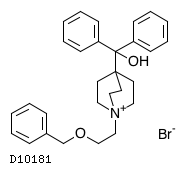
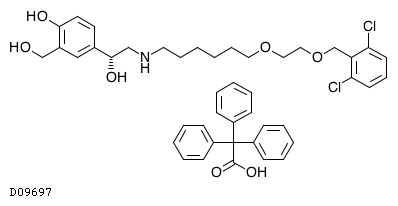
医薬品情報
| 総称名 | アノーロ |
|---|---|
| 一般名 | ウメクリジニウム臭化物 ビランテロールトリフェニル酢酸塩 |
| 欧文一般名 | Umeclidinium Bromide Vilanterol Trifenatate |
| 製剤名 | ウメクリジニウム臭化物・ビランテロールトリフェニル酢酸塩ドライパウダーインヘラー |
| 薬効分類名 | COPD治療配合剤 |
| 薬効分類番号 | 2259 |
| ATCコード | R03AL03 |
| KEGG DRUG |
D10533
ウメクリジニウム臭化物・ビランテロール
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第4版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アノーロエリプタ7吸入用 | ANORO ELLIPTA 7doses | グラクソ・スミスクライン | 2259806G1021 | 1412.8円/キット | 処方箋医薬品注) |
| アノーロエリプタ30吸入用 | ANORO ELLIPTA 30doses | グラクソ・スミスクライン | 2259806G2028 | 5445.1円/キット | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 閉塞隅角緑内障の患者[抗コリン作用により、眼圧が上昇し症状を悪化させるおそれがある。]
2.2 前立腺肥大等による排尿障害がある患者[抗コリン作用により、尿閉を誘発するおそれがある。][9.1.5参照]
2.3 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
5.1 本剤は慢性閉塞性肺疾患の症状の長期管理に用いること。
5.2 本剤は慢性閉塞性肺疾患の増悪時の急性期治療を目的として使用する薬剤ではない。[8.1参照]
5.3 本剤は気管支喘息治療を目的とした薬剤ではないため、気管支喘息治療の目的には使用しないこと。
6. 用法及び用量
通常、成人にはアノーロエリプタ1吸入(ウメクリジニウムとして62.5μg及びビランテロールとして25μg)を1日1回吸入投与する。
8. 重要な基本的注意
8.1 用法及び用量どおり正しく使用しても効果が認められない場合には、本剤が適当でないと考えられるので、漫然と投与を継続せず中止すること。[5.2参照]
8.2 本剤の吸入後に気管支痙攣があらわれることがある。そのような状態では、患者の生命が脅かされる可能性があるので、気管支痙攣が認められた場合には、直ちに本剤の投与を中止し、適切な処置を行うこと。
8.3 過度に本剤の使用を続けた場合、不整脈、場合により心停止を起こすおそれがあるので、用法及び用量を超えて投与しないよう注意すること。患者に対し、本剤の過度の使用による危険性を理解させ、本剤を1日1回なるべく同じ時間帯に吸入するよう(1日1回を超えて投与しないよう)注意を与えること。[13.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 甲状腺機能亢進症の患者
甲状腺機能亢進症の症状を悪化させるおそれがある。
9.1.2 心疾患を有する患者
抗コリン作用により心不全、心房細動、期外収縮が発現又は悪化するおそれがある。β2刺激作用により上室性頻脈、期外収縮等の不整脈が発現又は悪化するおそれがある。また、QT延長が発現するおそれがある。[11.1参照]
9.1.3 高血圧の患者
血圧を上昇させるおそれがある。
9.1.4 糖尿病の患者
血糖値をモニタリングするなど慎重に投与すること。高用量のβ2刺激剤を投与すると、血糖値が上昇するおそれがある。
9.1.5 前立腺肥大(排尿障害がある場合を除く)のある患者
排尿障害が発現するおそれがある。[2.2参照]
9.1.6 気管支喘息を合併した患者
気管支喘息の管理が十分行われるよう注意すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ビランテロールの高用量の吸入又は皮下投与により、ウサギの胎児に眼瞼開存、口蓋裂などの所見及び発育抑制が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ラットの授乳期にビランテロールを経口投与又はウメクリジニウムを皮下投与したとき、生後10日の出生児血漿中にビランテロール又はウメクリジニウムが検出された(それぞれ1/54及び2/54例)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら注意して投与すること。一般に、生理機能が低下している。
10. 相互作用
相互作用序文
ビランテロールは、主としてCYP3A4で代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| CYP3A4阻害作用を有する薬剤 リトナビル ケトコナゾール(経口剤:国内未発売) エリスロマイシン等 [16.7.1参照] | ケトコナゾール(経口剤)を併用した臨床薬理試験において、血中のビランテロールの曝露量の増加が認められたとの報告がある。 | CYP3A4による代謝が阻害されることにより、ビランテロールの血中濃度が上昇する可能性がある。 |
| β遮断薬 | ビランテロールの作用が減弱するおそれがある。 | β受容体においてビランテロールと競合する。 |
| QT間隔延長を起こすことが知られている薬剤 抗不整脈剤 三環系抗うつ剤等 [17.3.1参照] | QT間隔が延長され心室性不整脈等のリスクが増大するおそれがある。 | いずれもQT間隔を延長させる可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
心房細動(頻度不明)[9.1.2参照]
11.2 その他の副作用
| 0.5%以上 | 頻度不明 | |
| 過敏症 | 発疹、蕁麻疹、血管性浮腫 | |
| 感染症 | 咽頭炎 | |
| 精神神経系 | 振戦、味覚異常、頭痛 | |
| 循環器 | 頻脈、動悸 | |
| 呼吸器 | 咳嗽 | 発声障害、口腔咽頭痛 |
| 消化器 | 口内乾燥 | 便秘 |
| 筋骨格系 | 筋痙縮 | |
| 腎臓・泌尿器 | 排尿困難 | 尿閉 |
| 眼 | 眼圧上昇、霧視、眼痛 |
13. 過量投与
13.1 症状
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 吸入前
(1)患者に使用説明書を渡し、使用方法を指導すること。
(2)本剤は防湿のためアルミ包装されているので、使用開始直前にアルミ包装を開封するよう指導すること。
14.1.2 吸入時
本剤は口腔内への吸入投与にのみ使用すること(内服しても効果はみられない)。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人
健康成人75例にウメクリジニウム・ビランテロール(以下、UMEC・VI)125・25μg注)を1日1回10日間吸入投与した時、投与10日目の血漿中UMEC及びVIの濃度推移及び薬物動態パラメータは以下のとおりであった(外国人データ)。
図1 健康成人にUMEC・VI 125・25μgを1日1回10日間吸入投与した時の血漿中UMEC及びVIの濃度推移(平均値+標準偏差、74例)
| 測定薬物 | Cmax(pg/mL) | tmax(h)注1) | AUC0-τ(pg・h/mL) |
| UMEC | 334[294,379] | 0.10(0.08-0.15) | 495[431,569] |
| VI | 340[307,376] | 0.10(0.08-0.15) | 429[379,486] |
16.1.2 慢性閉塞性肺疾患患者
慢性閉塞性肺疾患患者にUMEC・VI 62.5・25μgを吸入投与した時の定常状態における曝露量について、母集団薬物動態解析を用いて算出された曝露量は以下のとおりであった。
| 患者 | 例数 | UMEC | VI | ||
| Cmax(pg/mL) | AUC0-τ(pg・h/mL) | Cmax(pg/mL) | AUC0-τ(pg・h/mL) | ||
| 日本人 | 20 | 79.4[64.8,99.7] | 365.3[299.2,450.4] | 126.8[103.1,160.6] | 677.3[568.7,806.2] |
| 外国人 | 390 | 68.0[64.5,71.6] | 305.4[291.3,320.6] | 127.9[121.8,134.6] | 609.2[584.9,633.9] |
16.2 吸収
健康成人9例にUMEC 1000μgを単回吸入投与した時のUMECの絶対的バイオアベイラビリティは12.8%であった(外国人データ)。
健康成人16例にVI 100μgをフルチカゾンフランカルボン酸エステル(以下、FF)800μgと併用で吸入投与した時のVIの絶対的バイオアベイラビリティは27.3%であった(外国人データ)。
16.3 分布
16.3.1 分布容積
健康成人6又は16例にそれぞれUMEC 65μg又はVI 55μgを静脈内投与した時の定常状態における分布容積の幾何平均値はそれぞれ86及び165Lであった(外国人データ)。
16.3.2 血漿蛋白結合率
In vitroでのUMEC及びVIのヒト血漿蛋白結合率は、それぞれ88.9及び93.9%であった。
16.3.3 血球移行
In vitroでのUMEC及びVI(いずれも50〜500ng/mL)のヒト血液/血漿比は、それぞれ0.541〜0.560及び0.73〜0.81であった。
16.4 代謝
In vitro試験において、UMEC及びVIはそれぞれ主にCYP2D6及びCYP3A4で代謝された。UMECの主な代謝経路は酸化(他に、水酸化及びO-脱アルキル化)であり、さらに抱合体(グルクロン酸抱合等)を生成し、VIからは主にO-脱アルキル化された代謝物が生成する。[10.参照]
16.5 排泄
健康成人6例に14C-UMEC 65μgを単回静脈内投与した時に放射能は主に代謝物として尿・糞中に排泄され、放射能の尿・糞中排泄率はそれぞれ約22及び58%であった(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能低下者
重度の腎機能低下者(CLcr:30mL/分未満)及び健康成人各9例にUMEC・VI 125・25μg注)を単回吸入投与した時のUMECのCmax及びAUC0-2は健康成人と比べてそれぞれ2%低下及び10%増加し、VIのCmax及びAUC0-1はそれぞれ3及び21%増加した1)(外国人データ)。
16.6.2 肝機能低下者
中等度の肝機能低下者(Child-PughスコアB)及び健康成人各9例にUMEC・VI 125・25μg注)を単回吸入投与した時のUMECのCmax及びAUC0-tは健康成人と比べてそれぞれ15及び6%低下し、VIのCmax及びAUC0-tはそれぞれ22及び26%低下した。重度の肝機能低下者にUMEC・VIを投与する試験は実施されていない2)(外国人データ)。
16.7 薬物相互作用
16.7.1 ケトコナゾール
16.7.2 その他の薬剤
健康成人16例にUMEC・VI 500・25μg注)とCYP3A4阻害作用及びP-gp阻害作用を有するベラパミル240mg(経口)を反復併用投与した時の血漿中薬物動態に及ぼす影響を検討した。その結果、UMECのCmax及びAUC0-τの平均値はそれぞれ11%低下及び37%増加し、VIのCmax及びAUC0-2の平均値はそれぞれ5及び14%増加した4)(外国人データ)。
注)本剤の承認用量は、UMEC・VI 62.5・25μg1日1回吸入投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第III相試験
慢性閉塞性肺疾患患者1532例(日本人患者68例を含む)を対象に実施したプラセボ対照無作為化二重盲検並行群間比較試験において、UMEC・VI 62.5・25μgを1日1回24週間投与した時のトラフFEV1値(L)は下表のとおりであった5)。
| UMEC・VI 62.5・25μg群 | UMEC 62.5μg群 | VI 25μg群 | プラセボ群 | ||
| 全体集団 | |||||
| トラフFEV1(L) | ベースライン | 1.282±0.556(413) | 1.199±0.488(417) | 1.247±0.485(421) | 1.200±0.469(280) |
| 投与24週後 | 1.461±0.557(330) | 1.357±0.516(322) | 1.358±0.492(317) | 1.226±0.475(201) | |
| 変化量 | 0.164±0.246(330) | 0.123±0.225(322) | 0.083±0.234(317) | 0.004±0.230(201) | |
| プラセボ群との差[95%信頼区間]注1) p値注1) | 0.167[0.128,0.207] p<0.001 | 0.115[0.076,0.155] p<0.001 | 0.072[0.032,0.112] p<0.001 | / | |
| UMEC・VI 62.5・25μgとの差[95%信頼区間]注1) p値注1) | / | 0.052[0.017,0.087] p=0.004 | 0.095[0.060,0.130] p<0.001 | / | |
| 日本人部分集団 | |||||
| トラフFEV1(L) | ベースライン | 0.890±0.328(20) | 1.118±0.349(18) | 1.094±0.450(18) | 1.204±0.508(12) |
| 投与24週後 | 1.079±0.342(19) | 1.329±0.453(13) | 1.184±0.509(18) | 1.286±0.564(8) | |
| 変化量 | 0.201±0.153(19) | 0.205±0.144(13) | 0.091±0.170(18) | −0.006±0.140(8) | |
| プラセボ群との差[95%信頼区間]注2) | 0.201[0.013,0.388] | 0.215[0.018,0.412] | 0.114[−0.076,0.303] | / | |
| UMEC・VI 62.5・25μgとの差[95%信頼区間]注2) | / | −0.014[−0.177,0.149] | 0.087[−0.067,0.241] | / | |
副作用発現頻度は、UMEC・VI 62.5・25μg群で6%(25/413例)であった。主な副作用は、頭痛1%未満(4/413例)であった。
17.1.2 国内第III相試験
慢性閉塞性肺疾患患者130例を対象に実施した52週間の国内長期投与試験において、UMEC・VI 125・25μg注)を1日1回投与したところ、治療期間を通しFEV1の改善が維持された6)。
副作用発現頻度は、6%(8/130例)であった。主な副作用は、高血圧2%(2/130例)であった。
17.3 その他
17.3.1 心電図に対する影響
注)本剤の承認用量は、UMEC・VI 62.5・25μg1日1回吸入投与である。
18. 薬効薬理
18.1 作用機序
UMECは長時間作用性の選択的ムスカリン受容体拮抗薬であり、気管支平滑筋に存在するムスカリン受容体へのアセチルコリンの結合を競合的に阻害することにより気管支平滑筋収縮を抑制する。
VIは長時間作用性β2刺激剤であり、アデニル酸シクラーゼを活性化し細胞内の環状アデノシン一リン酸を増加させることで、気管支平滑筋を弛緩させる。
18.2 ムスカリン受容体への作用
UMECはin vitroですべてのムスカリン受容体サブタイプ(M1〜M5受容体)に対して高い親和性を示し、UMECのM3受容体に対する拮抗作用は緩徐な回復性を示した。
18.3 気管支収縮に対する作用
UMECはモルモットへの単回気管内投与によりアセチルコリン誘発気管支収縮に対して長時間持続性の抑制作用を示した。
VIはモルモットへの単回噴霧投与によりヒスタミン誘発気管支収縮を持続的に抑制した。
19. 有効成分に関する理化学的知見
19.1. ウメクリジニウム臭化物
19.2. ビランテロールトリフェニル酢酸塩
22. 包装
<アノーロエリプタ7吸入用>
7吸入用[トレイ、乾燥剤入り]×1
<アノーロエリプタ30吸入用>
30吸入用[トレイ、乾燥剤入り]×1
23. 主要文献
- Mehta R,et al., Int J Chron Obstruct Pulmon Dis., 10, 15-23, (2015) »PubMed »DOI
- Mehta R,et al., Clin Ther., 36 (7), 1016-1027, (2014) »PubMed »DOI
- Kempsford R,et al., Br J Clin Pharmacol., 75 (6), 1478-1487, (2013) »PubMed »DOI
- Mehta R,et al., Int J Chron Obstruct Pulmon Dis., 8, 159-167, (2013) »PubMed »DOI
- Donohue JF,et al., Respir Med., 107 (10), 1538-1546, (2013) »PubMed »DOI
- 南方良章ほか, 呼吸, 33, 1037-1047, (2014)
- Kelleher D,et al., Pulm Pharmacol Ther., 29 (1), 49-57, (2014) »PubMed »DOI
24. 文献請求先及び問い合わせ先
文献請求先
グラクソ・スミスクライン株式会社
メディカル・インフォメーション
東京都港区赤坂1-8-1
電話:0120-561-007 (9:00〜17:45/土日祝日及び当社休業日を除く)
製品情報問い合わせ先
グラクソ・スミスクライン株式会社
メディカル・インフォメーション
東京都港区赤坂1-8-1
電話:0120-561-007 (9:00〜17:45/土日祝日及び当社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1