医薬品情報
| 総称名 | ボリコナゾール |
|---|---|
| 一般名 | ボリコナゾール |
| 欧文一般名 | Voriconazole |
| 薬効分類名 | 深在性真菌症治療剤 |
| 薬効分類番号 | 6179 |
| ATCコード | J02AC03 |
| KEGG DRUG |
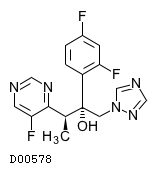
D00578
ボリコナゾール
|
| KEGG DGROUP |
DG01523
トリアゾール系抗真菌薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第5版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ボリコナゾール錠50mg「アメル」 (後発品) | Voriconazole Tablets「AMEL」 | 共和薬品工業 | 6179001F1058 | 138.8円/錠 | 劇薬, 処方箋医薬品 |
| ボリコナゾール錠100mg「アメル」 (後発品) | Voriconazole Tablets「AMEL」 | 共和薬品工業 | 6179001F3034 | 251.2円/錠 | 劇薬, 処方箋医薬品 |
| ボリコナゾール錠200mg「アメル」 (後発品) | Voriconazole Tablets「AMEL」 | 共和薬品工業 | 6179001F2054 | 457.9円/錠 | 劇薬, 処方箋医薬品 |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 次の薬剤を投与中の患者
リファンピシン、リファブチン、エファビレンツ、リトナビル、ロピナビル・リトナビル、ニルマトレルビル・リトナビル、カルバマゼピン、バルビタール、フェノバルビタール、ピモジド、キニジン、イバブラジン、麦角アルカロイド(エルゴタミン・無水カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、エルゴメトリン、メチルエルゴメトリン)、トリアゾラム、チカグレロル、アスナプレビル、ロミタピド、ブロナンセリン、スボレキサント、リバーロキサバン、アゼルニジピン、オルメサルタン メドキソミル・アゼルニジピン、ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期)、アナモレリン、ルラシドン、イサブコナゾニウム、フィネレノン、エプレレノン、ボクロスポリン、マバカムテン[10.1参照]
2.2 本剤の成分に対して過敏症の既往歴のある患者
2.3 妊婦又は妊娠している可能性のある患者[9.5参照]
4. 効能または効果
○下記の重症又は難治性真菌感染症
・フサリウム症
○造血幹細胞移植患者における深在性真菌症の予防
5. 効能または効果に関連する注意
<カンジダ感染の治療>
5.1 他の抗真菌剤が無効あるいは忍容性に問題があると考えられる場合に本剤の使用を考慮すること。
<造血幹細胞移植患者における深在性真菌症の予防>
5.2 真菌感染に高リスクの患者(好中球数が500/mm3未満に減少することが予測される患者など)を対象とすること。
6. 用法及び用量
| 成人(体重40kg以上) | 通常、ボリコナゾールとして初日は1回300mgを1日2回、2日目以降は1回150mg又は1回200mgを1日2回食間に経口投与する。なお、患者の状態に応じて、又は効果不十分の場合には、増量できるが、初日投与量の上限は1回400mg1日2回、2日目以降投与量の上限は1回300mg1日2回までとする。 |
| 成人(体重40kg未満) | 通常、ボリコナゾールとして初日は1回150mgを1日2回、2日目以降は1回100mgを1日2回食間に経口投与する。なお、患者の状態に応じて、又は効果不十分の場合には2日目以降の投与量を1回150mg1日2回まで増量できる。 |
| 小児(2歳以上12歳未満及び12歳以上で体重50kg未満) | ボリコナゾール注射剤による投与を行った後、通常、ボリコナゾールとして1回9mg/kgを1日2回食間に経口投与する。なお、患者の状態に応じて、又は効果不十分の場合には1mg/kgずつ増量し、忍容性が不十分の場合には1mg/kgずつ減量する(最大投与量として350mgを用いた場合は50mgずつ減量する)。 ただし、1回350mg1日2回を上限とする。 |
| 小児(12歳以上で体重50kg以上) | ボリコナゾール注射剤による投与を行った後、通常、ボリコナゾールとして1回200mgを1日2回食間に経口投与する。なお、患者の状態に応じて、又は効果不十分の場合には1回300mg1日2回まで増量できる。 |
7. 用法及び用量に関連する注意
<効能共通>
7.1 注射剤からボリコナゾールの投与を開始した成人患者において、経口投与可能であると医師が判断した場合は、錠剤又はドライシロップに切り替えることができる。
7.2 小児においては、注射剤からボリコナゾールの投与を開始すること。患者の状態に応じて、経口投与可能であると医師が判断した場合に、錠剤又はドライシロップに切り替えることができるが、投与開始から1週間未満で注射剤から経口剤に変更した際の有効性及び安全性は検討されていないため慎重に判断すること。なお、ボリコナゾール注射剤では食道カンジダ症の適応はないため、小児の食道カンジダ症に対する本剤の使用は推奨されない。[16.1.2参照]
7.3 腎機能障害のある患者で注射剤の投与ができない成人患者に対しては、錠剤又はドライシロップを使用すること。
<造血幹細胞移植患者における深在性真菌症の予防>
7.5 好中球数が500/mm3以上に回復する、又は免疫抑制剤の投与終了など、適切な時期に投与を終了すること。臨床試験において、180日を超えた投与の有効性及び安全性は検討されていない。
8. 重要な基本的注意
8.1 重篤な血液障害、重篤な腎障害、高カリウム血症があらわれることがあるので、本剤の投与に際しては定期的に血液検査、腎機能検査、血中電解質検査を行うなど観察を十分に行うこと。[11.1.6、11.1.9、11.1.16参照]
8.3 心電図QT延長、心室頻拍(torsade de pointesを含む)、心室細動、不整脈、完全房室ブロック、心室性二段脈、心室性期外収縮、頻脈等があらわれることがあるので、定期的に心電図検査を行うなど観察を十分に行うこと。[9.1.2、11.1.4参照]
8.4 本剤の投与に際しては、アレルギー既往歴、薬物過敏症等について十分な問診を行うこと。
8.5 視神経炎、視神経乳頭浮腫等の眼障害があらわれ、本剤投与中止後も羞明、霧視、視覚障害等の症状が持続することがあるので、本剤投与中及び投与中止後もこれらの症状が回復するまでは、自動車の運転等危険を伴う機械の操作には従事させないように十分注意すること。また、本剤を投与する患者にはあらかじめ説明し、必要に応じて眼科専門医を受診するよう指導すること。[1.3、11.2参照]
8.6 光線過敏性反応があらわれることがあるので、本剤投与中は長袖の衣服、帽子等の着用により日光の照射を避け、日焼け止め効果の高いサンスクリーンの使用により紫外線の照射を避けること。本剤投与中に光線過敏性反応があらわれた場合は、本剤の投与を中止すること。やむを得ず投与を継続する場合は、皮膚科医を定期的に受診するよう指導し、日光角化症などの前癌病変の早期発見に留意すること。[15.1.3参照]
8.7 投与期間中は血中濃度をモニタリングすることが望ましい。[15.1.1参照]
8.8 本剤投与開始にあたっては、あらかじめワルファリン服用の有無を確認し、ワルファリンと併用する場合は、プロトロンビン時間測定及びトロンボテストの回数を増やすなど慎重に投与すること。[10.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 薬物過敏症の既往歴のある患者(ただし、本剤に対して過敏症の既往歴のある患者には投与しないこと)
9.1.2 不整脈を有する患者及び不整脈を発現しやすい状態にある患者
9.3 肝機能障害患者
9.3.1 重度の肝機能低下(Child Pugh分類クラスCの肝硬変に相当)のある患者
定期的に検査を行うなど観察を十分に行うこと。薬物動態、安全性は検討されていない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。ラット10mg/kg以上投与において催奇形性(口蓋裂、水腎症/尿管水腫)、ウサギ100mg/kg投与において胎児毒性(胎児死亡率増加、骨格変異等)が認められた。[2.3参照]
9.6 授乳婦
9.7 小児等
9.7.1 低出生体重児、新生児、乳児又は2歳未満の幼児を対象とした臨床試験は実施していない。
9.7.2 日光の照射を避けること。皮膚弾力性の低下、色素の沈着や脱失等の光老化が認められた場合は、投与中止後も観察を行うことが望ましい。小児で光線過敏性反応及び皮膚扁平上皮癌が発現した報告がある。
9.7.3 投与に際しては観察を十分に行うこと。小児を対象とした海外臨床試験では、成人と比べ肝酵素上昇の発現頻度が高いことが報告されている。
9.7.4 用量を増減する時には、患者の状態を十分に観察し、効果及び副作用の発現を考慮して、必要最小限の増量又は減量にとどめること。ただし、原則として、投与開始後及び増量後、少なくとも3日間は増量しないこと。
9.8 高齢者
用量に留意するなど慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
相互作用序文
薬物代謝酵素用語
CYP2C19
薬物代謝酵素用語
CYP2C9
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP3A
10.1 併用禁忌
| リファンピシン (リマクタン、アプテシン、リファジン) [2.1参照] | リファンピシンとの併用により、本剤のCmaxは93%、AUCは96%減少した3)。 | リファンピシンは、本剤の代謝酵素(CYP3A4)を誘導する。 |
| リファブチン (ミコブティン) [2.1参照] | リファブチンとの併用により、本剤のCmaxは69%、AUCは78%減少した3)。 | リファブチンは、本剤の代謝酵素(CYP3A4)を誘導する。 |
| リファブチン (ミコブティン) [2.1参照] | 本剤との併用によりリファブチンのCmaxは3.0倍、AUCは4.3倍増加した4)。 | 本剤はリファブチンの代謝酵素(CYP3A4)を阻害する。 |
| エファビレンツ (ストックリン) [2.1参照] | エファビレンツとの併用により、本剤のCmaxは61%、AUCは77%減少した5)。 | エファビレンツは、本剤の代謝酵素(CYP2C19及びCYP2C9)を誘導する。 |
| エファビレンツ (ストックリン) [2.1参照] | 本剤との併用によりエファビレンツのCmaxは1.4倍、AUCは1.4倍増加した5)。 | 本剤はエファビレンツの代謝酵素(CYP3A4)を阻害する。 |
| リトナビル (ノービア) ロピナビル・リトナビル (カレトラ) ニルマトレルビル・リトナビル (パキロビッドパック) [2.1参照] | リトナビルとの併用により、本剤のCmaxは66%、AUCは82%減少した6)。 | リトナビルは、本剤の代謝酵素(CYP2C19及びCYP2C9)を誘導する。 |
| カルバマゼピン (テグレトール) 長時間作用型バルビツール酸誘導体 バルビタール フェノバルビタール (フェノバール) [2.1参照] | これらの薬剤との併用により、本剤の代謝が促進され血中濃度が減少するおそれがある。 | これらの薬剤は、本剤の代謝酵素(CYP3A4)を誘導する。 |
| ピモジド (オーラップ) キニジン [2.1参照] | 本剤との併用により、これらの薬剤の血中濃度が増加し、QT延長、心室性不整脈(torsade de pointesを含む)などの心血管系の副作用を引き起こすおそれがある。 | 本剤はこれらの薬剤の代謝酵素(CYP3A4)を阻害する。 |
| イバブラジン (コララン) [2.1参照] | 本剤との併用により、イバブラジンの血中濃度が増加し、過度の徐脈があらわれるおそれがある。 | 本剤はイバブラジンの代謝酵素(CYP3A)を阻害する。 |
| 麦角アルカロイド エルゴタミン・無水カフェイン・イソプロピルアンチピリン (クリアミン配合錠) ジヒドロエルゴタミン エルゴメトリン メチルエルゴメトリン (パルタンM) [2.1参照] | 本剤との併用により、これらの薬剤の血中濃度が増加し、麦角中毒を引き起こすおそれがある。 | 本剤はこれら薬剤の代謝酵素(CYP3A4)を阻害する。 |
| トリアゾラム (ハルシオン) [2.1参照] | 本剤との併用により、トリアゾラムの血中濃度が増加し、作用の増強や作用時間延長を引き起こすおそれがある。 | 本剤はトリアゾラムの代謝酵素(CYP3A4)を阻害する。 |
| チカグレロル (ブリリンタ) [2.1参照] | 本剤との併用により、チカグレロルの血中濃度が上昇し、血小板凝集抑制作用が増強するおそれがある。 | 本剤はチカグレロルの代謝酵素(CYP3A)を阻害する。 |
| アスナプレビル (スンベプラ) [2.1参照] | 本剤との併用により、アスナプレビルの血中濃度が上昇し、肝臓に関連した有害事象が発現、又は重症化するおそれがある。 | 本剤はアスナプレビルの代謝酵素(CYP3A)を阻害する。 |
| ロミタピド (ジャクスタピッド) [2.1参照] | 本剤との併用により、ロミタピドの血中濃度が上昇するおそれがある。 | 本剤はロミタピドの代謝酵素(CYP3A)を阻害する。 |
| ブロナンセリン (ロナセン) [2.1参照] | 本剤との併用により、ブロナンセリンの血中濃度が上昇し、作用が増強するおそれがある。 | 本剤はブロナンセリンの代謝酵素(CYP3A4)を阻害する。 |
| スボレキサント (ベルソムラ) [2.1参照] | 本剤との併用により、スボレキサントの血中濃度が上昇し、作用が増強するおそれがある。 | 本剤はスボレキサントの代謝酵素(CYP3A)を阻害する。 |
| リバーロキサバン (イグザレルト) [2.1参照] | 本剤との併用により、リバーロキサバンの血中濃度が上昇し、抗凝固作用が増強することにより、出血の危険性が増大するおそれがある。 | 本剤はリバーロキサバンの代謝酵素(CYP3A4)を阻害する。 |
| アゼルニジピン (カルブロック) オルメサルタン メドキソミル・アゼルニジピン (レザルタス) [2.1参照] | 本剤との併用により、アゼルニジピンの血中濃度が上昇するおそれがある。 | 本剤はアゼルニジピンの代謝酵素(CYP3A4)を阻害する。 |
| ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期) (ベネクレクスタ) [2.1参照] | 本剤との併用により、ベネトクラクスの血中濃度が増加し、腫瘍崩壊症候群の発現が増強されるおそれがある。 | 本剤はベネトクラクスの代謝酵素(CYP3A)を阻害する。 |
| アナモレリン (エドルミズ) [2.1参照] | 本剤との併用により、アナモレリンの血中濃度が増加し、副作用の発現が増強されるおそれがある。 | 本剤はアナモレリンの代謝酵素(CYP3A4)を阻害する。 |
| ルラシドン (ラツーダ) [2.1参照] | 本剤との併用により、ルラシドンの血中濃度が上昇し、作用が増強するおそれがある。 | 本剤はルラシドンの代謝酵素(CYP3A4)を阻害する。 |
| イサブコナゾニウム (クレセンバ) [2.1参照] | 本剤との併用により、イサブコナゾールの血中濃度が上昇し、作用が増強するおそれがある。 | 本剤はイサブコナゾールの代謝酵素(CYP3A)を阻害する。 |
| フィネレノン (ケレンディア) [2.1参照] | 本剤との併用により、フィネレノンの血中濃度が上昇し、作用が増強するおそれがある。 | 本剤はフィネレノンの代謝酵素(CYP3A4)を阻害する。 |
| エプレレノン (セララ) [2.1参照] | 本剤との併用により、エプレレノンの血中濃度が上昇し、作用が増強するおそれがある。 | 本剤はエプレレノンの代謝酵素(CYP3A4)を阻害する。 |
| ボクロスポリン (ルプキネス) [2.1参照] | 本剤との併用により、ボクロスポリンの血中濃度が上昇し、作用が増強するおそれがある。 | 本剤はボクロスポリンの代謝酵素(CYP3A4)を阻害する。 |
| マバカムテン (カムザイオス) [2.1参照] | 本剤との併用により、マバカムテンの血中濃度が上昇し、副作用が増強され、収縮機能障害による心不全のリスクが高まるおそれがある。 | 本剤はマバカムテンの代謝酵素(CYP3A4)を阻害する。 |
10.2 併用注意
| ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の維持投与期、急性骨髄性白血病) | 本剤との併用により、ベネトクラクスの血中濃度が増加するおそれがある。 ベネトクラクスを減量するとともに、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | 本剤はベネトクラクスの代謝酵素(CYP3A)を阻害する。 |
| バレメトスタット | 本剤との併用により、バレメトスタットの血中濃度が増加するおそれがある。 バレメトスタットを減量するとともに、患者の状態を慎重に観察し、副作用の発現に十分注意すること。 | 本剤はバレメトスタットの代謝酵素(CYP3A)を阻害する。 |
| 抗てんかん薬 フェニトイン | フェニトインとの併用により、本剤のCmaxは49%、AUCは69%減少した7)。 | フェニトインは、本剤の代謝酵素(CYP3A4)を誘導する。 |
| 抗てんかん薬 フェニトイン | 本剤との併用により、フェニトインのCmaxは1.7倍、AUCは1.8倍増加した7)。 | 本剤はフェニトインの代謝酵素(CYP2C9)を阻害する。 |
| レテルモビル | レテルモビルとの併用により、本剤のCmaxは39%、AUC0-12は44%減少した。 | レテルモビルは本剤の代謝酵素(CYP2C19及びCYP2C9)を誘導すると考えられる。 |
| レテルモビル | レテルモビルとの併用により、作用が減弱するおそれがある。 | レテルモビルは本剤の代謝酵素(CYP2C19及びCYP2C9)を誘導すると考えられる。 |
| チロシンキナーゼ阻害剤 ボスチニブ、ニロチニブ、イブルチニブ、ラロトレクチニブ、ロルラチニブ | 本剤との併用により、これらの薬剤の血中濃度が増加するおそれがあるため、代替薬への変更を考慮すること。 | 本剤はこれらの薬剤の代謝酵素(CYP3A)を阻害する。 |
| HIVプロテアーゼ阻害薬 ホスアンプレナビル | 本剤との併用により、ホスアンプレナビルの活性代謝物であるアンプレナビルの血中濃度が増加するおそれがある。 | In vitro試験結果において、本剤はアンプレナビルの代謝酵素(CYP3A4)を阻害した8)。 |
| HIVプロテアーゼ阻害薬 ホスアンプレナビル | ホスアンプレナビルとの併用により、本剤の血中濃度が増加するおそれがある。 | In vitro試験において、アンプレナビルは本剤の代謝酵素(CYP3A4)を阻害した8)。 |
| 非ヌクレオシド逆転写酵素阻害薬(NNRTI) デラビルジン | これらの薬剤との併用により、本剤の血中濃度が増加するおそれがある。 | In vitro試験結果において、これらの薬剤は本剤の代謝酵素(CYP3A4)を阻害した9)。 |
| 非ヌクレオシド逆転写酵素阻害薬(NNRTI) デラビルジン | これらの薬剤との併用により、本剤の血中濃度が減少するおそれがある。 | これらの薬剤は本剤の代謝酵素(CYP3A4)を誘導するおそれがある。 |
| 非ヌクレオシド逆転写酵素阻害薬(NNRTI) デラビルジン | 本剤との併用により、これらの薬剤の血中濃度が増加するおそれがある。 | In vitro試験結果において、本剤はこれらの薬剤の代謝酵素(CYP3A4)を阻害した9)。 |
| トレチノイン | 本剤との併用により、トレチノインの血中濃度が増加するおそれがある。 | 本剤はトレチノインの代謝酵素(CYP)を阻害する。 |
| 免疫抑制剤 シクロスポリン、タクロリムス、エベロリムス | 本剤との併用により、シクロスポリンのCmaxは1.1倍に、AUCは1.7倍に増加した10)。 | 本剤はこれらの薬剤の代謝酵素(CYP3A4)を阻害する。 |
| 免疫抑制剤 シクロスポリン、タクロリムス、エベロリムス | 本剤との併用により、タクロリムスのCmaxは2.2倍に、AUCは3.2倍に増加した11)。 | 本剤はこれらの薬剤の代謝酵素(CYP3A4)を阻害する。 |
| 免疫抑制剤 シクロスポリン、タクロリムス、エベロリムス | 本剤との併用により、エベロリムスの血中濃度が増加するおそれがある。 | 本剤はこれらの薬剤の代謝酵素(CYP3A4)を阻害する。 |
| クマリン系抗凝血薬 ワルファリンカリウム [8.8参照] | 本剤との併用により、プロトロンビン時間が1.9倍延長した12)。また、ワルファリンの作用が増強し、著しいINR上昇を来した症例が報告されている。 | 本剤はワルファリンの代謝酵素(CYP2C9)を阻害する。 |
| プロトンポンプ阻害薬 オメプラゾール | 本剤との併用により、オメプラゾールのCmaxは2.2倍、AUCは3.8倍増加した13)。 | 本剤はオメプラゾールの代謝酵素(CYP2C19及びCYP3A4)を阻害する。 |
| ミダゾラム | 本剤との併用により、ミダゾラム0.05mg/kg単回静脈内投与時のミダゾラムのAUCは3.7倍に増加し、ミダゾラム7.5mg単回経口投与時(本邦未承認)のミダゾラムのCmaxは3.8倍に、AUCは10.3倍に増加した15)。 | 本剤はミダゾラムの代謝酵素(CYP3A4)を阻害する14)。 |
| HMG-CoA還元酵素阻害薬 | 本剤との併用により、HMG-CoA還元酵素阻害薬の血中濃度が増加するおそれがある。 | In vitro試験において、本剤はHMG-CoA還元酵素阻害薬の代謝酵素(CYP3A4)を阻害した9)。 |
| ジアゼパム | 本剤との併用により、ジアゼパムのAUCは増加し、血中濃度半減期は延長した16)。 | 本剤はジアゼパムの代謝酵素(CYP3A4及びCYP2C19)を阻害する。 |
| ゾルピデム | 本剤との併用により、ゾルピデムのCmaxは1.2倍、AUCは1.5倍増加した17)。 | 本剤はゾルピデムの代謝酵素(CYP3A4及びCYP2C9)を阻害する。 |
| スルホニル尿素系血糖降下薬 トルブタミド | 本剤との併用により、これらの薬剤の血中濃度が増加するおそれがある。 | 本剤はこれらの薬剤の代謝酵素(CYP2C9)を阻害する。 |
| ビンカアルカロイド系抗悪性腫瘍薬 ビンクリスチン ビンブラスチン | 本剤との併用により、これらの薬剤の血中濃度が増加するおそれがある。 | 本剤はこれらの薬剤の代謝酵素(CYP3A4)を阻害する。 |
| メサドン | 本剤との併用により、メサドンのCmaxが30.7%、AUCが47.2%増加した。 | 本剤はこれらの薬剤の代謝酵素(CYP3A4)を阻害する。 |
| オキシコドン | 本剤との併用により、オキシコドンのCmaxとAUCが増加した18)。 | 本剤はこれらの薬剤の代謝酵素(CYP3A4)を阻害する。 |
| フェンタニル | 本剤との併用により、フェンタニルのAUCが増加した19)。 | 本剤はこれらの薬剤の代謝酵素(CYP3A4)を阻害する。 |
| イブプロフェン、ジクロフェナク | 本剤との併用により、これらの薬剤のCmaxとAUCが増加した20)21)。 | 本剤はこれらの薬剤の代謝酵素(CYP2C9)を阻害する。 |
| 経口避妊薬 ノルエチステロン・エチニルエストラジオール | ノルエチステロン・エチニルエストラジオールとの併用により、本剤のCmaxは14%、AUCは46%増加した。 | これらの薬剤は本剤の代謝酵素(CYP2C19)を阻害する。 |
| 経口避妊薬 ノルエチステロン・エチニルエストラジオール | 本剤との併用により、エチニルエストラジオールのCmaxは36%、AUCは61%増加し、ノルエチステロンのCmaxは15%、AUCは53%増加した。 | 本剤はこれらの薬剤の代謝酵素(CYP3A4)を阻害する。 |
| リオシグアト | 本剤との併用により、リオシグアトの血中濃度が上昇するおそれがある。本剤との併用が必要な場合は、患者の状態に注意し、必要に応じてリオシグアトの減量を考慮すること。 | 本剤はリオシグアトの代謝酵素(CYP3A)を阻害する。 |
| セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品 | セイヨウオトギリソウとの併用により、本剤のAUCは59%減少した22)。本剤投与時はセイヨウオトギリソウ含有食品を摂取しないよう注意すること。 | セイヨウオトギリソウは、本剤の代謝酵素(CYP3A4)を誘導する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)、アナフィラキシー(頻度不明)
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)、多形紅斑(頻度不明)
皮疹等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.3 肝障害(5.0%)
11.1.4 心電図QT延長(頻度不明)、心室頻拍(1.0%)、心室細動(頻度不明)、不整脈(頻度不明)、完全房室ブロック(頻度不明)
11.1.5 心不全(3.0%)
心機能に関する異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.6 腎障害(1.0%)
重篤な腎障害(急性腎障害、腎炎、腎尿細管壊死等)があらわれることがある。[8.1参照]
11.1.7 呼吸窮迫症候群(頻度不明)
11.1.8 ギラン・バレー症候群(頻度不明)
11.1.9 血液障害(2.0%)
骨髄抑制、汎血球減少、再生不良性貧血、無顆粒球症、播種性血管内凝固等の重篤な血液障害があらわれることがある。[8.1参照]
11.1.10 偽膜性大腸炎(頻度不明)
偽膜性大腸炎等の重篤な大腸炎があらわれることがあるので、腹痛、下痢があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.11 痙攣(頻度不明)
痙攣等の神経障害があらわれることがある。
11.1.12 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがある。
11.1.13 間質性肺炎(0.2%注))
咳嗽、呼吸困難、発熱、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施し、本剤の投与を中止するとともに、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.14 低血糖(頻度不明)
重篤な低血糖があらわれることがある。
11.1.15 意識障害(0.1%注))
意識消失、意識レベルの低下等の意識障害があらわれることがある。
11.1.16 高カリウム血症(1.0%)[8.1参照]
注:発現頻度は使用成績調査の結果に基づいている。
発現頻度は重症又は難治性真菌感染症の承認時の国内臨床試験の結果に基づいている。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満a) | 頻度不明 | |
| 血液及びリンパ系障害 | 白血球減少症、血小板減少症 | 貧血、リンパ節症 | ||
| 心臓障害 | 動悸、心嚢液貯留 | 肺水腫、脚ブロック | ||
| 耳・迷路障害 | 聴覚過敏、耳鳴、回転性眩暈 | |||
| 内分泌障害 | ADH不適合分泌 | 副腎皮質機能不全、甲状腺機能亢進症、甲状腺機能低下症 | ||
| 眼障害 | 羞明b)、霧視b)、視覚障害b) | 眼の異常感、調節障害、色覚異常、複視、眼瞼浮腫、流涙増加、縮瞳、視神経乳頭浮腫、光視症、網膜滲出物、網膜出血、網膜毛細血管瘤、網膜裂孔、網膜血管炎、黄視症 | 眼瞼炎、視神経炎、強膜炎、角膜混濁、視神経萎縮 | |
| 胃腸障害 | 悪心、嘔吐 | 腹部膨満、口唇のひび割れ、便秘、下痢、消化不良、胃潰瘍、痔核、イレウス、口唇乾燥、口唇粘膜脱落、口唇炎、逆流性食道炎、口内炎 | 腹痛、胃腸炎、十二指腸炎、歯肉炎、舌炎、膵炎、舌浮腫、腹膜炎 | |
| 全身障害及び投与局所様態 | 無力症、胸痛、胸部圧迫感、異常感、倦怠感、末梢性浮腫、発熱、口渇 | 悪寒、注射部位反応/炎症、インフルエンザ症候群 | ||
| 肝胆道系障害 | 胆嚢炎、胆石症、肝腫大 | |||
| 感染症及び寄生虫症 | 副鼻腔炎 | |||
| 代謝及び栄養障害 | 食欲不振 | 高血糖、低カリウム血症 | 低ナトリウム血症 | 高コレステロール血症 |
| 筋骨格及び結合組織障害 | 背部痛、四肢痛 | 関節炎 | 骨膜炎 | |
| 神経系障害 | 頭痛 | 認知不能症、健忘、浮動性めまい、味覚異常、感覚減退、傾眠、会話障害、振戦、視野欠損 | 末梢性ニューロパチー | 錯感覚、失調、脳浮腫、筋緊張亢進、眼振、失神、注視痙攣、錐体外路症候群 |
| 精神障害 | 不眠症 | 錯乱状態、幻覚、幻聴、幻視 | 不安 | うつ病、激越 |
| 腎及び尿路障害 | 血尿、アルブミン尿 | |||
| 呼吸器、気管支及び縦隔障害 | 喀血 | |||
| 皮膚及び皮下組織障害 | 皮膚乾燥、湿疹、紅斑、結節性紅斑、発疹、毛髪変色、光線過敏性反応、多汗、そう痒症、丘疹、皮膚落屑 | 蕁麻疹 | 顔面浮腫、斑状丘疹状皮疹、脱毛症、剥脱性皮膚炎、紫斑、固定薬疹、乾癬、血管浮腫、皮膚エリテマトーデス、偽性ポルフィリン症 | |
| 血管障害 | 潮紅 | 低血圧、血栓性静脈炎、静脈炎、リンパ管炎 | ||
| 臨床検査 | ALT増加、AST増加、ALP増加、γ-GTP増加 | 血中ビリルビン増加、血中カルシウム増加、血中クレアチニン増加、LDH増加、血中カリウム減少、血中カリウム増加、血圧低下、血圧上昇、フィブリンDダイマー増加、血清FDP増加、膵アミラーゼ増加、好酸球増加、血小板数減少 | BUN増加 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 外国人患者において、ボリコナゾールの血漿中濃度と肝機能検査値異常発現率の間に統計的に有意な関連性が認められた。日本人健康成人においては、肝機能障害が発生した症例で、かつ、血漿中濃度が測定されていた症例の血漿中濃度トラフ値はいずれも4.5μg/mL以上であった。また、国内臨床試験では有効性及び安全性に応じた投与量の調整に加え、目安としてトラフ血漿中濃度が4.5μg/mL以上の場合、必要に応じて投与量を減量する血中濃度モニタリングを実施した。国内外の臨床試験データからは肝機能検査値異常の出現を予測する血漿中濃度の閾値は認められていない。[7.4、8.7参照]
15.1.2 肺移植あるいは心肺移植患者を対象とした海外の観察研究において、本剤曝露患者では皮膚扁平上皮癌の発生リスクがアゾール系抗真菌薬非曝露患者と比較して有意に高く(ハザード比:2.39、95%信頼区間1.31-4.37)、この発生リスクは180日を超える長期曝露の患者で高い(ハザード比:3.52、95%信頼区間1.59-7.79)との報告がある23)。
15.1.3 本剤投与後に、皮膚扁平上皮癌及び悪性黒色腫が発生したとの報告がある。また、本剤長期投与中に、光線過敏性反応を発現している患者で皮膚扁平上皮癌及び悪性黒色腫が発生したとの報告がある。[8.6参照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人男性(各用量6例)に、ボリコナゾール100、200、300及び400mgを空腹時に単回経口投与したとき、消失半減期は用量に依存して延長し、AUC及びCmaxは用量に対して非線形の増加を示した24)。
| 投与量(mg) | Cmax(μg/mL) | Tmax(hr) | AUC(μg・hr/mL) | T1/2(hr) |
| 100 | 0.39(54) | 1.2(33) | 1.82(101) | 4.8(42) |
| 200 | 0.91(41) | 1.6(44) | 5.12(70) | 6.1(41) |
| 300 | 1.80(8) | 1.3(23) | 11.58(41) | 6.8(31) |
| 400 | 2.88(26) | 2.0(0) | 31.01(62) | 11.9(51) |
16.1.2 反復投与
(1)健康成人
ボリコナゾールは、主にCYP2C19により代謝される。CYP2C19には遺伝子多型が存在するため、遺伝子のタイプにより標準的(EM:Extensive Metabolizer)、やや低い(HEM:Heterozygous Extensive Metabolizer)及び低い(PM:Poor Metabolizer)酵素活性を有する被験者に分けて解析した。
日本人健康成人男性に、ボリコナゾール1回200mgを1日2回反復経口投与(負荷投与:初日に1回400mgを1日2回)したところ、EM及びHEMで2日目、PMで3日目にほぼ定常状態に達した25)。
日本人健康成人男性に、ボリコナゾール1回200mgを1日2回反復経口投与(負荷投与:初日に1回400mgを1日2回)したところ、EM及びHEMで2日目、PMで3日目にほぼ定常状態に達した25)。
| CYP2C19遺伝子型 | 例数 | Cmax(μg/mL) | AUCτ(μg・hr/mL) | Tmax(hr) | T1/2(hr) |
| EM | 5 | 2.15(30) | 12.02(45) | 1.4(39) | 6.1(15) |
| HEM | 5 | 3.36(24) | 20.01(37) | 1.6(68) | 6.1(14) |
| PM | 10 | 6.87(14) | 65.05(17) | 1.6(47) | 9.0(12) |
(2)小児患者
日本人小児患者(3〜14歳、18例)にボリコナゾール1回8mg/kgを1日2回(負荷投与:初日に1回9mg/kgを1日2回)7日間静脈内投与した後、ドライシロップとして1回9mg/kgを1日2回7日間反復経口投与したときの最終投与後のCmax及びAUCτの幾何平均値(範囲)はそれぞれ7.22(2.03〜18.3)μg/mL及び45.8(10.0〜156)μg・hr/mLであった26)。[7.2参照]
| CYP2C19遺伝子型 | 例数 | Cmax(μg/mL)a) | AUCτ(μg・hr/mL)a) | Tmax(hr)b) |
| EM | 6 | 5.49(2.03-11.0) | 31.2(10.0-80.8) | 1.5(0.95-3.8) |
| HEM | 10 | 7.66(4.45-18.3) | 49.3(14.5-156) | 1.1(0.92-2.2) |
| PM | 2 | 12.3(11.6,13.0) | 99.1(84.0,117) | 1.0(0.95,1.1) |
| 全例 | 18 | 7.22(2.03-18.3) | 45.8(10.0-156) | 1.0(0.92-3.8) |
12歳以上15歳未満で体重50kg以上の小児1例には、成人と同様にボリコナゾール1回4mg/kgを1日2回(負荷投与:初日に1回6mg/kgを1日2回)7日間静脈内投与した後、1回200mgを1日2回7日間反復経口投与した。
CYP2C19遺伝子型は、以下の遺伝子型より予測される表現型である。
EM:CYP2C19*1/*1又はCYP2C19*1/*17
HEM:CYP2C19*1/*2又はCYP2C19*1/*3
PM:CYP2C19*2/*2、CYP2C19*2/*3又はCYP2C19*3/*3
16.1.3 生物学的同等性試験
ボリコナゾール錠200mg「アメル」とブイフェンド錠200mgを、クロスオーバー法によりそれぞれ1錠(ボリコナゾールとして200mg)健康成人男子(肝代謝酵素であるCYP2C19の活性が低い被験者(PM:Poor Metabolizer)を除く)に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った。その結果、AUCはlog(0.80)〜log(1.25)の範囲内であり、Cmaxについては判定パラメータの対数値の平均値の差がlog(0.90)〜log(1.11)で、かつ、溶出試験で規定するすべての条件で溶出挙動が類似していたことから、両剤の生物学的同等性が確認された27)。
| 判定パラメータ | 参考パラメータ | |||
| AUC(0→30)(μg・hr/mL) | Cmax(μg/mL) | Tmax(hr) | T1/2(hr) | |
| ボリコナゾール錠200mg「アメル」 | 5.57±1.98 | 1.31±0.48 | 1.65±0.98 | 6.27±0.92 |
| ブイフェンド錠200mg | 5.52±1.86 | 1.33±0.39 | 1.49±0.91 | 6.11±1.19 |
血漿中未変化体濃度(生物学的同等性)
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 バイオアベイラビリティ
16.2.2 食事の影響
健康成人男性(37例)において、高脂肪食(約1000kcal)を取った直後にボリコナゾール200mgを1日2回7日間反復経口投与したとき、定常状態におけるCmax及びAUCτは空腹時投与と比較し、それぞれ34%及び24%低下した。Tmaxは食事により1.4時間遅延した30)(外国人データ)。
16.3 分布
健康成人のボリコナゾールの定常状態における分布容積は4.6L/kgと推定された28)(日本人及び外国人データ)。
16.3.1 組織内移行
ボリコナゾール投与後1〜10時間の血漿中ボリコナゾール濃度に対する髄液中ボリコナゾール濃度の比は0.22〜1.0(中央値0.46)であった31)(外国人データ)。
16.3.2 蛋白結合率
ボリコナゾールのヒト血漿蛋白に対する結合率は、58%であった32)。
16.4 代謝
16.5 排泄
ボリコナゾールは、肝代謝により消失し、単回投与後96時間までに尿中に未変化体として投与量の2%未満が排泄される32)。
16.6 特定の背景を有する患者
16.6.1 肝機能の低下した被験者
16.6.2 腎機能の低下した被験者
16.8 その他
ボリコナゾール錠50mg「アメル」及びボリコナゾール錠100mg「アメル」について、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成24年2月29日 薬食審査発0229第10号)」に基づき、ボリコナゾール錠200mg「アメル」を標準製剤としたとき、溶出挙動が同等と判断され、生物学的に同等とみなされた37)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<重症又は難治性真菌感染症>
17.1.1 国内第III相試験(1501001試験)
深在性真菌症と診断された患者又は深在性真菌症が強く疑われた患者を対象とし、100例(経口療法61例、静注療法18例、スイッチ療法21例)にボリコナゾールを投与した。
経口療法の場合は、投与初日に負荷用量として300mgを1日2回(体重40kg未満の場合は150mgを1日2回)、その後は維持用量として200mgを1日2回(体重40kg未満の場合は100mgを1日2回)経口投与した。ただし、投与開始3日目の血漿中ボリコナゾール濃度が2.5μg/mL以上のときは、投与開始5日目以降は150mgを1日2回経口投与へ減量した。
静注療法の場合は、重篤な真菌症の場合は、投与初日に負荷用量として6mg/kgを1日2回、その後は維持用量として4mg/kgを1日2回静脈内投与した。ただし、投与開始3日目の血漿中ボリコナゾール濃度が2.5μg/mL以上のときは、投与開始5日目以降は3mg/kgを1日2回静脈内投与に減量した。重篤な真菌症以外の場合は、投与初日に負荷用量として6mg/kgを1日2回、その後は維持用量として3mg/kgを1日2回静脈内投与した。静注療法を3日間行った後、治験責任医師により経口療法が可能と判断された患者においては経口療法への切り替え(スイッチ療法)を可能とし、投与開始3日目の血漿中濃度が2.5μg/mL未満のときは200mgを1日2回、2.5μg/mL以上のときは150mgを1日2回経口投与した。
投与終了時(最大投与期間12週間)の総合効果有効率は、以下の通りであった。
経口療法の場合は、投与初日に負荷用量として300mgを1日2回(体重40kg未満の場合は150mgを1日2回)、その後は維持用量として200mgを1日2回(体重40kg未満の場合は100mgを1日2回)経口投与した。ただし、投与開始3日目の血漿中ボリコナゾール濃度が2.5μg/mL以上のときは、投与開始5日目以降は150mgを1日2回経口投与へ減量した。
静注療法の場合は、重篤な真菌症の場合は、投与初日に負荷用量として6mg/kgを1日2回、その後は維持用量として4mg/kgを1日2回静脈内投与した。ただし、投与開始3日目の血漿中ボリコナゾール濃度が2.5μg/mL以上のときは、投与開始5日目以降は3mg/kgを1日2回静脈内投与に減量した。重篤な真菌症以外の場合は、投与初日に負荷用量として6mg/kgを1日2回、その後は維持用量として3mg/kgを1日2回静脈内投与した。静注療法を3日間行った後、治験責任医師により経口療法が可能と判断された患者においては経口療法への切り替え(スイッチ療法)を可能とし、投与開始3日目の血漿中濃度が2.5μg/mL未満のときは200mgを1日2回、2.5μg/mL以上のときは150mgを1日2回経口投与した。
投与終了時(最大投与期間12週間)の総合効果有効率は、以下の通りであった。
| 菌種 | 疾患名 | 有効例/症例 |
| カンジダ属 | カンジダ血症 | 1/2 |
| 食道カンジダ症 | 5/5 | |
| カンジダ腹膜炎 | 4/4 | |
| 気管支・肺カンジダ症 | 1/1 | |
| 小計 | 11/12(91.7%) | |
| アスペルギルス属 | 侵襲性肺アスペルギルス症 | 10/16 |
| 慢性壊死性肺アスペルギルス症 | 3/5 | |
| 肺アスペルギローマ | 14/18 | |
| 小計 | 27/39(69.2%) | |
| クリプトコックス属 | クリプトコックス髄膜炎 | 1/1 |
| 肺クリプトコックス症 | 7/7 | |
| 小計 | 8/8(100%) | |
| フサリウム属 | 全身性フサリウム・ソラニ感染症 | 0/1 |
| 小計 | 0/1 | |
| 合計 | 46/60(76.7%) |
17.1.2 外国第III相試験(150-307/602試験)
免疫不全で急性侵襲性アスペルギルス症の患者を対象とし、ボリコナゾール投与群とアムホテリシンB投与群の有効性、安全性及び忍容性を比較した。ボリコナゾール投与群では196例に初回投与24時間は負荷用量として6mg/kgを12時間ごとに、以降は4mg/kgを12時間ごとに静脈内投与した。忍容性に問題が認められた場合は3mg/kgを12時間ごとへの減量を可能とした。全ての被験者に対して、少なくとも7日間の静脈内投与を推奨し、注入速度は最大で3mg/kg/hrとした。ボリコナゾールの経口投与の開始用量は200mgを1日2回とし、経口投与3日目以降に臨床効果が不十分な場合は、300mgを1日2回までの増量を可能とした。忍容性に問題が認められた場合は50mgを1日2回単位の減量を行い、200mgを1日2回までの減量を可能とした。体重40kg未満の被験者においては、ボリコナゾールの経口投与量を半量とした。
投与終了時(最大投与期間16週間)の総合効果有効率は、以下の通りであった。
投与終了時(最大投与期間16週間)の総合効果有効率は、以下の通りであった。
| 菌種 | 疾患名 | 有効例/症例 |
| アスペルギルス属 | 侵襲性肺アスペルギルス症 | 77/144 |
| 小計 | 77/144(53.5%) | |
| 合計 | 77/144(53.5%) |
17.1.3 外国第III相試験(150-309/604試験)
「原因真菌に対して効能を有する薬剤がない全身性又は侵襲性真菌症」、又は「前治療薬が効能不十分又は忍容性の問題から継続できない全身性又は侵襲性真菌症」と診断された患者を対象に、372例にボリコナゾールを静脈内投与又は経口投与した。
静脈内投与の場合は、投与初日に負荷用量として6mg/kgを12時間ごとに投与し、その後は維持用量として4mg/kgを12時間ごとに少なくとも3日間投与した。注入速度は約3mg/kg/hrとした。経口投与の場合は、投与初日に負荷用量として400mgを1日2回投与し、その後は維持用量として200mgを1日2回投与した。
投与終了時(最大投与期間16週間)の総合効果有効率は、以下の通りであった。
静脈内投与の場合は、投与初日に負荷用量として6mg/kgを12時間ごとに投与し、その後は維持用量として4mg/kgを12時間ごとに少なくとも3日間投与した。注入速度は約3mg/kg/hrとした。経口投与の場合は、投与初日に負荷用量として400mgを1日2回投与し、その後は維持用量として200mgを1日2回投与した。
投与終了時(最大投与期間16週間)の総合効果有効率は、以下の通りであった。
| 菌種 | 疾患名 | 有効例/症例 |
| カンジダ属 | カンジダ血症 | 11/21 |
| 食道カンジダ症 | 23/38 | |
| 小計 | 34/59(57.6%) | |
| アスペルギルス属 | 侵襲性肺アスペルギルス症 | 40/86 |
| 小計 | 40/86(46.5%) | |
| クリプトコックス属 | クリプトコックス髄膜炎 | 1/4 |
| クリプトコックス血症とクリプトコックス髄膜炎の併発 | 1/2 | |
| 小計 | 2/6(33.3%) | |
| フサリウム属 | フサリウム血症 | 1/2 |
| フサリウム副鼻腔炎 | 1/1 | |
| フサリウム眼内炎 | 2/4 | |
| 肺フサリウム症とフサリウム皮下感染症の併発 | 0/1 | |
| その他のフサリウム症 | 1/3 | |
| 小計 | 5/11(45.5%) | |
| スケドスポリウム属 | スケドスポリウム脳感染症 | 0/3 |
| 肺スケドスポリウム症 | 1/2 | |
| スケドスポリウム皮下感染症 | 2/2 | |
| スケドスポリウム脳感染症とスケドスポリウム皮下感染症の併発 | 0/1 | |
| スケドスポリウム血症 | 0/1 | |
| その他のスケドスポリウム症 | 0/1 | |
| 小計 | 3/10(30.0%) | |
| 合計 | 84/172(48.8%) |
17.1.4 外国第III相試験(150-608試験)
非好中球減少のカンジダ血症患者を対象に、ボリコナゾールの有効性及び安全性を、アムホテリシンBの投与後にフルコナゾールを投与した時の有効性及び安全性と比較した。少なくとも最初の3日間は静脈内投与を行い、その後は経口投与への切り替えを可能とした。
ボリコナゾール投与群では272例に最初の24時間は負荷用量として6mg/kgを、以後は維持用量として3mg/kgをそれぞれ12時間ごとに静脈内投与した。また、維持用量は4mg/kgを12時間ごとまで増量できることとした。最高注入速度は3mg/kg/hrとした。
ボリコナゾール経口投与への切り替え後は、200mgを1日2回(体重40kg未満の場合は100mgを1日2回)で開始し、300mgを1日2回(体重40kg未満の場合は150mgを1日2回)まで増量可能とした。
投与終了時(最大投与期間はカンジダ血症の消失後8週間)の総合効果有効率は以下の通りであった。
ボリコナゾール投与群では272例に最初の24時間は負荷用量として6mg/kgを、以後は維持用量として3mg/kgをそれぞれ12時間ごとに静脈内投与した。また、維持用量は4mg/kgを12時間ごとまで増量できることとした。最高注入速度は3mg/kg/hrとした。
ボリコナゾール経口投与への切り替え後は、200mgを1日2回(体重40kg未満の場合は100mgを1日2回)で開始し、300mgを1日2回(体重40kg未満の場合は150mgを1日2回)まで増量可能とした。
投与終了時(最大投与期間はカンジダ血症の消失後8週間)の総合効果有効率は以下の通りであった。
| 菌種 | 疾患名 | 有効例/症例 |
| カンジダ属 | カンジダ血症 | 162/248 |
| 小計 | 162/248(65.3%) | |
| 合計 | 162/248(65.3%) |
副作用発現率は272例中97例(35.7%)であった。主な副作用はALP増加(0.7%)、低カリウム血症(0.7%)であった44)。
<造血幹細胞移植患者における深在性真菌症の予防>
17.1.5 海外第III相試験(無作為化非盲検並行群間比較試験)(A1501073試験)
過去6ヵ月間に侵襲性真菌感染症の発症がない12歳以上の造血幹細胞移植患者を対象として、移植後180日の真菌感染予防の成功についてボリコナゾールとイトラコナゾールを比較した。ボリコナゾール又はイトラコナゾールを2日間静脈内投与し、その後は経口投与に切り替えた。ボリコナゾール投与群では234例に、最初の24時間は負荷用量として6mg/kgを、以後は維持用量として4mg/kgをそれぞれ12時間ごとに静脈内投与した。経口投与に切り替え後は、200mgを1日2回(体重40kg未満の場合は100mgを1日2回)投与した。
イトラコナゾール投与群では255例に、負荷用量として200mgを1日2回静脈内投与し、経口投与へ切り替え後は200mgを1日2回投与した。
移植後180日における真菌感染予防の成功率は、以下の通りであった。
イトラコナゾール投与群では255例に、負荷用量として200mgを1日2回静脈内投与し、経口投与へ切り替え後は200mgを1日2回投与した。
移植後180日における真菌感染予防の成功率は、以下の通りであった。
| 予防成功率a) | 群間差[95%信頼区間]b) | |
| ボリコナゾール群 | イトラコナゾール群 | |
| 48.9% (109/223) | 33.5% (80/239) | 16.3[7.6,25.0]% |
17.1.6 海外第III相試験(非盲検非対照試験)(A1501038試験)
過去12ヵ月間に侵襲性真菌感染症の既往のある18歳以上の造血幹細胞移植患者を対象として、侵襲性真菌感染症の二次予防のためにボリコナゾールを投与した。45例に負荷投与として12時間ごとに6mg/kgを2回投与し、維持投与として12時間ごとに4mg/kgを静脈内投与した。経口投与に切り替え後は、負荷投与として12時間ごとに400mgを2回投与(体重40kg未満の場合は12時間ごとに200mgを2回投与)し、維持投与として12時間ごとに200mg(体重40kg未満の場合は12時間ごとに100mg)を投与した。投与開始12ヵ月後までに侵襲性真菌感染症を発症した被験者の割合は10.7%(3/28例)であった。副作用発現率は45例中26例(57.8%)であった。主な副作用は、肝毒性(8.9%)、幻覚(6.7%)及び頭痛(6.7%)であった45)47)。
18. 薬効薬理
18.1 作用機序
アゾール系抗真菌薬で、真菌細胞膜の主成分であるエルゴステロールの合成を阻害し膜機能を障害するが、作用機序はラノステロールC14α脱メチル化酵素の阻害である48)。
18.2 抗真菌作用
19. 有効成分に関する理化学的知見
19.1. ボリコナゾール
22. 包装
<ボリコナゾール錠50mg「アメル」>
50錠[10錠(PTP)×5]
<ボリコナゾール錠100mg「アメル」>
50錠[10錠(PTP)×5]
<ボリコナゾール錠200mg「アメル」>
50錠[10錠(PTP)×5]
23. 主要文献
- 生殖発生毒性試験 ラット胎児の器官形成期投与試験(海外in vivo試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.7.13)
- 生殖発生毒性試験 ウサギ胚・胎児発生に関する試験(国内in vivo試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.7.13)
- 薬物動態に及ぼすリファンピシン及びrifabutinの影響(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- 薬物動態に及ぼすrifabutinの影響(海外薬物動態試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- 薬物動態に及ぼすエファビレンツの影響(海外薬物動態試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- 薬物動態に及ぼすリトナビルの影響(海外薬物動態試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- Purkins L,et al., Br J Clin Pharmacol., 56 (Suppl.1), 37-44, (2003) »PubMed
- HIVプロテアーゼ阻害薬におけるチトクロームP450に関連した薬物相互作用(海外in vitro試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.5.15)
- CYP3A4モジュレーターにおけるチトクロームP450に関連した薬物相互作用(海外in vitro試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.5.15)
- Romero AJ,et al., Clin Pharmacol Ther., 71 (4), 226-234, (2002) »PubMed
- タクロリムスの薬物動態に及ぼす影響(海外薬物動態試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- Purkins L,et al., Br J Clin Pharmacol., 56 (Suppl.1), 24-29, (2003) »PubMed
- オメプラゾールの薬物動態に及ぼす影響(海外薬物動態試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- テストステロン、ミダゾラムにおけるチトクロームP450に関連した薬物相互作用(海外in vitro試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.5.15)
- Saari TI,et al., Clin Pharmacol Ther., 79, 362-370, (2006) »PubMed
- Saari TI,et al., Eur J Clin Pharmacol., 63 (10), 941-949, (2007) »PubMed
- Saari TI,et al., Br J Clin Pharmacol., 63 (1), 116-120, (2007) »PubMed
- Hagelberg NM,et al., Eur J Clin Pharmacol., 65 (3), 263-271, (2009) »PubMed
- Saari TI,et al., Eur J Clin Pharmacol., 64 (1), 25-30, (2008) »PubMed
- Hynninen VV,et al., Antimicrob Agents Chemother., 50 (6), 1967-1972, (2006) »PubMed
- Hynninen VV,et al., Fundam Clin Pharmacol., 21 (6), 651-656, (2007) »PubMed
- Rengelshausen J,et al., Clin Pharmacol Ther., 78 (1), 25-33, (2005) »PubMed
- Hamandi B,et al., Am J Transplant., 18 (1), 113-124, (2018) »PubMed
- 健常成人における単回経口投与時の薬物動態、食事の影響及び安全性(国内第I相試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- 健常成人における単回及び負荷投与を伴う反復経口投与時の薬物動態(国内第I相試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- 小児患者における薬物動態(ブイフェンド錠/静注用/ドライシロップ:2014年9月26日承認、申請資料概要2.7.2.3、2.7.2.5)
- 社内資料:生物学的同等性試験[錠200mg]
- 健康成人におけるポピュレーションファーマコキネティクス(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.2.3(4))
- 国内第III相試験におけるポピュレーションファーマコキネティクス(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.2.3(4))
- 薬物動態におよぼす食事の影響(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- Lutsar I,et al., Clin.Infect.Dis., 37 (5), 728-732, (2003) »PubMed
- Roffey SJ,et al., Drug Metab Dispos., 31 (6), 731-741, (2003) »PubMed
- Hyland R,et al., Drug Metab Dispos., 31 (5), 540-547, (2003) »PubMed
- 中等度の肝機能障害を有する被験者における反復経口投与時の薬物動態、安全性及び忍容性(海外薬物動態試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- 腎機能障害者における薬物動態、安全性及び忍容性(海外薬物動態試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- 腎機能低下者における薬物動態(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.5.3(7))
- 社内資料:生物学的同等性試験(溶出挙動比較)
- 深在性真菌症に対する有効性及び安全性(国内第III相試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- 深在性真菌症に対する国内第III相試験(ブイフェンド錠/静注用:2005年4月11日承認、審査報告書)
- Herbrecht R,et al., N.Engl.J.Med., 347 (6), 408-415, (2002) »PubMed
- 外国第III相試験(150-307/602試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- Perfect JR,et al., Clin.Infect.Dis., 36 (9), 1122-1131, (2003) »PubMed
- 外国第III相試験(150-309/604試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- 非好中球減少患者のカンジダ血症の治療における比較試験(海外第III相試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.7.6(2))
- 造血幹細胞移植患者を対象とした予防試験で発現した副作用(海外第III相試験)(ブイフェンド錠/静注用/ドライシロップ:2015年8月24日承認、申請資料概要2.7.6.2、2.7.6.3)
- 同種造血幹細胞移植(HSCT)患者における侵襲性真菌感染症(IFI)の一次予防試験(海外第III相試験)(ブイフェンド錠/静注用/ドライシロップ:2015年8月24日承認、申請資料概要2.7.6.2)
- 同種幹細胞移植(SCT)患者における侵襲性真菌感染症(IFI)の二次予防試験(海外第III相試験)(ブイフェンド錠/静注用/ドライシロップ:2015年8月24日承認、申請資料概要2.7.6.3)
- 第十八改正日本薬局方解説書, C-5436, (2021), (廣川書店)
- in vitroにおける抗真菌活性(海外in vitro試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.2.2(1))
- 免疫正常モルモットにおけるアスペルギルス全身感染に対する感染防御効果(海外in vivo試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.2.2(2))
- 免疫抑制モルモットにおけるアスペルギルス全身感染に対する感染防御効果(海外in vivo試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.2.2(2))
- 免疫抑制モルモットにおけるアスペルギルス肺感染に対する感染防御効果(海外in vivo試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.2.2(2))
- 免疫正常モルモットにおけるCandida全身感染に対する感染防御効果(海外in vivo試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.2.2(2))
- 免疫抑制モルモットにおけるCandida全身感染に対する感染防御効果(海外in vivo試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.2.2(2))
- 免疫正常及び免疫抑制モルモットにおけるCandida nonalbicans全身感染に対する感染防御効果(海外in vivo試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.2.2(2))
- 免疫正常モルモットにおけるCryptococcus肺感染に対する感染防御効果(海外in vivo試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.2.2(2))
- 免疫正常モルモットにおけるCryptococcus頭蓋内感染に対する感染防御効果(海外in vivo試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.2.2(2))
- 免疫正常モルモットにおけるスケドスポリウム全身感染に対する感染防御効果(海外in vivo試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.2.2(2))
- 免疫抑制モルモットにおけるスケドスポリウム全身感染に対する感染防御効果(海外in vivo試験)(ブイフェンド錠/静注用:2005年4月11日承認、申請資料概要2.6.2.2(2))
24. 文献請求先及び問い合わせ先
文献請求先
共和薬品工業株式会社
お問い合わせ窓口
〒530-0005
大阪市北区中之島3-2-4
電話:0120-041-189
FAX:06-6121-2858
製品情報問い合わせ先
共和薬品工業株式会社
お問い合わせ窓口
〒530-0005
大阪市北区中之島3-2-4
電話:0120-041-189
FAX:06-6121-2858
26. 製造販売業者等
26.1 製造販売元
共和薬品工業株式会社
大阪市北区中之島3-2-4