医薬品情報
| 総称名 | ロサルヒド |
|---|---|
| 一般名 | ロサルタンカリウム ヒドロクロロチアジド |
| 欧文一般名 | Losartan Potassium Hydrochlorothiazide |
| 薬効分類名 | 持続性ARB/利尿薬合剤 |
| 薬効分類番号 | 2149 |
| ATCコード | C09DA01 |
| KEGG DRUG |
D07895
ロサルタンカリウム・ヒドロクロロチアジド
|
| KEGG DGROUP |
DG03231
血圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(第3版)
商品情報 3.組成・性状
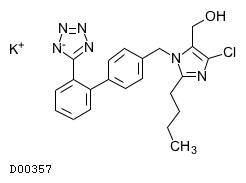
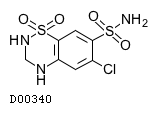
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ロサルヒド配合錠LD「日医工」 (後発品) | Losarhyd Combination Tablets | 日医工 | 2149110F1287 | 17.4円/錠 | 処方箋医薬品注) |
| ロサルヒド配合錠HD「日医工」 (後発品) | Losarhyd Combination Tablets | 日医工 | 2149110F2240 | 31.6円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 チアジド系薬剤又はその類似化合物(例えばクロルタリドン等のスルフォンアミド誘導体)に対する過敏症の既往歴のある患者
2.3 妊婦又は妊娠している可能性のある女性[9.5参照]
2.4 重篤な肝機能障害のある患者[9.3.1参照]
2.5 無尿の患者又は透析患者[9.2.1参照]
2.6 急性腎障害の患者[9.2.2参照]
2.8 アリスキレンを投与中の糖尿病患者(ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く)[10.1参照]
2.9 デスモプレシン酢酸塩水和物(男性における夜間多尿による夜間頻尿)を投与中の患者[10.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
過度な血圧低下のおそれ等があり、本剤を高血圧治療の第一選択薬としないこと。
6. 用法及び用量
ロサルヒド配合錠LD「日医工」
成人には1日1回1錠(ロサルタンカリウム/ヒドロクロロチアジドとして50mg/12.5mg)を経口投与する。
本剤は高血圧治療の第一選択薬として用いない。
本剤は高血圧治療の第一選択薬として用いない。
ロサルヒド配合錠HD「日医工」
成人には1日1回1錠(ロサルタンカリウム/ヒドロクロロチアジドとして100mg/12.5mg)を経口投与する。
本剤は高血圧治療の第一選択薬として用いない。
本剤は高血圧治療の第一選択薬として用いない。
7. 用法及び用量に関連する注意
原則として、ロサルタンカリウム50mgで効果不十分な場合にロサルタンカリウム/ヒドロクロロチアジドとして50mg/12.5mgの投与を、ロサルタンカリウム100mg又はロサルタンカリウム/ヒドロクロロチアジドとして50mg/12.5mgで効果不十分な場合にロサルタンカリウム/ヒドロクロロチアジドとして100mg/12.5mgの投与を検討すること。[8.1参照]
8. 重要な基本的注意
8.1 本剤はロサルタンカリウム50mgあるいは100mgとヒドロクロロチアジド12.5mgの配合剤であり、ロサルタンカリウムとヒドロクロロチアジド双方の副作用が発現するおそれがあり、適切に本剤の使用を検討すること。[7.参照]
8.2 一過性の血圧低下(ショック症状、意識消失、呼吸困難等を伴う)を起こすおそれがあるので、本剤投与中は定期的(投与開始時:2週間ごと、安定後:月1回程度)に血圧のモニタリングを実施すること。
8.3 本剤の成分であるヒドロクロロチアジドは低カリウム血症を起こすことが知られている。ロサルタンカリウム/ヒドロクロロチアジドとして50mg/12.5mgが投与された国内臨床試験において、血清カリウム値は低下傾向を示し、また低カリウム血症の発現頻度は高カリウム血症よりも高かった。したがって、低カリウム血症の発現がより懸念されるので、血清カリウム値のモニタリングを定期的に実施し、観察を十分に行うこと。[9.1.2、11.1.7参照]
8.4 本剤の成分であるヒドロクロロチアジドは高尿酸血症を発現させるおそれがあるので、本剤投与中は定期的に血清尿酸値のモニタリングを実施し、観察を十分に行うこと。[9.1.8参照]
8.5 本剤の成分であるヒドロクロロチアジドは血糖値上昇若しくは糖尿病顕性化のおそれがあるので、観察を十分に行うこと。[9.1.8参照]
8.6 本剤の成分であるヒドロクロロチアジドは重篤な血液障害を発現させるおそれがあるので、定期的に検査を実施するなど観察を十分に行うこと。[11.1.10参照]
8.7 降圧作用に基づくめまい、ふらつきがあらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
8.8 手術前24時間は投与しないことが望ましい。アンジオテンシンII受容体拮抗剤投与中の患者は、麻酔及び手術中にレニン・アンジオテンシン系の抑制作用による高度な血圧低下を起こすおそれがある。
8.9 本剤の成分を含むアンジオテンシンII受容体拮抗剤投与中にまれに肝炎等の重篤な肝障害があらわれたとの報告がある。肝機能検査を実施するなど、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
8.10 本剤の投与により利尿効果が急激にあらわれることがあるので、電解質失調、脱水に十分注意すること。
8.11 夜間の休息が特に必要な患者には、夜間の排尿を避けるため、午前中に投与することが望ましい。
8.12 本剤の成分であるヒドロクロロチアジドは急性近視、閉塞隅角緑内障、脈絡膜滲出を発現させるおそれがあるので、急激な視力の低下や眼痛等の異常が認められた場合には、直ちに眼科医の診察を受けるよう、患者に指導すること。[11.1.16参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 両側性腎動脈狭窄のある患者又は片腎で腎動脈狭窄のある患者
治療上やむを得ないと判断される場合を除き、使用は避けること。腎血流量の減少や糸球体ろ過圧の低下により急速に腎機能を悪化させるおそれがある。
9.1.2 血清カリウム値異常の患者
9.1.3 高カリウム血症の患者
9.1.4 脳血管障害のある患者
過度の降圧が脳血流不全を惹起し、病態を悪化させるおそれがある。
9.1.5 体液量が減少している患者(水分摂取の不十分な患者、過度の発汗をしている患者)
一過性の血圧低下を起こすおそれがある。[11.1.5参照]
9.1.6 減塩療法中の患者
9.1.7 重篤な冠動脈硬化症又は脳動脈硬化症のある患者
急激な利尿があらわれた場合、急速な血漿量減少、血液濃縮を来し、血栓塞栓症を誘発するおそれがある。
9.1.8 本人又は両親、兄弟に痛風、糖尿病のある患者、及び高尿酸血症のある患者
9.1.9 下痢、嘔吐のある患者
電解質失調があらわれるおそれがある。
9.1.10 高カルシウム血症、副甲状腺機能亢進症のある患者
血清カルシウムを上昇させるおそれがある。
9.1.11 交感神経切除後の患者
本剤の降圧作用が増強されるおそれがある。
9.2 腎機能障害患者
9.2.1 無尿の患者又は透析患者
投与しないこと。[2.5参照]
9.2.2 急性腎障害の患者
投与しないこと。腎機能を更に悪化させるおそれがある。[2.6参照]
9.2.3 腎機能障害患者(血清クレアチニン値2.0mg/dL超)
治療上やむを得ないと判断される場合を除き、使用は避けること。ヒドロクロロチアジドにより腎血流量が低下し、ロサルタンカリウムにより腎機能障害が悪化するおそれがある。
9.2.4 腎機能低下患者(血清クレアチニン値1.5〜2.0mg/dL)
本剤投与中は定期的に血清クレアチニン値及び血清尿酸値のモニタリングを実施し、観察を十分に行うこと。血清クレアチニン値上昇及び血清尿酸値上昇のおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝機能障害のある患者
9.3.2 肝機能障害又はその既往のある患者(ただし、重篤な肝機能障害のある患者を除く)
外国において、軽・中等度のアルコール性肝硬変患者にロサルタンカリウム50mgを単回経口投与すると、健康成人と比較してロサルタンの消失速度が遅延し、ロサルタン及びカルボン酸体の血漿中濃度がそれぞれ約5倍及び約2倍に上昇することが報告されている。また、ヒドロクロロチアジドは肝性昏睡を誘発するおそれがある。[9.3.1参照]
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性
妊娠していることが把握されずアンジオテンシン変換酵素阻害剤又はアンジオテンシンII受容体拮抗剤を使用し、胎児・新生児への影響(腎不全、頭蓋・肺・腎の形成不全、死亡等)が認められた例が報告されている1)2)。
本剤の投与に先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、投与が必要な場合には次の注意事項に留意すること。[9.5参照]
本剤の投与に先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、投与が必要な場合には次の注意事項に留意すること。[9.5参照]
(1)本剤投与開始前に妊娠していないことを確認すること。本剤投与中も、妊娠していないことを定期的に確認すること。投与中に妊娠が判明した場合には、直ちに投与を中止すること。
(2)次の事項について、本剤投与開始時に患者に説明すること。また、投与中も必要に応じ説明すること。
・妊娠中に本剤を使用した場合、胎児・新生児に影響を及ぼすリスクがあること。
・妊娠が判明した又は疑われる場合は、速やかに担当医に相談すること。
・妊娠を計画する場合は、担当医に相談すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。投与中に妊娠が判明した場合には、直ちに投与を中止すること。妊娠中期及び末期にアンジオテンシン変換酵素阻害剤又はアンジオテンシンII受容体拮抗剤を投与された患者で羊水過少症、胎児・新生児の死亡、新生児の低血圧、腎不全、多臓器不全、頭蓋の形成不全及び羊水過少症によると推測される四肢の拘縮、頭蓋顔面の奇形、肺の低形成等があらわれたとの報告がある。なお、チアジド系薬剤では新生児又は乳児に高ビリルビン血症、血小板減少症等を起こすことがある。また、利尿効果に基づく血漿量減少、血液濃縮、子宮・胎盤血流量減少があらわれることがある。[2.3、9.4.1参照]
9.6 授乳婦
授乳しないことが望ましい。ラットの周産期及び授乳期にロサルタンカリウム1mg/kg/day/ヒドロクロロチアジド0.25mg/kg/day〜ロサルタンカリウム50mg/kg/day/ヒドロクロロチアジド12.5mg/kg/dayを投与した試験において、ロサルタンカリウム50mg/kg/day/ヒドロクロロチアジド12.5mg/kg/day群で産児体重の減少及び腎の病理組織学的変化がみられた。また、ロサルタン、カルボン酸体及びヒドロクロロチアジドの乳汁移行性も確認された。本試験の産児に対する無毒性量はロサルタンカリウム10mg/kg/day/ヒドロクロロチアジド2.5mg/kg/dayであった。ヒドロクロロチアジドは、ヒト母乳中への移行が報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。乳児は電解質バランスがくずれやすい。
9.8 高齢者
9.8.1 一般に生理機能が低下している。
9.8.2 一般に過度の降圧は好ましくないとされている。脳梗塞等が起こるおそれがある。
9.8.3 高齢者でのロサルタンカリウム単独投与における薬物動態試験で、ロサルタン及びカルボン酸体の血漿中濃度が非高齢者に比べて高かった(非高齢者に比較してロサルタン及びカルボン酸体の血漿中濃度がそれぞれ約2倍及び約1.3倍に上昇)。
9.8.4 急激な利尿は血漿量の減少を来し、脱水、低血圧等による立ちくらみ、めまい、失神等を起こすことがある。
9.8.5 特に心疾患等で浮腫のある高齢者では急激な利尿は急速な血漿量の減少と血液濃縮を来し、脳梗塞等の血栓塞栓症を誘発するおそれがある。
9.8.6 低ナトリウム血症、低カリウム血症があらわれやすい。
10. 相互作用
相互作用序文
本剤の成分であるロサルタンカリウムは、薬物代謝酵素チトクロームP450 2C9(CYP2C9)及び3A4(CYP3A4)により活性代謝物であるカルボン酸体に代謝される。なお、本剤の成分であるヒドロクロロチアジドは、ほとんど代謝されることなく尿中に排泄される。[16.4参照]
薬物代謝酵素用語
CYP2C9
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
10.2 併用注意
| カリウム保持性利尿剤: スピロノラクトン トリアムテレン等 カリウム補給剤: 塩化カリウム トリメトプリム含有製剤: スルファメトキサ ゾール・トリメトプリム | 血清カリウム値が上昇するおそれがある。 | 本剤の成分であるロサルタンカリウムとの併用によりカリウム貯留作用が増強するおそれがある。腎機能障害のある患者には特に注意すること。 |
| 利尿降圧剤: フロセミド トリクロルメチアジド等 [11.1.5参照] | 一過性の血圧低下を起こすおそれがある。 | 利尿降圧剤で治療を受けている患者にはレニン活性が亢進している患者が多く、本剤が奏効しやすい。 |
| アリスキレン | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。eGFRが60mL/min/1.73m2未満の腎機能障害のある患者へのアリスキレンとの併用については、治療上やむを得ないと判断される場合を除き避けること。 | レニン・アンジオテンシン系阻害作用が増強される可能性がある。 |
| アンジオテンシン変換酵素阻害剤 | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。 | レニン・アンジオテンシン系阻害作用が増強される可能性がある。 |
| バルビツール酸誘導体 | 起立性低血圧が増強されることがある。 | これらの薬剤の中枢抑制作用と本剤の成分であるヒドロクロロチアジドの降圧作用による。 |
| あへんアルカロイド系麻薬 | 起立性低血圧が増強されることがある。 | 本剤の成分であるヒドロクロロチアジドとあへんアルカロイドの大量投与で血圧下降があらわれることが報告されている。 |
| アルコール | 起立性低血圧が増強されることがある。 | 本剤の成分であるヒドロクロロチアジドと血管拡張作用を有するアルコールとの併用により降圧作用が増強される可能性がある。 |
| 昇圧アミン: ノルアドレナリン アドレナリン | 昇圧アミンの作用を減弱することがある。 手術前の患者に使用する場合、本剤の一時休薬等の処置を講ずること。 | 本剤の成分であるヒドロクロロチアジドは昇圧アミンに対する血管壁の反応性を低下させることが報告されている。 |
| ツボクラリン及びその類似作用物質: ツボクラリン塩化物塩酸塩水和物 | ツボクラリン及びその類似作用物質の麻痺作用を増強することがある。手術前の患者に使用する場合、本剤の一時休薬等の処置を講ずること。 | 本剤の成分であるヒドロクロロチアジドによる血清カリウム値の低下により、これらの薬剤の神経・筋遮断作用を増強すると考えられている。 |
| 降圧作用を有する他の薬剤: β-遮断剤 ニトログリセリン等 | 降圧作用を増強するおそれがある。降圧剤の用量調節等に注意すること。 | 作用機序の異なる降圧作用により互いに協力的に作用する。 |
| ジギタリス剤: ジゴキシン | ジギタリスの心臓に対する作用を増強し、不整脈等を起こすことがある。血清カリウム値に十分注意すること。 | 本剤の成分であるヒドロクロロチアジドによる血清カリウム値の低下により多量のジギタリスが心筋Na-K ATPaseに結合し、心収縮力増強と不整脈が起こる。マグネシウム低下も同様の作用を示す。 |
| 乳酸ナトリウム | チアジド系薬剤による代謝性アルカローシス、低カリウム血症を増強することがある。 | 本剤の成分であるヒドロクロロチアジドのカリウム排泄作用により低カリウム血症や代謝性アルカローシスが引き起こされることがある。アルカリ化剤である乳酸ナトリウムの併用はこの状態を更に増強させる。 |
| リチウム: 炭酸リチウム | リチウム中毒が報告されている。血中リチウム濃度に注意すること。 | 本剤の成分であるロサルタンカリウムのナトリウム排泄作用により、リチウムの蓄積が起こると考えられている。 |
| リチウム: 炭酸リチウム | 振戦、消化器愁訴等、リチウム中毒を増強することがある。血清リチウム濃度に注意すること。 | 本剤の成分であるヒドロクロロチアジドは腎におけるリチウムの再吸収を促進し、リチウムの血中濃度を上昇させる。 |
| 副腎皮質ホルモン剤 ACTH | 低カリウム血症が発現することがある。 | 本剤の成分であるヒドロクロロチアジド及び副腎皮質ホルモン剤、ACTHともカリウム排泄作用を持つ。 |
| グリチルリチン製剤 | 血清カリウム値の低下があらわれやすくなる。 | グリチルリチン製剤は低カリウム血症を主徴とした偽アルドステロン症を引き起こすことがある。したがって本剤の成分であるヒドロクロロチアジドとグリチルリチン製剤の併用により低カリウム血症を増強する可能性がある。 |
| 糖尿病用剤: SU剤 インスリン 速効型インスリン分泌促進薬 | 糖尿病用剤の作用を著しく減弱することがある。 | 機序は明確ではないが、本剤の成分であるヒドロクロロチアジドによるカリウム喪失により膵臓のβ細胞のインスリン放出が低下すると考えられている。 |
| コレスチラミン | チアジド系薬剤の作用が減弱することがある。 | コレスチラミンの吸着作用により本剤の成分であるヒドロクロロチアジドの吸収が阻害されることがある。 |
| 非ステロイド性消炎鎮痛剤: インドメタシン等 | 降圧作用が減弱されるおそれがある。 | プロスタグランジンの合成阻害作用により、本剤の降圧作用を減弱させる可能性がある。 |
| 非ステロイド性消炎鎮痛剤: インドメタシン等 | 腎機能が悪化している患者では、さらに腎機能が悪化するおそれがある。 | プロスタグランジンの合成阻害作用により、腎血流量が低下するためと考えられる。 |
| 非ステロイド性消炎鎮痛剤: インドメタシン等 | チアジド系薬剤の作用が減弱することがある。 | 非ステロイド性消炎鎮痛剤のプロスタグランジン合成酵素阻害作用により、腎内プロスタグランジンが減少し、水・ナトリウムの体内貯留が生じて本剤の成分であるヒドロクロロチアジドの作用と拮抗する。 |
| グレープフルーツジュース | 降圧作用が減弱されるおそれがある。本剤の投与中はグレープフルーツジュースの摂取は避けること。 | グレープフルーツジュースに含まれる成分のCYP3A4阻害作用により本剤の有効成分であるロサルタンカリウムの活性代謝物の血中濃度が低下するため、本剤の降圧作用が減弱されるおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
不快感、口内異常感、発汗、蕁麻疹、呼吸困難、全身潮紅、浮腫等があらわれることがある。
11.1.2 血管性浮腫(頻度不明)
顔面、口唇、咽頭、舌等の腫脹があらわれることがある。また、腹痛、嘔気、嘔吐、下痢等を伴う腸管血管性浮腫があらわれることがある。
11.1.3 急性肝炎又は劇症肝炎(いずれも頻度不明)
11.1.4 急性腎障害(頻度不明)
11.1.5 ショック、失神、意識消失(いずれも頻度不明)
11.1.6 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれた場合には、投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎障害の発症に注意すること。
11.1.7 低カリウム血症、高カリウム血症(いずれも頻度不明)
11.1.8 不整脈(頻度不明)
心室性期外収縮、心房細動等の不整脈があらわれることがある。
11.1.9 汎血球減少、白血球減少、血小板減少(いずれも頻度不明)
11.1.10 再生不良性貧血、溶血性貧血(いずれも頻度不明)[8.6参照]
11.1.11 壊死性血管炎(頻度不明)
11.1.12 間質性肺炎、肺水腫、急性呼吸窮迫症候群(いずれも頻度不明)
11.1.13 全身性エリテマトーデスの悪化(頻度不明)
11.1.14 低血糖(頻度不明)
脱力感、空腹感、冷汗、手の震え、集中力低下、痙攣、意識障害等があらわれた場合には、投与を中止し、適切な処置を行うこと。糖尿病治療中の患者であらわれやすい。
11.1.15 低ナトリウム血症(頻度不明)
11.1.16 急性近視、閉塞隅角緑内障、脈絡膜滲出(いずれも頻度不明)
急性近視(霧視、視力低下等を含む)、閉塞隅角緑内障、脈絡膜滲出があらわれることがある。[8.12参照]
11.2 その他の副作用
| 0.1〜5%未満注) | 頻度不明 | |
| 精神神経系 | めまい、浮遊感、眠気、頭痛 | 耳鳴、不眠、知覚異常 |
| 循環器系 | 低血圧、起立性低血圧、動悸 | 調律障害(頻脈等)、胸痛 |
| 消化器 | 嘔吐・嘔気 | 口内炎、下痢、口角炎、胃不快感、胃潰瘍、腹部仙痛、膵炎、唾液腺炎、便秘、食欲不振、腹部不快感、口渇 |
| 肝臓 | 黄疸、肝機能障害(AST上昇、ALT上昇、LDH上昇等) | |
| 腎臓 | BUN上昇、クレアチニン上昇 | |
| 皮膚 | 発疹、蕁麻疹 | 多形紅斑、光線過敏、紅皮症、紅斑、そう痒、顔面潮紅、皮膚エリテマトーデス |
| 血液 | 貧血、赤血球数増加、赤血球数減少、ヘマトクリット低下、ヘマトクリット上昇、ヘモグロビン増加、白血球数増加、リンパ球数増加 | 好酸球数増加、好中球百分率増加、リンパ球数減少 |
| その他 | 倦怠感、CK上昇、高尿酸血症、高血糖症、頚部異和感、多汗、頻尿、CRP増加、尿中ブドウ糖陽性、尿中赤血球陽性、尿中白血球陽性、尿中蛋白陽性、BNP増加 | 発熱、味覚障害、しびれ感、眼症状(かすみ、異和感等)、黄視症、ほてり、浮腫、筋肉痛、咳嗽、低マグネシウム血症、低クロール性アルカローシス、血清カルシウム増加、インポテンス、高カルシウム血症を伴う副甲状腺障害、筋痙攣、関節痛、鼻閉、紫斑、呼吸困難、血清脂質増加、女性化乳房 |
12. 臨床検査結果に及ぼす影響
甲状腺障害のない患者の血清PBIを低下させることがある。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人にロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgを単回経口投与すると、ロサルタン及びカルボン酸体は、それぞれ投与後1.4及び3.7時間に最高血漿中濃度(Cmax)に達し、消失半減期(t1/2)1.7及び5.8時間で消失した。ヒドロクロロチアジドの血漿中濃度は、投与後2.8時間でCmaxに達し、t1/2は7.9時間であった9)(表1)。
| ロサルタンカリウム50mg/ヒドロクロロチアジド12.5mg | |||
| ロサルタン | カルボン酸体 | ヒドロクロロチアジド | |
| Cmax(ng/mL) | 291.0±96.9 | 592.9±137.4 | 95.9±20.9 |
| Tmax(hr) | 1.4±0.8 | 3.7±1.2 | 2.8±0.9 |
| AUC0-∞(ng・hr/mL) | 504.8±180.2 | 3674.1±680.2 | 516.2±89.8 |
| t1/2(hr) | 1.7±0.6 | 5.8±1.1 | 7.9±1.2 |
16.1.2 反復投与
軽症及び中等症の本態性高血圧症患者にロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgを1日1回14日間反復経口投与した時、血漿中ロサルタン、カルボン酸体及びヒドロクロロチアジドのいずれにも蓄積性は認められなかった10)。
16.1.3 生物学的同等性試験
ロサルヒド配合錠LD「日医工」及びプレミネント配合錠LDを、クロスオーバー法によりそれぞれ1錠(ロサルタンカリウムとして50mg及びヒドロクロロチアジドとして12.5mg)健康成人男性に絶食単回経口投与して血漿中カルボン酸体※濃度及びヒドロクロロチアジド濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された11)。
(※ロサルタンの主要活性代謝物)
| 判定パラメータ | 参考パラメータ | |||
| AUC0→24(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) | |
| ロサルヒド配合錠LD「日医工」 | 3423.42±882.74 | 511.88±158.60 | 3.30±0.72 | 4.58±0.40 |
| プレミネント配合錠LD | 3449.84±1007.84 | 533.09±168.67 | 3.50±1.31 | 4.56±0.39 |
図1 血漿中薬物濃度推移(カルボン酸体)
| 判定パラメータ | 参考パラメータ | |||
| AUC0→24(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) | |
| ロサルヒド配合錠LD「日医工」 | 515.15±77.12 | 82.07±19.13 | 2.50±0.99 | 7.62±1.01 |
| プレミネント配合錠LD | 506.55±83.16 | 78.62±16.08 | 2.76±0.80 | 7.62±0.85 |
図2 血漿中薬物濃度推移(ヒドロクロロチアジド)
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 食事の影響
(1)健康成人にロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgを食後投与すると、空腹時投与に比べてロサルタン、カルボン酸体及びヒドロクロロチアジドのいずれも最高血漿中濃度到達時間(Tmax)が遅延(0.7〜1.7時間)し、ロサルタンの血漿中濃度−時間曲線下面積(AUC)は差がなかったものの、カルボン酸体及びヒドロクロロチアジドのAUCがそれぞれ17%及び22%低下したが、臨床上問題とならない程度であった9)。
(2)健康成人にロサルタンカリウム/ヒドロクロロチアジド100mg/12.5mgを食後単回経口投与した場合、空腹時投与に比べてロサルタン、カルボン酸体及びヒドロクロロチアジドのいずれもTmaxが遅延(2.0〜2.8時間)し、ロサルタン、カルボン酸体及びヒドロクロロチアジドのAUCがそれぞれ22%、23%及び11%低下したが、臨床上問題とならない程度であった12)。
16.3 分布
ヒトにおけるロサルタン及びカルボン酸体の血漿蛋白結合率は、いずれも98%以上であった。
ヒドロクロロチアジドのヒト血清蛋白結合率は22%であった13)。
外国人におけるロサルタンの分布容積は34Lであった14)。
16.4 代謝
16.5 排泄
健康成人にロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgを単回経口投与後48時間までに、ロサルタン、カルボン酸体及びヒドロクロロチアジドが、尿中にそれぞれ投与量の3.7%、7.7%及び66.6%排泄された9)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能障害を伴う高血圧症患者(血清クレアチニン値1.5〜2.5mg/dL)にロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgを1日1回7日間反復経口投与した時のロサルタン及びカルボン酸体のCmaxは、腎機能正常患者に比べ1.2倍高く、AUC0-24hrは1.5〜1.7倍高かった。ヒドロクロロチアジドのCmax及びAUC0-24hrは、それぞれ腎機能正常患者の1.4倍及び2.2倍、腎クリアランスは27%であった15)。
16.6.2 高齢者
ロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgを1日1回7日間反復経口投与後のロサルタン及びカルボン酸体の血漿中濃度は、非高齢者と差はなく、ヒドロクロロチアジドの吸収も非高齢者と差がなかった16)(外国人データ)。
16.7 薬物相互作用
健康成人にロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgを単回経口投与した後のロサルタン、カルボン酸体及びヒドロクロロチアジドの血漿中濃度は、各単剤投与後と差がなく、ロサルタンとヒドロクロロチアジドとの薬物動態的な相互作用は認められなかった9)。
16.8 その他
ロサルヒド配合錠HD「日医工」は、ロサルヒド配合錠LD「日医工」を標準製剤としたとき、溶出挙動が同等と判定され、生物学的に同等とみなされた19)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 第III相二重盲検比較試験
日本人を対象とした二重盲検比較試験において、ロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgはロサルタンカリウム50mg投与よりも有意に優れた降圧効果が認められた。降圧効果判定採用154例のうち有効(拡張期血圧が90mmHg未満に又は10mmHg以上低下した症例)と判定された症例は112例(73%)であった。なお、8週間時における拡張期血圧の平均変化量は下図のとおりであった20)21)。
図 坐位拡張期血圧の平均変化量(8週間投与時)
Pbo=プラセボ、L=ロサルタンカリウム、H=ヒドロクロロチアジド
†主要評価項目のFAS解析対象例、††平均値(標準偏差)、§最小二乗平均値(95%信頼区間)
ロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgが投与された患者で自他覚症状の副作用が報告されたのは155例中14例(9.0%)であり、主な副作用は浮動性めまい5例(3.2%)、悪心2例(1.3%)であった。また、臨床検査値の副作用が報告されたのは155例中22例(14.2%)であり、主な臨床検査値の副作用は、尿酸増加8例(5.3%)、ALT増加、CK増加各3例(2.0%)、赤血球数減少、ヘマトクリット減少、ヘモグロビン減少、AST増加、BUN増加各2例(1.3%)であった。
また、ロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgの副作用発現率は、プラセボと同程度であった。
また、ロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgの副作用発現率は、プラセボと同程度であった。
17.1.2 国内第III相長期投与試験
日本人を対象に長期の安全性を検討した第III相試験において、ロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgが投与された患者で自他覚症状の副作用が報告されたのは200例中28例(14.0%)であり、主な副作用は頻尿6例(3.0%)、浮動性めまい4例(2.0%)、右脚ブロック、動悸、異常感、蕁麻疹各2例(1.0%)であった。また、臨床検査値の副作用が報告されたのは200例中26例(13.0%)であり、主な臨床検査値の副作用は尿酸増加6例(3.0%)、ALT増加5例(2.5%)、AST増加、カリウム減少各4例(2.0%)、赤血球数減少、ヘマトクリット減少各3例(1.5%)、白血球数増加、ヘモグロビン減少、LDH増加、CK増加、尿中赤血球陽性各2例(1.0%)であった22)。
17.1.3 国内第III相二重盲検比較試験
ロサルタンカリウム100mgを服用後に血圧コントロールが不十分であった日本人本態性高血圧症患者を対象とした第III相二重盲検試験において、ロサルタンカリウム/ヒドロクロロチアジド100mg/12.5mgはロサルタンカリウム100mg投与よりも、投与8週時の平均トラフ坐位収縮期及び拡張期血圧共に、有意に優れた降圧効果を示した(P<0.001)。投与8週時における平均トラフ坐位血圧のベースラインからの変化量を表1に示す23)24)。
| ベースラインの血圧†† | 投与8週時の変化量† | ||
| ロサルタンカリウム100mg (N=170)§ | 収縮期 | 155.0(10.4) | −5.4(1.0) |
| 拡張期 | 97.7(5.7) | −3.6(0.6) | |
| ロサルタンカリウム/ヒドロクロロチアジド100mg/12.5mg (N=166)§ | 収縮期 | 155.4(11.0) | −14.5(1.0) |
| 拡張期 | 97.1(5.3) | −8.7(0.6) | |
ロサルタンカリウム/ヒドロクロロチアジド100mg/12.5mgが投与された患者で副作用が報告されたのは166例中16例(9.6%)であり、主な副作用は血中尿酸増加4例(2.4%)であった23)。
17.1.4 国内第III相二重盲検比較試験及び長期投与試験
ロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgを8週間服用後に血圧コントロールが不十分であった日本人本態性高血圧症患者を対象に長期安全性を評価した第III相試験の二重盲検期(8週間)において、ロサルタンカリウム/ヒドロクロロチアジド100mg/12.5mgはロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mgと比べて、投与8週時の平均トラフ坐位拡張期血圧では同程度の降圧効果を示し、投与8週時の平均トラフ坐位収縮期血圧では上乗せの降圧効果を示した。投与8週時における平均トラフ坐位血圧のベースラインからの変化量を表2に示す23)25)。
| ベースラインの血圧†† | 投与8週時の変化量† | ||
| ロサルタンカリウム/ヒドロクロロチアジド50mg/12.5mg (N=144)§ | 収縮期 | 151.7(9.5) | −6.2(1.0) |
| 拡張期 | 95.9(5.4) | −5.3(0.7) | |
| ロサルタンカリウム/ヒドロクロロチアジド100mg/12.5mg (N=134)§ | 収縮期 | 152.4(11.2) | −8.5(1.0) |
| 拡張期 | 95.1(4.5) | −5.0(0.7) | |
また、ロサルタンカリウム/ヒドロクロロチアジド100mg/12.5mgの降圧効果は、収縮期及び拡張期血圧共に52週時においても持続した23)。
二重盲検期(8週間)において、ロサルタンカリウム/ヒドロクロロチアジド100mg/12.5mgが投与された患者で副作用が報告されたのは134例中7例(5.2%)であった。延長期(52週間)において、ロサルタンカリウム/ヒドロクロロチアジド100mg/12.5mgが投与された患者で副作用が報告されたのは265例中32例(12.1%)であり、主な副作用は血中尿酸増加7例(2.6%)、高尿酸血症4例(1.5%)、AST増加、BNP増加各3例(1.1%)であった23)。
二重盲検期(8週間)において、ロサルタンカリウム/ヒドロクロロチアジド100mg/12.5mgが投与された患者で副作用が報告されたのは134例中7例(5.2%)であった。延長期(52週間)において、ロサルタンカリウム/ヒドロクロロチアジド100mg/12.5mgが投与された患者で副作用が報告されたのは265例中32例(12.1%)であり、主な副作用は血中尿酸増加7例(2.6%)、高尿酸血症4例(1.5%)、AST増加、BNP増加各3例(1.1%)であった23)。
18. 薬効薬理
18.1 作用機序
ロサルタンカリウム/ヒドロクロロチアジドの配合成分であるロサルタンカリウム(ロサルタン)は、経口投与後速やかに吸収され、その一部が主代謝物であるカルボン酸体に変換される。ロサルタン及びカルボン酸体は、いずれも生理的昇圧物質であるアンジオテンシンII(AII)が作用する受容体(AT1受容体)に極めて高い親和性を示し、AIIの作用を選択的に拮抗することにより降圧効果を発揮する26)。ロサルタンは、レニン・アンジオテンシン系(RAS)が活性化されている高レニン性高血圧モデルにおいて著明な降圧効果を示し27)28)、逆にRASの関与が少ない低レニン性高血圧モデルにおける降圧効果は弱いことが知られている28)。一方の配合成分であるヒドロクロロチアジドは、チアジド系の降圧利尿薬である。ヒドロクロロチアジドの降圧機序に関しては、尿細管におけるナトリウム再吸収抑制作用による循環血液量減少作用が考えられている29)30)。また、ヒドロクロロチアジドはその利尿作用によりRASの活性化を起こす31)。
したがって、ロサルタンカリウム/ヒドロクロロチアジドはRAS活性化状態で著明な降圧効果を示すロサルタンとRASを活性化させるヒドロクロロチアジドとの配合剤であるため、両成分の併用投与は各単剤投与に比較しより顕著な降圧効果を示すと考える。
したがって、ロサルタンカリウム/ヒドロクロロチアジドはRAS活性化状態で著明な降圧効果を示すロサルタンとRASを活性化させるヒドロクロロチアジドとの配合剤であるため、両成分の併用投与は各単剤投与に比較しより顕著な降圧効果を示すと考える。
18.2 降圧作用
自然発症高血圧ラットにおいて、単独投与で中等度の降圧効果(約15mmHg低下)を示した用量のロサルタンと単独投与では降圧効果が認められなかった用量のヒドロクロロチアジドを併用投与することにより、著明な降圧効果(約30mmHg低下)が認められた。併用投与群における降圧効果は各単独投与群の効果と比較し有意であった32)。
19. 有効成分に関する理化学的知見
19.1. ロサルタンカリウム
19.2. ヒドロクロロチアジド
22. 包装
<ロサルヒド配合錠LD「日医工」>
100錠[10錠×10;PTP]
<ロサルヒド配合錠HD「日医工」>
100錠[10錠×10;PTP]
23. 主要文献
- 阿部真也 他, 周産期医学, 47 (10), 1353-1355, (2017)
- 齊藤大祐 他, 鹿児島産科婦人科学会雑誌, 29, 49-54, (2021)
- Rai A.,et al., Am.J.Respir.Crit.Care Med., 193, A1890, (2016)
- Jansson P.S.,et al., J.Emerg.Med., 55 (6), 836-840, (2018) »PubMed
- Vadas P., Am.J.Emerg.Med., 38 (6), 1299.e1-1299.e2, (2020)
- Kane S.P.,et al., Perfusion., 33 (4), 320-322, (2018) »PubMed
- Pottegard A.,et al., J.Intern.Med., 282 (4), 322-331, (2017) »PubMed
- Pedersen S.A.,et al., J.Am.Acad.Dermatol., 78 (4), 673-681, (2018) »PubMed
- 第I相単回投与試験(プレミネント錠:2006年10月20日承認、申請資料概要2.7.6.3)
- 第I相反復投与試験(プレミネント錠:2006年10月20日承認、申請資料概要2.7.6.4)
- 星野真人 他, 診療と新薬, 51 (3), 235-243, (2014)
- 食事の影響試験(プレミネント配合錠:2013年9月20日承認、審査報告書)
- 配合成分の薬物動態(プレミネント錠:2006年10月20日承認、申請資料概要2.7.2.3)
- Lo M.W.,et al., Clin.Pharmacol.Ther., 58 (6), 641-649, (1995) »PubMed
- 腎障害患者における薬物動態(プレミネント錠:2006年10月20日承認、申請資料概要2.7.2.3)
- 海外高齢男女高血圧症患者での反復投与試験(プレミネント錠:2006年10月20日承認、申請資料概要2.7.6.7)
- 薬物相互作用(プレミネント錠:2006年10月20日承認、申請資料概要2.5.6.2)
- 配合成分の薬物動態(プレミネント錠:2006年10月20日承認、審査報告書)
- 社内資料:生物学的同等性試験(配合錠HD)
- Saruta T.,et al., Hypertens.Res., 30 (8), 729-739, (2007) »PubMed
- 第III相二重盲検比較試験(プレミネント錠:2006年10月20日承認、申請資料概要2.7.6.8)
- 第III相長期投与試験(プレミネント錠:2006年10月20日承認、申請資料概要2.7.6.13)
- Rakugi H.,et al., Hypertens.Res., 37 (12), 1042-1049, (2014) »PubMed
- 国内第III相二重盲検比較試験(プレミネント配合錠:2013年9月20日承認、審査報告書)
- 国内第III相二重盲検比較試験及び長期投与試験(プレミネント配合錠:2013年9月20日承認、審査報告書)
- 第十八改正日本薬局方解説書, C6319-C6323, (2021), (廣川書店)
- 岡田恵 他, 基礎と臨床, 28 (13), 4063-4073, (1994)
- Wong P.C.,et al., J.Pharmacol.Exp.Ther., 252 (2), 726-732, (1990) »PubMed
- Shah S.,et al., Am.Heart J., 95 (5), 611-618, (1978) »PubMed
- 第十八改正日本薬局方解説書, C4338-C4343, (2021), (廣川書店)
- Lijnen P.,et al., Br.J.Clin.Pharmacol., 12 (3), 387-392, (1981) »PubMed
- 降圧作用(プレミネント錠:2006年10月20日承認、申請資料概要2.4.2.1)
24. 文献請求先及び問い合わせ先
文献請求先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
製品情報問い合わせ先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
26. 製造販売業者等
26.1 製造販売元
日医工株式会社
富山市総曲輪1丁目6番21