医薬品情報
| 総称名 | プリマキン |
|---|---|
| 一般名 | プリマキンリン酸塩 |
| 欧文一般名 | Primaquine Phosphate |
| 製剤名 | プリマキンリン酸塩製剤 |
| 薬効分類名 | 抗マラリア剤 |
| 薬効分類番号 | 6419 |
| ATCコード | P01BA03 |
| KEGG DRUG |
D02126
プリマキンリン酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年6月 改訂(再審査結果)(第3版)

|
1.警告 2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
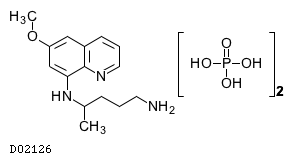
|---|---|---|---|---|---|
| プリマキン錠15mg「サノフィ」 | Primaquine Tablets「SANOFI」 | サノフィ | 6419005F1020 | 2242.8円/錠 | 劇薬, 処方箋医薬品 |
1. 警告
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
本剤は三日熱マラリア又は卵形マラリア原虫の休眠体を殺滅する目的(根治療法)のみに使用する薬剤であるため、赤血球中の原虫の殺滅に対しては他の抗マラリア剤を使用すること。また、本剤は赤血球中の原虫の殺滅に対する他の抗マラリア剤による治療後に使用すること。
6. 用法及び用量
通常、成人にはプリマキンとして30mgを1日1回14日間、食後に経口投与する。
通常、小児にはプリマキンとして0.5mg/kg(最大30mg)を1日1回14日間、食後に経口投与する。
8. 重要な基本的注意
8.1 本剤の使用に際しては、マラリアの診断・治療に関して十分な知識と経験をもつ医師又はその指導の下で行うこと。
8.2 本剤の服用により溶血性貧血、メトヘモグロビン血症があらわれるおそれがある。溶血性貧血は投与開始後1週間以内に認められることがあるので、本剤の投与前及び投与中は、ヘモグロビン値、ハプトグロビン値等の血液検査を頻回に行い、異常が認められた場合は本剤による治療継続の可否を慎重に判断すること。患者に対し、溶血性貧血を示唆する徴候(尿の暗色化、青白い肌、息切れ、めまい、疲労など)や、メトヘモグロビン血症の徴候(青みがかった唇や爪など)がみられた場合には、直ちに使用を中止し、医師に連絡するよう指導すること。危険因子のない患者でもメトヘモグロビン濃度を一過性に最大10%上昇させる可能性がある。[1.、2.2、9.1.2、10.2、11.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 関節リウマチやエリテマトーデスなどによって顆粒球減少の傾向を呈する患者
顆粒球減少の発現が増加するおそれがある。
9.1.2 溶血性貧血の既往あるいは家族歴のある患者及び先天性NADH・メトヘモグロビン還元酵素欠損症の患者
9.1.3 心疾患等のリスクを有する患者
9.1.4 遺伝的にCYP2D6の活性が欠損している患者(Poor Metabolizer)又はCYP2D6の活性が低い患者(Intermediate Metabolizer)
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性には、本剤投与中及び最終投与後6ヵ月間において避妊する必要性及び適切な避妊法について説明すること。[9.5、15.2.1、15.2.3参照]
9.4.2 男性には、本剤投与中及び最終投与後3ヵ月間においてバリア法(コンドーム)を用いて避妊する必要性について説明すること。[15.2.1参照]
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。授乳婦にプリマキン0.5mg/kgを投与したところ、乳汁中にプリマキンが移行すること、生後1ヶ月以上のG6PDが正常な乳児における授乳を介したプリマキンの相対投与量は授乳婦への投与量の1%未満であったことが報告されている。
9.7 小児等
本剤投与による溶血性貧血を含むリスクとベネフィットを考慮した上で、投与の可否を慎重に判断すること。4歳未満の小児に対する臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に、生理機能が低下している。
10. 相互作用
10.2 併用注意
| 溶血性貧血が報告されている薬剤 イブプロフェン等の解熱消炎鎮痛剤、セフェム系抗生物質製剤、メチルチオニニウム塩化物水和物(メチレンブルー)等 [1.、8.2、9.1.2、11.1.1参照] | 併用により溶血性貧血の危険性が高まる可能性がある。 | 両剤の相加的な溶血作用によるものと考えられる。 |
| 骨髄抑制を起こすおそれのある薬剤 抗悪性腫瘍剤、骨髄抑制剤、ペニシラミン、金製剤等 | 併用により骨髄抑制による副作用が増強するおそれがある。 | 機序は不明である。 |
| QT延長を起こすことが知られている薬剤 キノロン系抗菌薬 モキシフロキサシン塩酸塩、レボフロキサシン水和物等 クラスIA抗不整脈薬 キニジン、プロカインアミド等 クラスIII抗不整脈薬 アミオダロン、ソタロール等 スルピリド、イミプラミン、ピモジド、ハロペリドール、エリスロマイシン、コハク酸ソリフェナシン等 [9.1.3参照] | QT延長を起こすおそれがある。 | 機序は不明である。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 溶血性貧血、白血球減少、メトヘモグロビン血症(いずれも頻度不明)
11.2 その他の副作用
| 頻度不明 | |
| 過敏症 | 発疹、そう痒症 |
| 消化器 | 悪心、嘔吐、胃部不快感、腹痛 |
| 精神神経系 | 浮動性めまい |
13. 過量投与
13.1 症状
本剤の過量投与により、腹部仙痛、嘔吐、黄疸、心窩部灼熱感・苦悶、不整脈及びQT延長を含む心臓血管系の障害、中枢神経系の障害、チアノーゼ、メトヘモグロビン血症、中等度の白血球増加又は白血球減少、貧血、顆粒球減少、急性溶血性貧血などが発現することがある。[9.1.3参照]
13.2 処置
症状のあるメトヘモグロビン血症に対しては、メチルチオニニウム塩化物水和物(メチレンブルー)1〜2mg/kgにより治療すること。
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子10例にプリマキン30mgを単回投与したときの薬物動態パラメータを以下に示す9)(外国人データ)。
| 投与量(mg) | Cmax(ng/mL) | tmax(h) | AUCinf(ng・h/mL) | t1/2(h) |
| 30 | 120(81-151) | 2.0(1.0-2.0)注1) | 1094(454-1723) | 7.9±2.5注2) |
16.1.2 反復投与
三日熱マラリア患者7例にプリマキン15mg注3)を1日1回14日間反復経口投与したときの薬物動態パラメータを以下に示す10)(外国人データ)。
| 測定日 | Cmax(ng/mL) | tmax(h) | AUCinf(ng・h/mL) | t1/2(h) |
| 1日目 | 50.7±21.2 | 2.3±1.1 | 480±260 | 5.6±1.0 |
| 14日目 | 49.7±14.4 | 2.1±0.9 | 490±190 | 5.8±0.9 |
16.2 吸収
16.2.1 生物学的利用率
健康成人5例にプリマキン45mg注3)を単回投与したときの経口バイオアベイラビリティは96%であった11)(外国人データ)。
16.2.2 食事の影響
健康成人20例にプリマキン30mgを空腹時及び食直後に単回経口投与したとき、プリマキンのCmax及びAUCinfの幾何平均は、食直後の投与により空腹時投与よりも、それぞれ26%及び14%増加した。tmax(中央値)は、空腹時投与で2.0時間、食事直後の投与で1.5時間であった9)(外国人データ)。
16.3 分布
血漿中のプリマキンは主にα1-酸性糖タンパク質に結合することが示唆された12)(in vitro)。
16.4 代謝
16.5 排泄
健康被験者6例にプリマキン45mg注3)を単回経口投与したときの投与24時間後までの未変化体の尿中排泄率は1%未満であった。プリマキンの終末相半減期は6時間、血漿中の主代謝物であるカルボキシプリマキンの終末相半減期は22時間であった。カルボキシプリマキンはさらに代謝され、生成する代謝物は主に尿より排泄されることが示唆された14)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者における体内動態
慢性腎疾患患者24例にプリマキン15mg注3)を単回投与したとき、健康成人の薬物動態に比較して違いは認められなかった15)(外国人データ)。
16.7 薬物相互作用
16.7.1 代謝酵素
16.7.2 併用薬の影響
プリマキンの薬物動態パラメータに及ぼす併用薬の影響を以下に示す20)(外国人データ)。
| 併用薬 | 例数 | プリマキンの用法・用量注3) | 併用薬の用法・用量 | Cmax(ng/mL) | CLPO(L/h) |
| メフロキン | 9 | 45mg単回 | 非併用 | 167(113-532) | 33.1(17.6-49.3) |
| 10mg/kg単回 | 229(114-503) | 34.0(21.7-49.0) | |||
| キニーネ | 7 | 45mg単回 | 非併用 | 271(147-431) | 24.8(12.6-48.4) |
| 10mg/kg1日3回 | 295(64-308) | 21.3(15.9-73.0) |
16.7.3 プリマキンの影響
併用薬の薬物動態パラメータに及ぼすプリマキンの影響を以下に示す21)22)(外国人データ)。
| 併用薬 | 例数 | 併用薬の用法・用量 | プリマキンの用法・用量注3) | Cmax(ng/mL) | AUCinf(ng・h/mL) |
| メフロキン | 8 | 750mg単回 | 非併用 | 1161±120 | 20.0±3.8注4) |
| 45mg単回 | 1179±153 | 20.2±4.8注4) | |||
| エチニルエストラジオール | 6 | エチニルエストラジオール/レボノルゲストレル: 30/150μg単回 | 非併用 | − | 929±188 |
| 45mg単回 | 985±223 | ||||
| レボノルゲストレル | 6 | 非併用 | − | 22.4±6.5 | |
| 45mg単回 | 29.7±10.3 |
注3)国内で承認された本剤の用法及び用量は30mg1日1回14日間である。
注4)μg・day/mL
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外用量検討試験
アーテスネート(本邦未承認薬)が投与された12〜60歳の三日熱マラリア患者399例を対象にプリマキンを投与し、28日間追跡した試験の結果は以下のとおりであった。有害事象の発現率は頭痛4.5%(3/66例)、めまい3.0%(2/66例)、食欲不振、悪心及び下痢が各1例(1.5%)であった23)(外国人データ)。
| 用法・用量 | 例数 | 再発例(%) |
| 30mg/日 14日間 | 52 | 0 |
17.1.2 プラセボを対照薬とした海外比較試験
クロロキン(本邦未承認薬)が投与された3歳以上の三日熱マラリア患者200例にプラセボを対照として、プリマキン0.5mg/kg/日注)14日間又はプリマキン0.75mg/kg/週8週間投与注)し、11ヵ月間追跡した試験の結果は以下のとおりであった24)(外国人データ)。
| 投与群 | 症例数 | 再発例数(%) |
| プラセボ8週間投与群 | 71 | 22(31.0) |
| プリマキン14日間投与群:0.5mg/kg/日 | 55 | 1(1.8) |
| プリマキン8週間投与群:0.75mg/kg/週 | 74 | 4(5.1) |
注)国内で承認された本剤の用法及び用量は、30mg1日1回14日間である。
18. 薬効薬理
18.1 作用機序
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. プリマキンリン酸塩
22. 包装
14錠[ボトル、バラ]
23. 主要文献
- Ono T,et al., Mutat Res., 325 (1), 7-10, (1994) »PubMed
- Chatterjee T,et al., Mutagenesis., 13 (6), 619-24, (1998) »PubMed
- Shubber E K,et al., Cell Biol Toxicol., 2 (3), 379-99, (1986) »PubMed
- Marrs T C,et al., Toxicol Lett., 36 (3), 281-7, (1987) »PubMed
- Lee C C,et al., Bull World Health Organ., 59 (3), 439-48, (1981) »PubMed
- Schmidt I G,et al., J Neuropathol Exp Neurol., 10 (3), 231-56, (1951) »PubMed
- Trutter J A,et al., The Toxicologist., 3 (1), 65, (1983)
- Beveridge E,et al., Trans R Soc Trop Med Hyg., 74 (1), 43-51, (1980) »PubMed
- Cuong B T,et al., Br J Clin Pharmacol., 61 (6), 682-9, (2006) »PubMed
- Bhatia S C,et al., Eur J Clin Pharmacol., 31 (2), 205-10, (1986) »PubMed
- Mihaly G W,et al., Br J Clin Pharmacol., 19 (6), 745-50, (1985) »PubMed
- Zsila F,et al., Bioorg Med Chem., 16 (7), 3759-72, (2008) »PubMed
- Mihaly G W,et al., Br J Clin Pharmacol., 17 (4), 441-6, (1984) »PubMed
- Fletcher K A,et al., Bull World Health Organ., 59 (3), 407-12, (1981) »PubMed
- Kulkarni S P,et al., Indian J Pharmacol., 45 (4), 330-3, (2013) »PubMed
- Pybus B S,et al., Malar J., 11, 259, (2012) »PubMed
- Li X Q,et al., Eur J Clin Pharmacol., 59 (5-6), 429-42, (2003) »PubMed
- Jin X,et al., Eur J Drug Metab Pharmacokinet., 39 (2), 139-46, (2014) »PubMed
- Bapiro T E,et al., Drug Metab Dispos., 29 (1), 30-5, (2001) »PubMed
- Edwards G,et al., Br J Clin Pharmacol., 35 (2), 193-8, (1993) »PubMed
- Karbwang J,et al., Eur J Clin Pharmacol., 42 (5), 559-60, (1992) »PubMed
- Back D J,et al., Contraception., 30 (3), 289-95, (1984) »PubMed
- Krudsood S,et al., Am J Trop Med Hyg., 78 (5), 736-40, (2008) »PubMed
- Leslie T,et al., PLoS One., 3 (8), e2861, (2008) »PubMed
- Lanners H N, Parasitol Res., 77 (6), 478-81, (1991) »PubMed
- Beutler E,et al., Am J Trop Med Hyg., 77 (4), 779-89, (2007) »PubMed
- Dembele L,et al., PLoS One., 6 (3), e18162, (2011) »PubMed
- Voorberg-van der Wel A,et al., PLoS One., 8 (1), e54888, (2013) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
サノフィ株式会社
くすり相談室
〒163-1488
東京都新宿区西新宿三丁目20番2号
電話:フリーダイヤル 0120-109-905
製品情報問い合わせ先
サノフィ株式会社
くすり相談室
〒163-1488
東京都新宿区西新宿三丁目20番2号
電話:フリーダイヤル 0120-109-905
26. 製造販売業者等
26.1 製造販売元
サノフィ株式会社
〒163-1488
東京都新宿区西新宿三丁目20番2号