医薬品情報
| 総称名 | デザレックス |
|---|---|
| 一般名 | デスロラタジン |
| 欧文一般名 | Desloratadine |
| 製剤名 | デスロラタジン錠 |
| 薬効分類名 | 持続性選択H1受容体拮抗・アレルギー性疾患治療剤 |
| 薬効分類番号 | 4490 |
| ATCコード | R06AX27 |
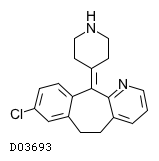
| KEGG DRUG |
D03693
デスロラタジン
|
| KEGG DGROUP |
DG01482
ヒスタミンH1受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年5月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| デザレックス錠5mg | DESALEX Tablets 5mg | オルガノン | 4490032F1023 | 38.7円/錠 | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分又はロラタジンに対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、12歳以上の小児及び成人にはデスロラタジンとして1回5mgを1日1回経口投与する。
8. 重要な基本的注意
<効能共通>
8.1 効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
<アレルギー性鼻炎>
8.2 季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 てんかんの既往のある患者
十分な問診を行うこと。発作があらわれることがある。[11.1.2参照]
9.2 腎機能障害患者
デスロラタジンの血漿中濃度が上昇するおそれがある。[16.6.1参照]
9.3 肝機能障害患者
デスロラタジンの血漿中濃度が上昇するおそれがある。[16.6.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、投与を避けることが望ましい。本剤の動物試験(ラット、ウサギ)で催奇形性は認められていないが、ロラタジンを投与したラットの試験でデスロラタジンの胎児への移行が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ロラタジンの臨床試験で、デスロラタジンのヒト母乳中への移行が報告されている1)。
9.7 小児等
国内において、低出生体重児、新生児、乳児、幼児及び12歳未満の小児を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| エリスロマイシン ケトコナゾール [16.7参照] | デスロラタジン及び3-OHデスロラタジンの血漿中濃度の上昇が認められた。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(チアノーゼ、呼吸困難、血圧低下、血管浮腫等)があらわれることがある。
11.1.2 てんかん(頻度不明)[9.1.1参照]
11.1.3 痙攣(頻度不明)
11.1.4 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTP、Al-P、LDH、ビリルビン等の著しい上昇を伴う肝機能障害、黄疸があらわれることがある。
11.2 その他の副作用
| 2%未満 | 頻度不明 | |
| 神経系障害 | 傾眠 | 頭痛、精神運動亢進 |
| 心臓障害 | 頻脈、動悸 | |
| 胃腸障害 | 口内乾燥 | |
| 皮膚及び皮下組織障害 | 発疹 | |
| 一般・全身障害及び投与部位の状態 | 疲労 | |
| その他 | 白血球数増加、血中コレステロール増加 | 食欲亢進 |
12. 臨床検査結果に及ぼす影響
アレルゲン皮内反応を抑制するため、アレルゲン皮内反応検査を実施する3〜5日前から本剤の投与を中止すること。
13. 過量投与
13.1 処置
本剤は血液透析によって除去できない。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性にデスロラタジン錠2.5、5及び10mg注1)を空腹時単回経口投与したとき、血漿中デスロラタジン濃度は以下の図表に示したとおりであり、Cmax及びAUCについて用量比例性が認められた2)。
| 用量 | 例数 | Tmax†(hr) | Cmax††(ng/mL) | AUC0-∞††(ng・hr/mL) | t1/2††(hr) |
| 2.5mg | 8 | 2.50[1-4] | 1.46(24) | 20.1(29) | 19.7(11) |
| 5mg | 8 | 1.75[0.5-3] | 3.55(37) | 43.1(37) | 19.5(18) |
| 10mg | 8 | 1.50[1-2.5] | 6.95(14) | 84.8(26) | 18.5(18) |
図 デスロラタジン錠を空腹時単回経口投与したときの血漿中濃度推移
16.1.2 反復投与
健康成人男性(8例)にデスロラタジン錠5mgを空腹時に1日1回10日間反復経口投与したとき、血漿中デスロラタジン濃度は投与開始後5日目までに定常状態に到達し、Cmax及びAUC0-24hrについて算出した累積係数はそれぞれ1.30及び1.47であった2)。
| 用量 | 例数 | Tmax†(hr) | Cmax††(ng/mL) | AUC0-24hr††(ng・hr/mL) | t1/2††(hr) |
| 5mg | 8 | 2.00[1-4] | 4.21(32) | 47.4(42) | 22.7(19) |
16.2 吸収
16.2.1 食事の影響
健康成人(24例)にデスロラタジン錠5mgを食後(高脂肪高カロリー食)に単回経口投与したとき、血漿中デスロラタジン及び3-OHデスロラタジン濃度(Cmax及びAUC)への影響はいずれも認められなかった3)(外国人データ)。
| 比較 | 例数 | デスロラタジン | 3-OHデスロラタジン | ||
| Cmax | AUC0-∞ | Cmax | AUC0-∞ | ||
| 食事の影響(食後/空腹時) | 24 | 1.08[0.96-1.20] | 1.07[0.97-1.19] | 0.98[0.88-1.09] | 0.98[0.90-1.07] |
16.3 分布
16.3.1 分布容積
健康成人にデスロラタジン5mgを単回経口投与したときの見かけの分布容積は約3,300Lであった4)。
16.3.2 血漿蛋白結合
ヒト血漿に14C-デスロラタジンを添加したときの蛋白結合率は82.8%〜87.2%であった5)(in vitro)。
16.4 代謝
ヒトに経口投与したとき、デスロラタジンは主に3-OHデスロラタジンに代謝されたのち、グルクロン酸抱合体へと代謝される6)(外国人データ)。
16.5 排泄
健康成人男性(5例)に14C-デスロラタジン10mg注1)を空腹時に単回経口投与したとき、投与放射能の87.1%が代謝物として尿(40.6%)及び糞(46.5%)中に排泄された。未変化体の尿中及び糞中への排泄率はそれぞれ1.7%及び6.7%であった6)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
軽度[クレアチニンクリアランス(CLcr):51〜80mL/min/1.73m2、6例]、中等度(CLcr:30〜50mL/min/1.73m2、6例)又は重度(CLcr:10〜29mL/min/1.73m2、6例)の慢性腎機能障害患者にデスロラタジン錠5mgを反復経口投与したとき、健康成人(CLcr:>80mL/min/1.73m2、9例)と比較してCmax及びAUC0-24hrは軽度〜中等度腎機能障害患者で約1.3〜2.1倍、重度腎機能障害患者で約2.6倍に、それぞれ上昇した7)(外国人データ)。[9.2参照]
| 腎機能障害 | 例数 | Tmax†(hr) | Cmax††(ng/mL) | AUC0-24hr††(ng・hr/mL) |
| 軽度 | 6 | 3.50[1.5-5] | 4.33(21) | 59.9(28) |
| 中等度 | 6 | 3.00[1.5-12] | 6.11(73) | 95.8(104) |
| 重度 | 6 | 1.75[1.5-5] | 7.61(70) | 120(89) |
| 正常 | 9 | 3.00[1.5-8] | 2.96(50) | 45.5(61) |
16.6.2 肝機能障害患者
軽度(Child-Pughスコア:5〜6)、中等度(Child-Pughスコア:7〜9)又は重度(Child-Pughスコア:10〜15)の慢性肝機能障害患者(各4例)及び健康成人(8例)にデスロラタジン錠7.5mg注1)を空腹時に単回経口投与したとき、血漿中デスロラタジン濃度の薬物動態パラメータは以下の表に示したとおりであった。肝機能障害患者のCmax及びAUCは、健康成人と比較してそれぞれ約1.8〜2.2倍及び約2.0〜2.9倍に上昇した8)(外国人データ)。[9.3参照]
| 肝機能障害 | 例数 | Tmax†(hr) | Cmax††(ng/mL) | AUC0-∞††(ng・hr/mL) | t1/2††(hr) |
| 軽度 | 4 | 6.75[1-24] | 5.07(19) | 312(110) | 68.7(63) |
| 中等度 | 4 | 1.75[1-2] | 6.48(52) | 245(19) | 60.3(10) |
| 重度 | 4 | 1.75[1-5] | 5.90(40) | 345(55) | 62.3(27) |
| 正常 | 8 | 5.00[4-8] | 2.89(23) | 120(123) | 43.4(80) |
16.6.3 高齢者
高齢者(17例、年齢:65〜70歳)にデスロラタジン錠5mgを1日1回10日間反復経口投与したとき、血漿中デスロラタジン濃度のCmax及びAUCは、非高齢対照(95例、年齢:19〜64歳)と比較していずれも約20%上昇した。高齢者でのデスロラタジンのt1/2は平均31.0時間(幾何平均)であり、非高齢対照群と比較して約30%延長した9)(外国人データ)。
16.7 薬物相互作用
健康成人を対象として、CYP3A4の阻害剤(ケトコナゾール注2)、エリスロマイシン、アジスロマイシン)、CYP2D6の阻害剤(フルオキセチン)又はCYP3A4及び2D6の阻害剤(シメチジン)とデスロラタジン錠5mg又は7.5mg注1)を反復併用投与したとき、血漿中デスロラタジン及び3-OHデスロラタジン濃度の変化率は下表に示すとおりであり10)、いずれの併用においてもQTc間隔を含め心電図への影響は認められなかった11)(外国人データ)。[10.2参照]
| 併用薬 | 例数 | デスロラタジン | 3-OHデスロラタジン | ||
| Cmax | AUC0-24hr | Cmax | AUC0-24hr | ||
| ケトコナゾール†200mg 1日2回 | 24 | 1.29[1.06-1.56] | 1.21[1.01-1.45] | 1.77[1.27-2.47] | 2.10[1.63-2.70] |
| ケトコナゾール††400mg 1日1回 | 30 | 1.56[1.43-1.70] | 1.67[1.56-1.80] | 1.59[1.48-1.71] | 1.68[1.58-1.78] |
| エリスロマイシン†500mg 1日3回 | 24 | 1.24[1.17-1.31] | 1.14[1.08-1.19] | 1.43[1.39-1.48] | 1.40[1.34-1.46] |
| アジスロマイシン††500mg単回(初日)+250mg 1日1回 | 18 | 1.15[0.92-1.44] | 1.05[0.82-1.34] | 1.15[0.98-1.36] | 1.04[0.88-1.22] |
| フルオキセチン††20mg 1日1回 | 18 | 1.15[0.95-1.39] | 1.00[0.82-1.23] | 1.17[1.00-1.36] | 1.13[0.96-1.32] |
| シメチジン††600mg 1日2回 | 18 | 1.12[0.86-1.45] | 1.19[0.88-1.61] | 0.89[0.73-1.07] | 0.97[0.81-1.16] |
注1)本剤の承認された用量は、1日1回5mgである。
注2)国内では外用剤のみ発売
17. 臨床成績
17.1 有効性及び安全性に関する試験
<アレルギー性鼻炎>
17.1.1 国内第III相試験
(1)
16歳以上の季節性アレルギー性鼻炎患者を対象とした第III相二重盲検比較試験の結果、患者評価による投与2週間平均の4鼻症状スコアの合計(くしゃみ発作、鼻汁、鼻閉及び鼻内そう痒感の各スコアの合計)のベースラインからの変化量において、デスロラタジン5mgの1日1回投与は、プラセボの1日1回投与に対して優越性を示した(p<0.001)(表1)。
| デスロラタジン5mg群 | プラセボ群 | |
| ベースラインa) | 8.33±1.27(223) | 8.39±1.29(225) |
| 投与2週間b) | 6.93±1.93(223) | 7.79±1.81(225) |
| ベースラインからの変化量 | −1.40±1.83(223) | −0.60±1.69(225) |
| プラセボ群との最小二乗平均差[95%信頼区間]c)、p値c) | −0.83[−1.14,−0.51] p<0.001 | / |
副作用は、223例中13例(5.8%)に認められた。主なものは、尿中蛋白陽性、白血球数増加の各3例(1.3%)、傾眠2例(0.9%)であった。
(2)12歳以上の通年性アレルギー性鼻炎患者を対象とした第III相二重盲検比較試験の結果、医師評価による2週間投与後の4鼻症状スコアの合計のベースラインからの変化量において、デスロラタジン5mgの1日1回投与は、プラセボの1日1回投与に対して優越性を示さなかった。
副作用は認められなかった。
副作用は認められなかった。
<蕁麻疹>
17.1.2 国内第III相試験
12歳以上の慢性蕁麻疹患者を対象とした第III相二重盲検比較試験の結果、医師評価による2週間投与後の痒みスコア(日中又は夜間の症状のうち程度の高い方)と発斑スコア(総合)の合計のベースラインからの変化量において、デスロラタジン5mgの1日1回投与は、プラセボの1日1回投与に対して優越性を示した(p<0.001)。
| デスロラタジン5mg群 | プラセボ群 | |
| ベースライン | 4.98±1.02(80) | 4.91±0.75(80) |
| 投与2週後 | 1.79±1.52(80) | 2.81±1.83(72) |
| ベースラインからの変化量 | −3.19±1.68(80) | −2.07±1.83(72) |
| プラセボ群との最小二乗平均差[95%信頼区間]a)、p値a) | −1.17[−1.69,−0.65] p<0.001 | / |
副作用は、80例中7例(8.8%)に認められた。主なものは、傾眠3例(3.8%)であった。
<皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒>
17.1.3 国内第III相試験
12歳以上の湿疹・皮膚炎及び皮膚そう痒症患者を対象とした第III相長期投与試験の結果、デスロラタジン5mgを1日1回2週間投与後の医師評価による痒みスコア(日中の症状及び夜間の症状)の合計のベースラインからの変化量は表3のとおりであった。
| 湿疹・皮膚炎群 | 皮膚そう痒症群 | 全体 | |
| ベースライン | 4.75±1.10(65) | 5.10±1.47(29) | 4.86±1.23(94) |
| 投与2週後 | 3.06±1.33(63) | 2.93±1.69(29) | 3.02±1.44(92) |
| ベースラインからの変化量 | −1.67±1.32(63) | −2.17±1.91(29) | −1.83±1.54(92) |
| 変化量の最小二乗平均[95%信頼区間]a) | −1.63[−2.01,−1.25] | −2.17[−2.74,−1.61] | −1.99[−2.39,−1.59] |
副作用は、94例中8例(8.5%)に認められた。主なものは、傾眠4例(4.3%)であった。
17.3 その他
17.3.1 眠気及び運転・機械操作能力に対する影響
デスロラタジン服用後の眠気、精神運動機能及び自動車運転能力に対する影響はプラセボ服用後と同程度であった。
(1)健康成人男女を対象に日中の眠気及び精神運動機能を評価した2試験の結果(19例及び22例)、デスロラタジン7.5mg注)単回投与時の日中の眠気(覚醒維持検査スコア及び睡眠潜時反復検査スコア)及び精神運動機能はプラセボ投与時と有意差がなかった12)13)(外国人データ)。
(2)健康成人男性(21例)を対象に飛行条件を模した低圧室内での眠気及び操縦操作能力に及ぼす影響を検討したとき、デスロラタジン5mg単回投与時の眠気及び操縦操作能力はプラセボ投与時と有意差がなかった14)(外国人データ)。
(3)健康成人男女(18例)を対象に路上での自動車運転能力及び精神運動機能に及ぼす影響を検討したとき、デスロラタジン5mg単回投与時の自動車運転能力及び精神運動機能はプラセボ投与時と差がなかった15)(外国人データ)。
17.3.2 心血管系に及ぼす影響
健康成人男女(24例)にデスロラタジン45mg注)(臨床用量の9倍)を1日1回10日間反復投与したとき、臨床的に意味のあるQTc間隔の延長は認められなかった16)(外国人データ)。
注)本剤の承認された用量は、1日1回5mgである。
18. 薬効薬理
18.1 作用機序
デスロラタジンはロラタジンの活性代謝物であり、持続的なヒスタミンH1受容体拮抗作用を有するアレルギー性疾患治療薬である。
18.2 ヒスタミンH1受容体拮抗作用
18.3 炎症性サイトカイン等の産生抑制作用
19. 有効成分に関する理化学的知見
19.1. デスロラタジン
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
23. 主要文献
- Hilbert J,et al., J Clin Pharmacol., 28, 234-9, (1988) »PubMed
- 社内資料:日本人での単回及び反復投与試験(2016年9月28日承認、CTD2.7.2.2)
- 社内資料:食事の影響(2016年9月28日承認、CTD2.7.1.2)
- 社内資料:分布容積(2016年9月28日承認、CTD2.7.2.3)
- 社内資料:血漿蛋白結合(2016年9月28日承認、CTD2.6.4.4)
- 社内資料:マスバランス試験(2016年9月28日承認、CTD2.7.2.2)
- 社内資料:腎機能障害による影響(2016年9月28日承認、CTD2.7.2.2)
- 社内資料:肝機能障害による影響(2016年9月28日承認、CTD2.7.2.2)
- 社内資料:高齢者を含む健康成人を対象とした試験(2016年9月28日承認、CTD2.7.2.2)
- 社内資料:薬物相互作用試験(薬物動態)(2016年9月28日承認、CTD2.7.2.2)
- 社内資料:薬物相互作用試験(薬力学)(2016年9月28日承認、CTD2.7.6.2)
- 社内資料:日中の傾眠及び精神運動機能への影響評価試験(2016年9月28日承認、CTD2.7.2.2)
- 社内資料:睡眠潜時反復検査(MSLT)評価試験(2016年9月28日承認、CTD2.7.2.2)
- 社内資料:操縦能力への影響評価試験(2016年9月28日承認、CTD2.7.2.2)
- 社内資料:自動車運転能力への影響評価試験(2016年9月28日承認、CTD2.7.2.2)
- 社内資料:高用量心電図試験(2016年9月28日承認、CTD2.7.2.2)
- Anthes JC,et al., Eur J Pharmacol., 449, 229-37, (2002) »PubMed
- Kreutner W,et al., Arzneimittelforschung., 50, 345-52, (2000) »PubMed
- Lippert U,et al., Exp Dermatol., 4, 272-6, (1995) »PubMed
- Schroeder JT,et al., Clin Exp Allergy., 31, 1369-77, (2001) »PubMed
- Molet S,et al., Clin Exp Allergy., 27, 1167-74, (1997) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
杏林製薬株式会社
くすり情報センター
〒160-0017
東京都新宿区左門町20番地
電話:0120-409-341 受付時間 9:00〜17:30(土・日・祝日・会社休日を除く)
科研製薬株式会社
医薬品情報サービス室
〒113-8650
東京都文京区本駒込二丁目28番8号
電話:0120-519-874 受付時間 9:00〜17:00(土・日・祝日・会社休日を除く)
製品情報問い合わせ先
杏林製薬株式会社
くすり情報センター
〒160-0017
東京都新宿区左門町20番地
電話:0120-409-341 受付時間 9:00〜17:30(土・日・祝日・会社休日を除く)
科研製薬株式会社
医薬品情報サービス室
〒113-8650
東京都文京区本駒込二丁目28番8号
電話:0120-519-874 受付時間 9:00〜17:00(土・日・祝日・会社休日を除く)
26. 製造販売業者等
26.1 製造販売元
オルガノン株式会社
東京都港区南青山1-24-3
26.2 発売元
杏林製薬株式会社
東京都千代田区大手町一丁目3番7号
26.3 プロモーション提携
科研製薬株式会社
東京都文京区本駒込二丁目28番8号