医薬品情報
| 総称名 | ビラノア |
|---|---|
| 一般名 | ビラスチン |
| 欧文一般名 | Bilastine |
| 製剤名 | ビラスチン錠 |
| 薬効分類名 | アレルギー性疾患治療剤 |
| 薬効分類番号 | 4490 |
| ATCコード | R06AX29 |
| KEGG DRUG |
D09570
ビラスチン
|
| KEGG DGROUP |
DG01482
ヒスタミンH1受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年7月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 12.臨床検査結果に及ぼす影響 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ビラノア錠20mg | Bilanoa tablets | 大鵬薬品工業 | 4490033F1028 | 48.7円/錠 | 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、成人にはビラスチンとして1回20mgを1日1回空腹時に経口投与する。
8. 重要な基本的注意
<効能共通>
8.1 効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
<アレルギー性鼻炎>
8.2 本剤を季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.2.1 中等度(30≦GFR<50mL/min/1.73m2)又は重度(GFR<30mL/min/1.73m2)の腎機能障害のある患者
本剤の血漿中濃度が上昇するおそれがある。[16.6.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
授乳中の女性には治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般的に生理機能が低下していることが多く、腎臓からも排泄される本剤では血中濃度が上昇するおそれがある。[16.5参照]
10. 相互作用
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
11.2 その他の副作用
| 1%未満 | 頻度不明 | |
| 精神神経系 | 眠気、頭痛 | めまい、不眠、不安 |
| 消化器 | 口渇、下痢、腹痛 | 胃不快感、口内乾燥、消化不良、胃炎、悪心 |
| 循環器 | 右脚ブロック、洞性不整脈、心電図QT延長、心電図異常、頻脈、動悸 | |
| 肝臓 | AST上昇、γ-GTP上昇 | ALT上昇 |
| 腎臓 | 血中クレアチニン上昇 | |
| 呼吸器 | 鼻乾燥 | 呼吸困難、鼻部不快感 |
| 過敏症 | 発疹、そう痒症、血管性浮腫、多形紅斑 | |
| その他 | 耳鳴、発熱、体重増加、トリグリセリド上昇、無力症、口腔ヘルペス、食欲亢進、疲労 |
12. 臨床検査結果に及ぼす影響
本剤は、アレルゲン皮内反応を抑制するため、アレルゲン皮内反応検査を実施する3〜5日前より本剤の投与を中止することが望ましい。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
健康成人男性20例に本剤20mgを空腹時単回経口投与したとき、血漿中濃度は速やかに上昇し、投与後1.00時間で最高血漿中濃度277.86ng/mLに到達した後、消失半減期10.54時間で消失した2)。
本剤の薬物動態は10mg、20mg及び50mgの用量注1)で線形性を示した。反復投与による蓄積はなかった3)。
本剤の薬物動態は10mg、20mg及び50mgの用量注1)で線形性を示した。反復投与による蓄積はなかった3)。
注1)本剤の承認用量は1回20mg、1日1回である。
本剤20mg単回経口投与時のビラスチン血漿中濃度
空腹時投与、平均値±標準偏差(20例)
| 投与量(mg) | Cmax(ng/mL) | tmax(hr) | AUC0-inf(ng・hr/mL) | t1/2(hr) |
| 20 | 277.86(117.40) | 1.00(0.5-2.5) | 1296.45a(368.26) | 10.54a(5.50) |
16.2 吸収
16.2.1 食事の影響
健康成人男性20例にクロスオーバー法で空腹時及び食後(高脂肪食)に本剤20mgを単回経口投与したとき空腹時に比べ食後投与時のCmax及びAUC0-tはそれぞれ約60%及び約40%低下した2)。
16.3 分布
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
成人の腎機能障害患者に本剤20mgを単回経口投与したとき、重度の腎機能障害患者におけるビラスチンのCmax及びAUC0-infは健康成人に比べそれぞれ1.6倍及び2.3倍高かった8)(外国人データ)。[9.2.1参照]
| 腎機能[GFR(mL/min/1.73m2)] | Cmax(ng/mL) | tmax(hr) | AUC0-inf(ng・hr/mL) | t1/2(hr) |
| 正常(GFR>80) | 144.0(57.8) | 1.5(1.0-3.0) | 737.4(260.8) | 9.26(2.79) |
| 軽度低下(50≦GFR≦80) | 172.1(45.0) | 1.5(0.5-3.0) | 967.4(140.2) | 15.08(7.66) |
| 中等度低下(30≦GFR<50) | 271.1(30.4) | 2.25(1.0-2.5) | 1384.2(263.2) | 10.47(2.34) |
| 重度低下(GFR<30) | 228.8(81.8) | 1.5(0.5-3.0) | 1708.5(699.0) | 18.39(11.40) |
16.6.2 高齢者
若齢男性及び女性(18〜35歳)、高齢男性及び女性(65歳以上)の4グループ(各8例、計32例)に本剤20mgを単回経口投与したとき、若齢男性と高齢男性ではビラスチンのCmax及びAUC0-infに差はなかった。若齢女性と高齢女性ではビラスチンのCmaxは若齢女性が1.7倍高かったが、AUC0-infに差はなかった9)(外国人データ)。
16.7 薬物相互作用
ビラスチンは有機アニオン輸送ポリペプチドOATP1A2の基質である1)。
16.7.1 エリスロマイシン
16.7.2 ケトコナゾール
健康成人24例に本剤20mg1日1回とケトコナゾール注2)400mg1日1回6日間併用反復経口投与したとき、血漿中ビラスチンのCmax及びAUC0-24はそれぞれ約2.6倍及び約2倍に上昇した11)(外国人データ)。
16.7.3 ジルチアゼム
16.7.4 グレープフルーツジュース
健康成人12例に本剤20mgをグレープフルーツジュース240mLで投与したとき、血漿中ビラスチンのCmax及びAUC0-infはそれぞれ約0.6倍及び約0.7倍に低下した。この血漿中ビラスチン濃度の低下はグレープフルーツジュースによるビラスチンの消化管からの吸収阻害に起因すると推察されたが機序は不明である13)(外国人データ)。
注2)経口剤は国内未承認。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<アレルギー性鼻炎>
17.1.1 国内第III相試験
通年性アレルギー性鼻炎患者を対象とした二重盲検比較試験において、本剤20mg(1日1回)、フェキソフェナジン塩酸塩120mg(1回60mg1日2回)又はプラセボを2週間経口投与した。主要評価項目である「総合鼻症状スコア(鼻汁、くしゃみ発作、鼻閉、鼻内そう痒感)の期間平均変化量a」は、本剤20mg1日1回投与によりプラセボに対して有意な減少を示した14)。
| 投与群 | 症例数 | ベースラインb | Day 10〜13 | 変化量a | プラセボとの差c |
| 本剤20mg群 | 249 | 7.48±1.54 | 6.48±2.12 | −1.00±1.83 | −0.35[−0.65〜−0.05] p値:0.023 |
| フェキソフェナジン群 | 247 | 7.38±1.43 | 6.42±1.97 | −0.96±1.87 | −0.34[−0.64〜−0.04] |
| プラセボ群 | 251 | 7.33±1.49 | 6.73±1.87 | −0.60±1.72 | \ |
本剤20mg投与群の副作用発現率は2.0%(5/255例)であった。その内訳は傾眠0.8%(2/255例)、下痢、鼻乾燥及び円形脱毛症が各0.4%(1/255例)であった。
<蕁麻疹>
17.1.2 国内第II/III相試験
国内試験において、慢性蕁麻疹患者を対象とした二重盲検比較試験において、本剤20mg(1日1回)、本剤10mg(1日1回)注)、又はプラセボを2週間経口投与した。主要評価項目である「総合症状スコア(発斑、かゆみ)の期間平均変化量a」は、本剤20mg1日1回投与によりプラセボに対して有意な減少を示した15)。
| 投与群 | 症例数 | ベースラインb | Day 8〜14 | 変化量a | プラセボとの差c |
| 本剤20mg群 | 100 | 4.54±0.89 | 1.52±1.36 | −3.02±1.63 | −1.52[−1.89〜−1.15] p値:<0.001 |
| プラセボ群 | 95 | 4.49±0.95 | 3.02±1.32 | −1.47±1.24 |
本剤20mg投与群の副作用発現率は2.0%(2/101例)であった。その内訳は血中ビリルビン増加及び頭痛が各1.0%(1/101例)であった。
<皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒>
17.1.3 国内第III相試験
皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒患者を対象に実施した非盲検長期投与試験(52週間投与)において、本剤20mg1日1回投与した結果(116例)、かゆみスコアは投与早期からベースラインに比べて減少し、52週まで持続した16)。
副作用発現率は2.5%(5/197例)であった。その内訳は傾眠1.0%(2/197例)、AST増加、γ-GTP増加及び夜間頻尿が各0.5%(1/197例)であった。
17.3 その他
17.3.1 精神運動能に及ぼす影響
17.3.2 心血管系へ及ぼす影響
健康成人(30例)を対象に、本剤20mg、本剤100mg注)、本剤20mg+ケトコナゾール400mg、モキシフロキサシン400mg及びプラセボを二重盲検、クロスオーバーでそれぞれ1日1回4日間反復投与し(モキシフロキサシンのみ3日間)、心室再分極に及ぼす影響を評価した。主要評価項目を「QTcNiaのベースラインからの変化量のプラセボとの差」として評価した結果、本剤20mg及び100mgでは、投与後のいずれの時点でもプラセボに対するQTcNiのベースラインからの変化量の片側95%信頼区間の上限は10msecを上回らなかった19)(外国人データ)。
a:線形補正し個別の被験者データを用いて補正したQT間隔
注)本剤の承認用量は1回20mg、1日1回である。
18. 薬効薬理
18.1 作用機序
本剤はヒスタミンH1受容体拮抗作用及び抗アレルギー作用を示す。
18.2 ヒスタミンH1受容体拮抗作用
18.3 抗アレルギー作用
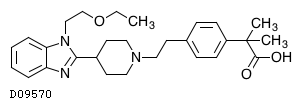
19. 有効成分に関する理化学的知見
19.1. ビラスチン
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
PTP包装
100錠(10錠×10)、420錠(14錠×10×3)、500錠(10錠×10×5)
23. 主要文献
- Mogyorosi K, In vitro interaction studies of bilastine with human MDR1 ABC efflux transporter and with human OATP1A2 uptake transporter(承認年月日:2016年9月28日、CTD2.7.2.2)
- 小室昌仁, 「TAC-202の食事の影響に関する臨床薬理試験」における薬物動態解析(承認年月日:2016年9月28日、CTD2.7.1.2、2.7.6.1)
- 山谷英利, 「健康成人男性を対象としたTAC-202の臨床第I相単回及び反復投与試験」における薬物動態の検討(承認年月日:2016年9月28日、CTD2.7.2.2、2.7.6.5)
- Gonzalo A, Bilastine.Plasma protein binding(承認年月日:2016年9月28日、CTD2.6.4.4)
- Farre M,et al., Br J Clin Pharmacol., 78 (5), 970-980, (2014) »PubMed
- Mair S J, A phase I study to investigate the absorption,metabolism and excretion of[14C]-bilastine following oral administration to healthy volunteers(承認年月日:2016年9月28日、CTD2.7.2.2、2.7.6.7)
- Mumford R, Investigation of the nature and identity of radiolabelled metabolites present in samples of urine,faeces and plasma following an oral dose of[14C]-bilastine to human volunteers(承認年月日:2016年9月28日、CTD2.7.2.2)
- Lasseter K C, Evaluation of the single-dose pharmacokinetics of bilastine in subjects with various degrees of renal insufficiency(承認年月日:2016年9月28日、CTD2.7.2.2、2.7.6.11)
- McLaverty D, An open-label study to assess the effects of age and gender on the pharmacokinetic profile and pharmacodynamics of bilastine in healthy volunteers(承認年月日:2016年9月28日、CTD2.7.2.2、2.7.6.10)
- McLaverty D, A pharmacokinetic and safety study evaluating the potential interaction of erythromycin and bilastine under steady-state conditions in healthy volunteers(承認年月日:2016年9月28日、CTD2.7.2.2、2.7.6.12)
- McLaverty D, A pharmacokinetic and safety study evaluating the potential interaction of ketoconazole and bilastine under steady-state conditions in healthy volunteers(承認年月日:2016年9月28日、CTD2.7.2.2、2.7.6.13)
- McLaverty D, A phase 1,open-label,randomised,two-way crossover study to evaluate the effect of diltiazem on the single-dose pharmacokinetics of bilastine in healthy adult subjects(承認年月日:2016年9月28日、CTD2.7.2.2、2.7.6.14)
- McLaverty D, A phase 1,open-label,randomised,two-way crossover study to evaluate the effect of grapefruit juice on the single-dose pharmacokinetics of bilastine in healthy adult subjects(承認年月日:2016年9月28日、CTD2.7.2.2、2.7.6.15)
- 通年性アレルギー性鼻炎患者を対象としたTAC-202の臨床第III相試験(承認年月日:2016年9月28日、CTD2.7.6.24)
- 慢性蕁麻疹患者を対象としたTAC-202の臨床第II/III相試験(承認年月日:2016年9月28日、CTD2.7.6.33)
- 慢性蕁麻疹及び皮膚疾患に伴うそう痒患者を対象としたTAC-202の臨床第III相長期投与試験(承認年月日:2016年9月28日、CTD2.7.6.37)
- Conen S,et al., J Psychopharmacol., 25 (11), 1517-1523, (2011) »PubMed
- Garcia-Gea C,et al., J Clin Psychopharmacol., 28 (6), 675-685, (2008) »PubMed
- Tyl B,et al., J Clin Pharmacol., 52 (6), 893-903, (2012) »PubMed
- Corcostegui R,et al., Drugs R D., 6 (6), 371-384, (2005) »PubMed
- Corcostegui R,et al., Drugs R D., 7 (4), 219-231, (2006) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
製品情報問い合わせ先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
26. 製造販売業者等
26.1 製造販売元
大鵬薬品工業株式会社
東京都千代田区神田錦町1-27
26.2 提携先
FAES FARMA
スペイン