医薬品情報
| 総称名 | ゲンタマイシン硫酸塩 |
|---|---|
| 一般名 | ゲンタマイシン硫酸塩 |
| 欧文一般名 | Gentamicin Sulfate |
| 薬効分類名 | アミノグリコシド系抗生物質製剤 |
| 薬効分類番号 | 6134 |
| ATCコード | D06AX07 J01GB03 S01AA11 S02AA14 S03AA06 |
| KEGG DRUG |
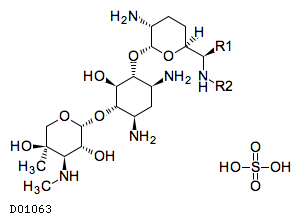
D01063
ゲンタマイシン硫酸塩
|
| KEGG DGROUP |
DG01447
アミノグリコシド系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年10月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ゲンタマイシン硫酸塩注射液10mg「F」 | 富士製薬工業 | 6134407A1067 | 109円/管 | 劇薬, 処方箋医薬品注) | |
| ゲンタマイシン硫酸塩注射液40mg「F」 | 富士製薬工業 | 6134407A2110 | 280円/管 | 劇薬, 処方箋医薬品注) | |
| ゲンタマイシン硫酸塩注射液60mg「F」 | 富士製薬工業 | 6134407A3108 | 295円/管 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分並びに他のアミノグリコシド系抗生物質及びバシトラシンに対し過敏症の既往歴のある患者
4. 効能または効果
<適応菌種>
<適応症>
敗血症、外傷・熱傷及び手術創等の二次感染、肺炎、膀胱炎、腎盂腎炎、腹膜炎、中耳炎
5. 効能または効果に関連する注意
<中耳炎>
「抗微生物薬適正使用の手引き」1)を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
6. 用法及び用量
通常、成人ではゲンタマイシン硫酸塩として1日3mg(力価)/kgを3回に分割して筋肉内注射または点滴静注する。増量する場合は、1日5mg(力価)/kgを限度とし、3〜4回に分割して投与する。
小児では、1回2.0〜2.5mg(力価)/kgを1日2〜3回筋肉内注射または点滴静注する。
点滴静注においては30分〜2時間かけて注入する。
なお、年齢、症状により適宜減量する。
7. 用法及び用量に関連する注意
7.1 腎機能障害患者では、血中濃度の半減期が延長し、高い血中濃度が長時間持続して、第8脳神経障害又は腎障害があらわれるおそれがあるので、腎機能障害度に応じて、次のような方法により投与量及び投与間隔を調節すること。[8.3、8.5、9.2参照]
7.1.1 投与間隔を調節する方法
通常量を「血清クレアチニン値(mg/dL)×8」時間毎に投与する。
7.1.2 1回投与量を調節する方法
初回は通常量を投与し、以降の維持量は通常量を血清クレアチニン値(mg/dL)で除した用量を8時間毎に投与する。
7.2 成人に1日最大5mg(力価)/kgまで増量した場合、副作用の発現を防ぐため、臨床的改善が認められた場合は、速やかに減量すること。
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
8.2 本剤によるショック、アナフィラキシーの発生を確実に予知できる方法がないので、次の措置をとること。[11.1.1参照]
8.2.1 事前に既往歴等について十分な問診を行うこと。なお、抗生物質等によるアレルギー歴は必ず確認すること。
8.2.2 投与に際しては、必ずショック等に対する救急処置のとれる準備をしておくこと。
8.2.3 投与開始から投与終了後まで、患者を安静の状態に保たせ、十分な観察を行うこと。特に、投与開始直後は注意深く観察すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 本人又はその血族がアミノグリコシド系抗生物質による難聴又はその他の難聴のある患者
9.1.2 重症筋無力症の患者
神経筋遮断作用がある。
9.1.3 経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者
観察を十分に行うこと。ビタミンK欠乏症状があらわれることがある。
9.2 腎機能障害患者
9.3 肝機能障害患者
肝障害を悪化させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。新生児に第8脳神経障害があらわれるおそれがある。また、動物実験(モルモット)で新生仔に外有毛細胞の消失がみられたとの報告がある。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。母乳中へ移行することが報告されている。[16.3.1参照]
9.7 小児等
9.7.1 小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
<低出生体重児、新生児>
9.7.2 やむを得ず投与する場合には投与間隔を延長するなど慎重に投与すること。低出生体重児や新生児では腎の発達が未熟であるため、高い血中濃度が長時間持続するおそれがある。また、本剤は添加剤としてベンジルアルコールを含有しており、外国において、低出生体重児へのベンジルアルコールの静脈内大量投与(一日平均投与量99〜234mg/kg)によりGasping症候群が発現したとの報告がある。[8.5参照]
9.8 高齢者
10. 相互作用
10.2 併用注意
| 腎障害を起こすおそれのある血液代用剤 デキストラン、ヒドロキシエチルデンプン 等 | 腎障害が発現、悪化することがあるので、併用は避けることが望ましい。 腎障害が発生した場合には、投与を中止し、透析療法等適切な処置を行うこと。 | 機序は明確ではないが、併用によりアミノグリコシド系抗生物質の血中濃度の上昇、近位尿細管上皮の空胞変性が生じるという報告がある。 |
| ループ利尿剤 エタクリン酸、アゾセミド、フロセミド 等 | 腎障害及び聴器障害が発現、悪化するおそれがあるので、併用は避けることが望ましい。 | 機序は明確ではないが、併用によりアミノグリコシド系抗生物質の血中濃度の上昇、腎への蓄積が起こるという報告がある。 |
| 腎毒性及び聴器毒性を有する薬剤 バンコマイシン塩酸塩、エンビオマイシン硫酸塩、白金含有抗悪性腫瘍剤(シスプラチン、カルボプラチン、ネダプラチン) 等 | 腎障害及び聴器障害が発現、悪化するおそれがあるので、併用は避けることが望ましい。 | 両薬剤ともに腎毒性、聴器毒性を有するが相互作用の機序は不明。 |
| 麻酔剤、筋弛緩剤 ツボクラリン塩化物塩酸塩水和物、パンクロニウム臭化物、ベクロニウム臭化物、トルペリゾン塩酸塩、ボツリヌス毒素 等 筋弛緩作用を有する薬剤 コリスチンメタンスルホン酸ナトリウム 等 | 呼吸抑制があらわれるおそれがある。 呼吸抑制があらわれた場合には、必要に応じ、コリンエステラーゼ阻害剤、カルシウム製剤の投与等の適切な処置を行うこと。 | 両薬剤ともに神経筋遮断作用を有しており、併用によりその作用が増強される。 |
| 腎毒性を有する薬剤 シクロスポリン、タクロリムス水和物、アムホテリシンB、ホスカルネットナトリウム水和物、コリスチンメタンスルホン酸ナトリウム 等 | 腎障害が発現、悪化するおそれがある。 | 両薬剤ともに腎毒性を有するが、相互作用の機序は不明。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)
チアノーゼ、呼吸困難、胸内苦悶、心悸亢進、血圧低下等があらわれた場合には投与を中止し、適切な処置を行うこと。[8.2参照]
11.1.2 急性腎障害(0.1%未満)
急性腎障害等の重篤な腎障害があらわれることがある。[8.4参照]
11.1.3 第8脳神経障害(0.1%未満)
11.2 その他の副作用
| 0.1〜5%未満注1) | 0.1%未満注1) | 頻度不明 | |
| 過敏症 | 発疹、発熱 | そう痒 | |
| 腎臓 | 腎機能障害(BUN・クレアチニン上昇、尿所見異常、乏尿等) | 血尿、カリウム等電解質の異常 | 浮腫 |
| 肝臓 | 肝機能障害(AST・ALT・Al-Pの上昇等) | ビリルビン上昇 | |
| 神経 | 頭痛 | 四肢のしびれ感、幻覚、妄想、痙攣、意識障害 | |
| 血液 | 好酸球増多 | 貧血、白血球減少、血小板減少 | |
| 消化器 | 悪心 | 嘔吐、食欲不振 | |
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等) | ||
| 注射部位注2) | 疼痛、硬結 |
13. 過量投与
13.1 症状
腎障害、聴覚障害、前庭障害、神経筋遮断症状、呼吸麻痺があらわれることがある。[8.3参照]
13.2 処置
血液透析等による薬剤の除去を行う。神経筋遮断症状、呼吸麻痺に対してはコリンエステラーゼ阻害剤、カルシウム製剤の投与又は機械的呼吸補助を行う。
14. 適用上の注意
14.1 薬剤調製時の注意
ヘパリンナトリウムと混合すると、本剤の活性低下を来すので、それぞれ別経路で投与すること。
14.2 薬剤投与時の注意
<点滴静注>
14.2.1 急速に投与しないこと。
<筋肉内注射>
14.2.2 組織・神経等への影響を避けるため以下の点に注意すること。
・同一部位への反復注射はなるべく行わないこと。また、低出生体重児、新生児、乳児、幼児、小児には特に注意すること。
・神経走行部位を避けるよう注意すること。なお、注射針を刺入したとき、神経にあたったと思われるような激痛を訴えた場合は、直ちに針を抜き、部位を変えて注射すること。
・注射器の内筒を軽くひき、血液の逆流がないことを確かめて注射すること。
・硬結を来すことがあるので、注射直後は局所を十分にもむこと。
15. その他の注意
15.1 臨床使用に基づく情報
クエン酸で抗凝固処理した血液を大量輸血された患者にアミノグリコシド系抗生物質を投与すると、投与経路にかかわらず、神経筋遮断症状、呼吸麻痺があらわれることがある。
16. 薬物動態
16.1 血中濃度
16.1.1 腎機能に異常のない成人感染症患者に、ゲンタマイシン硫酸塩注射液60mg(力価)を筋肉内注射又は30分、1時間及び2時間点滴静注したときの血清中濃度及び薬物動態パラメータは下表に示したとおりであった。筋肉内注射6時間後に平均1.09μg/mL、点滴静注開始6〜8時間後には平均0.68〜1.45μg/mLに低下した2)。
| 投与法 | 例数 | Tmax(hr) | Cmax(μg/mL) | t1/2(hr) | AUC (μg・hr/mL) |
| 筋肉内注射 | 4 | 0.54 | 5.09 | 2.49 | 20.69 |
| 点滴静注 (30min) | 3 | 0.5※ | 6.66 | 3.27 | 27.09 |
| 点滴静注 (1hr) | 5 | 1.0※ | 5.79 | 3.14 | 19.66 |
| 点滴静注 (2hr) | 5 | 2.0※ | 5.17 | 4.33 | 22.05 |
16.1.2 生物学的同等性試験
(1)ゲンタマイシン硫酸塩注射液10mg「F」
ゲンタマイシン硫酸塩注射液10mg「F」とゲンタシン注10を、クロスオーバー法によりそれぞれ1mL(ゲンタマイシン硫酸塩として10mg(力価))健康成人男子に筋肉内投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された3)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→inf(μg・hr/mL) | Cmax (μg/mL) | Tmax (hr) | T1/2 (hr) | |
| ゲンタマイシン硫酸塩注射液10mg「F」 | 1.89±0.34 | 0.67±0.15 | 0.58±0.19 | 2.06±0.27 |
| ゲンタシン注10 | 1.90±0.34 | 0.66±0.10 | 0.65±0.17 | 2.00±0.34 |
(2)ゲンタマイシン硫酸塩注射液40mg「F」及びゲンタマイシン硫酸塩注射液60mg「F」
ゲンタマイシン硫酸塩注射液60mg「F」とゲンタシン注60を、クロスオーバー法によりそれぞれ1.5mL(ゲンタマイシン硫酸塩として60mg(力価))健康成人男子に筋肉内投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された3)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→inf(μg・hr/mL) | Cmax (μg/mL) | Tmax (hr) | T1/2 (hr) | |
| ゲンタマイシン硫酸塩注射液60mg「F」 | 10.22±1.88 | 2.88±0.53 | 0.52±0.07 | 2.32±0.59 |
| ゲンタシン注60 | 9.54±1.97 | 2.88±0.55 | 0.46±0.10 | 2.24±0.45 |
16.3 分布
16.3.1 体液・組織内移行
(1)脳脊髄液中濃度
頭部外傷患者にゲンタマイシン硫酸塩注射液80mg(力価)を筋肉内注射したとき、投与1時間後に1.15〜1.50μg/mLの最高脳脊髄液中濃度を示した4)。
(2)胆汁中濃度
(3)母乳中濃度
(注)本剤の承認された成人投与量は、1日3mg(力価)/kgを3分割[増量する場合は、1日5mg(力価)/kgを限度とし3〜4分割]である。
16.3.2 血清蛋白結合
ヒト血清蛋白結合率は10μg/mLの濃度で3.4%であった7)(in vitro)。
16.4 代謝
ラット及びイヌの尿中に抗菌活性をもつ代謝産物は認められなかった7)。
16.5 排泄
ゲンタマイシン硫酸塩注射液の主排泄経路は尿中排泄であった。健康成人にゲンタマイシン硫酸塩注射液1mg(力価)/kgを筋肉内注射及び点滴静注(1時間及び2時間)したとき、投与開始6時間後までに点滴静注(1時間)で83.0%、点滴静注(2時間)で85.7%、筋肉内注射で96.5%が尿中に排泄された8)。
16.6 特定の背景を有する患者
16.6.1 乳児、幼児、小児にゲンタマイシン硫酸塩注射液2.0又は2.5mg(力価)/kgを30分又は1時間点滴静注したときの血清中濃度及び薬物動態パラメータは下表に示したとおりであった。いずれの年齢区分においても、Cmaxの平均値は5〜10μg/mLに達し、投与終了6時間後には2μg/mL未満に低下した9)10)。
| 点滴時間 (min) | 用量 | 年齢区分 | 薬物動態パラメータ | |
| Cmax (μg/mL) | t1/2 (hr) | |||
| 30 | 2.5mg(力価)/kg | 乳児 | 7.63(4) | 1.84(2) |
| 30 | 2.5mg(力価)/kg | 幼児 | 9.94(4) | 1.46(4) |
| 30 | 2.5mg(力価)/kg | 小児 | 9.84(4) | 1.85(4) |
| 60 | 2.0mg(力価)/kg | 乳児 | 5.28(3) | 1.98(3) |
| 60 | 2.0mg(力価)/kg | 幼児 | 5.33(2) | 1.39(2) |
| 60 | 2.0mg(力価)/kg | 小児 | 7.31(2) | 1.35(2) |
| 60 | 2.5mg(力価)/kg | 幼児 | 7.56(3) | 1.68(2) |
| 60 | 2.5mg(力価)/kg | 小児 | 8.58(2) | 1.31(1) |
16.8 その他
16.8.1 血中濃度モニタリング
アミノグリコシド系抗生物質による副作用発現の危険性は、最高血中濃度(筋肉内注射後15〜60分又は点滴静注終了時)あるいは最低血中濃度(次回投与直前値)が異常に高い場合に大きくなるといわれている。ゲンタマイシン硫酸塩注射液の場合は、最高血中濃度が12μg/mL以上、最低血中濃度が2μg/mL以上が繰り返されると、腎障害や第8脳神経障害発生の危険性が大きくなるといわれている11)。
腎機能障害患者、低出生体重児、新生児、高齢者、長期間投与患者及び大量投与患者等では血中濃度が高くなりやすいので、特に最高血中濃度と最低血中濃度を測定し、投与量や投与間隔を調整することが望ましい11)。
例えば、異常に高い最高血中濃度が繰り返されている場合は投与量を減量し、異常に高い最低血中濃度が繰り返されている場合は投与間隔を延長するなど投与方法の調整を行う。
腎機能障害患者、低出生体重児、新生児、高齢者、長期間投与患者及び大量投与患者等では血中濃度が高くなりやすいので、特に最高血中濃度と最低血中濃度を測定し、投与量や投与間隔を調整することが望ましい11)。
例えば、異常に高い最高血中濃度が繰り返されている場合は投与量を減量し、異常に高い最低血中濃度が繰り返されている場合は投与間隔を延長するなど投与方法の調整を行う。
18. 薬効薬理
19. 有効成分に関する理化学的知見
19.1. ゲンタマイシン硫酸塩
22. 包装
<ゲンタマイシン硫酸塩注射液10mg「F」>
1mL×10アンプル
<ゲンタマイシン硫酸塩注射液40mg「F」>
1mL×10アンプル
<ゲンタマイシン硫酸塩注射液60mg「F」>
1.5mL×10アンプル
23. 主要文献
- 厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
- 白松幸爾他, Jpn. J. Antibiot., 36 (2), 293-298, (1983) »PubMed
- 社内資料:生物学的同等性試験
- 石山俊次他, Chemotherapy, 15 (4), 361-369, (1967) »DOI
- 上田泰他, Chemotherapy, 15 (4), 275-281, (1967) »DOI
- 伊藤達也, Jpn. J. Antibiot., 23 (3), 298-311, (1970) »PubMed
- 池田智恵子他, Jpn. J. Antibiot., 32 (3), 312-324, (1979) »PubMed
- 平野学他, 西日泌尿, 43 (4), 851-858, (1981)
- 佐藤吉壮他, Chemotherapy, 36 (5), 421-427, (1988) »DOI
- 日本人小児及び新生児の患者を対象とした国内臨床試験(ゲンタシン注:2013年9月13日承認、審査報告書)
- 血中本薬濃度が高値を示した症例の安全性及び血中濃度モニタリングの必要性について(ゲンタシン注:2013年9月13日承認、審査報告書)
- 第十八改正日本薬局方解説書, C-1951-1956, (2021), (廣川書店)
- 出口浩一他, Jpn. J. Antibiot., 43 (10), 1674-1684, (1990) »PubMed
- Hahn, F. E., et al., J. Infect. Dis., 119 (4), 364-369, (1969) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
富士製薬工業株式会社
くすり相談室
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
製品情報問い合わせ先
富士製薬工業株式会社
くすり相談室
〒939-3515
富山県富山市水橋辻ヶ堂1515番地
電話:0120-956-792
FAX:076-478-0336
26. 製造販売業者等
26.1 製造販売元
富士製薬工業株式会社
富山県富山市水橋辻ヶ堂1515番地