医薬品情報
| 総称名 | エスワンタイホウ |
|---|---|
| 一般名 | テガフール ギメラシル オテラシルカリウム |
| 欧文一般名 | Tegafur Gimeracil Oteracil Potassium |
| 製剤名 | テガフール・ギメラシル・オテラシルカリウム配合 有核型口腔内崩壊錠 |
| 薬効分類名 | 代謝拮抗剤 |
| 薬効分類番号 | 4229 |
| ATCコード | L01BC53 |
| KEGG DRUG |
D06399
テガフール・ギメラシル・オテラシルカリウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年1月 改訂(第5版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エスワンタイホウ配合OD錠T20 (後発品) | S-1TAIHO combination OD tablets | 岡山大鵬薬品 | 4229101F1050 | 119.3円/錠 | 劇薬, 処方箋医薬品 |
| エスワンタイホウ配合OD錠T25 (後発品) | S-1TAIHO combination OD tablets | 岡山大鵬薬品 | 4229101F2057 | 180.8円/錠 | 劇薬, 処方箋医薬品 |
1. 警告
1.1 本剤を含むがん化学療法は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで本療法が適切と判断される症例についてのみ実施すること。適応患者の選択にあたっては、各併用薬剤の電子添文を参照して十分注意すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
1.2 本剤は従来の経口フルオロウラシル系薬剤とは投与制限毒性(Dose Limiting Toxicity、DLT)が骨髄抑制という点で異なり、特に臨床検査値に十分注意する必要がある。頻回に臨床検査を実施すること。[7.2、8.1、8.4、9.1.1、11.1.1参照]
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<頭頸部癌>
5.1 術後補助療法として、本剤の有効性及び安全性は確立していない。
<非小細胞肺癌>
5.2 術前・術後補助療法として、本剤の有効性及び安全性は確立していない。
<ホルモン受容体陽性かつHER2陰性で再発高リスクの乳癌における術後薬物療法>
5.3 術前薬物療法として、本剤の有効性及び安全性は確立していない。
5.4 臨床試験に組み入れられた患者の再発高リスクの定義等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。[17.1.4参照]
6. 用法及び用量
<胃癌、結腸・直腸癌、頭頸部癌、非小細胞肺癌、手術不能又は再発乳癌、膵癌、胆道癌>
胃癌にはA法、B法又はC法、結腸・直腸癌にはA法、C法又はD法、頭頸部癌にはA法、非小細胞肺癌にはA法、B法又はC法、手術不能又は再発乳癌にはA法、膵癌にはA法又はC法、胆道癌にはA法、E法又はF法を使用する。
A法
通常、成人には初回投与量(1回量)を体表面積に合わせて下表の基準量とし、朝食後及び夕食後の1日2回、28日間連日経口投与し、その後14日間休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜増減する。
増量は本剤の投与によると判断される臨床検査値異常(血液検査、肝・腎機能検査)及び消化器症状が発現せず、安全性に問題がなく、増量できると判断される場合に初回基準量から一段階までとし、75mg/回を限度とする。
増量は本剤の投与によると判断される臨床検査値異常(血液検査、肝・腎機能検査)及び消化器症状が発現せず、安全性に問題がなく、増量できると判断される場合に初回基準量から一段階までとし、75mg/回を限度とする。
B法
通常、成人には初回投与量(1回量)を体表面積に合わせて下表の基準量とし、朝食後及び夕食後の1日2回、21日間連日経口投与し、その後14日間休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
C法
通常、成人には初回投与量(1回量)を体表面積に合わせて下表の基準量とし、朝食後及び夕食後の1日2回、14日間連日経口投与し、その後7日間休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
D法
通常、成人には初回投与量(1回量)を体表面積に合わせて下表の基準量とし、朝食後及び夕食後の1日2回、14日間連日経口投与し、その後14日間休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
E法
通常、成人には初回投与量(1回量)を体表面積に合わせて下表の基準量とし、朝食後及び夕食後の1日2回、7日間連日経口投与し、その後7日間休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
| 体表面積 | 初回基準量(テガフール相当量) |
| 1.25m2未満 | 40mg/回 |
| 1.25m2以上1.5m2未満 | 50mg/回 |
| 1.5m2以上 | 60mg/回 |
F法
通常、成人には初回投与量(1回量)を体表面積に合わせて下表の基準量とし、朝食後及び夕食後の1日2回、14日間連日経口投与し、その後7日間休薬する。これを1コースとして投与を繰り返す。なお、患者の状態により適宜減量する。
| 体表面積 | 初回基準量(テガフール相当量) |
| 1.25m2未満 | 朝 40mg/回、夕 20mg/回 |
| 1.25m2以上1.5m2未満 | 40mg/回 |
| 1.5m2以上 | 50mg/回 |
<ホルモン受容体陽性かつHER2陰性で再発高リスクの乳癌における術後薬物療法>
内分泌療法剤との併用において、通常、成人には次の投与量を朝食後及び夕食後の1日2回、14日間連日経口投与し、その後7日間休薬する。これを1コースとして最長1年間、投与を繰り返す。なお、患者の状態により適宜増減する。初回基準量を超える増量は行わないこと。
| 体表面積 | 初回基準量(テガフール相当量) |
| 1.25m2未満 | 40mg/回 |
| 1.25m2以上1.5m2未満 | 50mg/回 |
| 1.5m2以上 | 60mg/回 |
7. 用法及び用量に関連する注意
<効能共通>
7.1 治療上やむを得ず休薬期間を短縮する必要がある場合には、本剤の投与によると判断される臨床検査値異常(血液検査、肝・腎機能検査)及び消化器症状が発現せず、安全性に問題がないことを確認した上で実施すること。ただし、その場合であっても少なくとも7日間の休薬期間を設けること。なお、手術不能又は再発乳癌においては休薬期間の短縮を行った場合の安全性は確立していない(使用経験はない)。
7.2 骨髄抑制、劇症肝炎等の重篤な副作用を回避するため、異常が認められた場合には休薬期間の延長、減量、投与中止等の適切な処置を行うこと。[1.2、1.3、8.1、8.4、9.1.1、11.1.1、11.1.3、17.1.1参照]
7.3 基礎的検討(ラット)において空腹時投与ではオテラシルカリウムのバイオアベイラビリティが変化し、フルオロウラシルのリン酸化が抑制されて抗腫瘍効果の減弱が起こることが予想されるので食後投与とすること。
7.4 本剤と胸部又は腹部放射線療法との併用に関しては有効性及び安全性は確立していない。
<胃癌、結腸・直腸癌、頭頸部癌、非小細胞肺癌、手術不能又は再発乳癌、膵癌、胆道癌>
7.5 本剤の投与スケジュール、周術期治療における投与期間、腎機能に応じた投与量、他の抗悪性腫瘍剤と併用する場合に併用する他の抗悪性腫瘍剤等については、国内外の最新のガイドライン等を参考に選択すること。
7.6 通常、A法において患者の状態に合わせて増減する場合、次の用量を参考とする。
| 減量 | 初回基準量 | 増量 |
| 休薬 | 40mg/回 | 50mg/回 |
| 休薬←40mg/回 | 50mg/回 | 60mg/回 |
| 休薬←40mg/回←50mg/回 | 60mg/回 | 75mg/回 |
なお、増量する場合は1コース毎とし、一段階の増量にとどめること。
<手術不能又は再発乳癌>
7.7 初回化学療法における本剤を含む他の抗悪性腫瘍剤との併用について有効性及び安全性は確立していない。
<ホルモン受容体陽性かつHER2陰性で再発高リスクの乳癌における術後薬物療法>
8. 重要な基本的注意
8.1 骨髄抑制に起因する重篤な感染症(敗血症等)から敗血症性ショックや播種性血管内凝固により死亡に至った症例が報告されているので、感染症・出血傾向の発現又は悪化に十分注意すること。[1.2、7.2、8.4、9.1.1、9.1.2、11.1.1、11.1.2参照]
8.2 本剤の投与により間質性肺炎が発現又は増悪することがあり、死亡に至ることもあるので、投与に際しては間質性肺炎の有無等を確認し、投与中は呼吸状態、咳、発熱の有無等の臨床症状を十分に観察し、胸部X線検査等を行うこと。特に非小細胞肺癌では、間質性肺炎等肺障害が他の癌腫より発現しやすい。[9.1.4、11.1.6参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨髄抑制のある患者(重篤な骨髄抑制のある患者は除く)
9.1.2 感染症を合併している患者
9.1.3 耐糖能異常のある患者
耐糖能異常が悪化するおそれがある。
9.1.4 間質性肺炎又はその既往歴のある患者
9.1.5 心疾患又はその既往歴のある患者
症状が悪化するおそれがある。[11.1.7参照]
9.1.6 消化管潰瘍又は出血のある患者
症状が悪化するおそれがある。[11.1.8参照]
9.1.7 B型肝炎ウイルスキャリアの患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
9.2.2 腎障害のある患者(重篤な腎障害のある患者は除く)
9.3 肝機能障害患者
9.4 生殖能を有する者
9.4.1 小児及び生殖可能な年齢の患者に投与する必要がある場合には性腺に対する影響を考慮すること。
9.4.3 男性には、本剤投与中及び最終投与後3カ月間においてバリア法(コンドーム)を用いて避妊する必要性について説明すること。[15.2.3参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。テガフール・ウラシルを投与された女性において奇形を有する児を出産したとの報告がある。また、動物実験で催奇形作用の報告(妊娠ラット及びウサギ(テガフール相当量7mg/kg、1.5mg/kg)の連日経口投与で胎児の内臓異常、骨格異常、化骨遅延等が認められている)がある。[2.7、9.4.2参照]
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で乳汁中へ移行したとの報告がある。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
10.1 併用禁忌
| フッ化ピリミジン系抗悪性腫瘍剤 フルオロウラシル (5-FU等) テガフール・ウラシル配合剤 (ユーエフティ等) テガフール (フトラフール等) ドキシフルリジン (フルツロン) カペシタビン (ゼローダ) [1.4、2.5、16.7参照] | 併用により早期に重篤な血液障害や下痢、口内炎等の消化管障害等が発現するおそれがある。なお、本剤投与中止後においても少なくとも7日間はこれらの薬剤(療法)を投与しないこと。また、これらの薬剤の投与中止後に本剤を投与する場合にはこれらの薬剤の影響を考慮し、適切な間隔をあけてから本剤の投与を開始すること。 | 本剤中のギメラシルにより、併用されたフルオロウラシルあるいは併用されたこれらフッ化ピリミジンから生成されたフルオロウラシルの異化代謝が阻害され、著しく血中フルオロウラシル濃度が上昇する。 |
| ホリナート・テガフール・ウラシル療法 (ユーゼル・ユーエフティ等) レボホリナート・フルオロウラシル療法 (アイソボリン・5-FU等) [1.4、2.5、16.7参照] | 併用により早期に重篤な血液障害や下痢、口内炎等の消化管障害等が発現するおそれがある。なお、本剤投与中止後においても少なくとも7日間はこれらの薬剤(療法)を投与しないこと。また、これらの薬剤の投与中止後に本剤を投与する場合にはこれらの薬剤の影響を考慮し、適切な間隔をあけてから本剤の投与を開始すること。 | 本剤中のギメラシルにより、併用されたフルオロウラシルあるいは併用されたこれらフッ化ピリミジンから生成されたフルオロウラシルの異化代謝が阻害され、著しく血中フルオロウラシル濃度が上昇する。 |
| フッ化ピリミジン系抗真菌剤 フルシトシン (アンコチル) [1.4、2.6、16.7参照] | 併用により早期に重篤な血液障害や下痢、口内炎等の消化管障害等が発現するおそれがある。なお、本剤投与中止後においても少なくとも7日間はこれらの薬剤(療法)を投与しないこと。また、これらの薬剤の投与中止後に本剤を投与する場合にはこれらの薬剤の影響を考慮し、適切な間隔をあけてから本剤の投与を開始すること。 | 本剤中のギメラシルにより、併用されたフルオロウラシルあるいは併用されたこれらフッ化ピリミジンから生成されたフルオロウラシルの異化代謝が阻害され、著しく血中フルオロウラシル濃度が上昇する。 |
10.2 併用注意
| フェニトイン | フェニトイン中毒(嘔気・嘔吐、眼振、運動障害等)が発現することがあるので、患者の状態を十分に観察すること。異常が認められた場合には本剤の投与を中止するなど適切な処置を行うこと。 | テガフールによってフェニトインの代謝が抑制され、フェニトインの血中濃度が上昇する。 |
| ワルファリンカリウム | ワルファリンカリウムの作用を増強することがあるので、凝固能の変動に注意すること。 | 機序は不明である。 |
| トリフルリジン・チピラシル塩酸塩配合剤 | 重篤な骨髄抑制等の副作用が発現するおそれがある。 | 本剤との併用により、トリフルリジンのDNA取り込みが増加する可能性がある。チピラシル塩酸塩がチミジンホスホリラーゼを阻害することにより、本剤の代謝に影響を及ぼす可能性がある。 |
| 他の抗悪性腫瘍剤、放射線照射等 | 血液障害、消化管障害等の副作用が増強することがあるので、患者の状態を十分に観察すること。異常が認められた場合には減量、休薬等の適切な処置を行うこと。 | 副作用が相互に増強される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄抑制、溶血性貧血
11.1.2 播種性血管内凝固症候群(DIC)(0.4%)
血小板数、血清FDP値、血漿フィブリノゲン濃度等の血液検査に異常が認められた場合には投与を中止し、適切な処置を行うこと。[8.1参照]
11.1.3 劇症肝炎等の重篤な肝障害
11.1.4 脱水症状
激しい下痢があらわれ、脱水症状(頻度不明)まで至ることがあるので、このような症状があらわれた場合には投与を中止し、補液等の適切な処置を行うこと。
11.1.5 重篤な腸炎(0.5%)
出血性腸炎、虚血性腸炎、壊死性腸炎等があらわれることがあるので、激しい腹痛・下痢等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.6 間質性肺炎
11.1.7 心筋梗塞、狭心症、不整脈、心不全
心筋梗塞、狭心症、不整脈(心室頻拍等を含む)、心不全(いずれも頻度不明)があらわれることがあるので、胸痛、失神、動悸、心電図異常、息切れ等が認められた場合には投与を中止し、適切な処置を行うこと。[9.1.5参照]
11.1.8 重篤な口内炎(頻度不明)、消化管潰瘍(0.5%)、消化管出血(0.3%)、消化管穿孔(頻度不明)
異常が認められた場合には投与を中止し、腹部X線等の必要な検査を行い、適切な処置を行うこと。[9.1.6参照]
11.1.9 急性腎障害、ネフローゼ症候群(頻度不明)
11.1.10 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
11.1.11 白質脳症等を含む精神神経障害
白質脳症(意識障害、小脳失調、認知症様症状等を主症状とする)や意識障害、失見当識、傾眠、記憶力低下、錐体外路症状、言語障害、四肢麻痺、歩行障害、尿失禁、知覚障害(いずれも頻度不明)等があらわれることがある。
11.1.12 急性膵炎(頻度不明)
腹痛、血清アミラーゼ値の上昇等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.13 横紋筋融解症
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症(頻度不明)があらわれることがある。また、横紋筋融解症による急性腎障害の発症に注意すること。
11.1.14 嗅覚脱失
嗅覚障害(0.1%)があらわれ、嗅覚脱失(頻度不明)まで至ることがある。
11.1.15 涙道閉塞(頻度不明)
外科的処置に至った例が報告されている。流涙等の症状があらわれた場合には、眼科的検査を実施するなど適切な処置を行うこと。
11.1.16 肝硬変(プロトロンビン時間延長、アルブミン低下、コリンエステラーゼ低下等)(頻度不明)
発現頻度は承認時までの単独投与による臨床試験から算出した。
注1)製造販売後調査において実施した非小細胞肺癌使用成績調査では間質性肺炎は0.7%(11/1669例)、放射線性肺臓炎・呼吸困難・呼吸不全等の肺障害は0.7%(12/1669例)であった。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 血液 | 白血球減少、好中球減少、血小板減少、赤血球減少、ヘモグロビン減少、ヘマトクリット値減少、リンパ球減少 | 出血傾向(皮下出血斑、鼻出血、凝固因子異常)、好酸球増多、白血球増多 | |
| 肝臓 | AST上昇、ALT上昇、ビリルビン上昇、Al-P上昇 | 黄疸、尿ウロビリノーゲン陽性 | |
| 腎臓 | BUN上昇、クレアチニン上昇、蛋白尿、血尿 | ||
| 消化器 | 食欲不振、悪心・嘔吐、下痢、口内炎、味覚異常 | 腸管閉塞、イレウス、腹痛、腹部膨満感、心窩部痛、胃炎、腹鳴、白色便、便秘、口角炎、口唇炎、舌炎、口渇 | |
| 皮膚 | 色素沈着 | 紅斑、落屑、潮紅、水疱、手足症候群注2)、皮膚潰瘍、皮膚炎、脱毛、爪の異常、爪囲炎、単純疱疹、皮膚の乾燥・荒れ | 光線過敏症、DLE様皮疹 |
| 過敏症 | 発疹 | そう痒 | |
| 精神神経系 | 全身倦怠感 | しびれ、頭痛、頭重感、めまい | ふらつき、末梢性ニューロパチー |
| 循環器 | 血圧低下、血圧上昇、心電図異常、レイノー症状 | 動悸 | |
| 眼 | 流涙注3)、結膜炎、角膜炎、角膜びらん、眼痛、視力低下、眼乾燥 | 角膜潰瘍、角膜混濁、輪部幹細胞欠乏 | |
| その他 | LDH上昇、総蛋白減少、アルブミン低下 | 発熱、全身熱感、鼻炎、咽頭炎、痰、糖尿、血糖値上昇、浮腫、筋肉痛、CK上昇、関節痛、電解質異常(血清ナトリウム上昇、血清ナトリウム低下、血清カリウム上昇、血清カリウム低下、血清カルシウム上昇、血清カルシウム低下、血清クロール上昇、血清クロール低下)、体重減少 | 血清アミラーゼ値上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
14.1.3 本剤は寝たままの状態では、水なしで服用させないこと。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤を投与した患者に、急性白血病(前白血病相を伴う場合もある)、骨髄異形成症候群(MDS)が発生したとの報告がある。
15.1.2 フルオロウラシルの異化代謝酵素であるジヒドロピリミジンデヒドロゲナーゼ(DPD)欠損等の患者がごくまれに存在し、このような患者にフルオロウラシル系薬剤を投与した場合、投与初期に重篤な副作用(口内炎、下痢、血液障害、神経障害等)が発現するとの報告がある。
15.1.3 本剤との因果関係は不明であるが、脳梗塞がみられたとの報告がある。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1)ティーエスワン(TS-1)を癌患者12名に32〜40mg/m2で食後経口投与した後の血漿中濃度から求めた、テガフール(FT)、ギメラシル(CDHP)、オテラシルカリウム(Oxo)及び代謝物であるフルオロウラシル(5-FU)、シアヌル酸(CA)の薬物動態パラメータを表に示す1)。
| Cmax(ng/mL) | Tmax(hr) | AUC(0-48hr)(ng・hr/mL) | T1/2(hr) | |
| FT | 1971.0±269.0 | 2.4±1.2 | 28216.9±7771.4 | 13.1±3.1 |
| 5-FU | 128.5±41.5 | 3.5±1.7 | 723.9±272.7 | 1.9±0.4 |
| CDHP | 284.6±116.6 | 2.1±1.2 | 1372.2±573.7 | 3.0±0.5 |
| Oxo | 78.0±58.2 | 2.3±1.1 | 365.7±248.6 | 3.0±1.4 |
| CA | 117.9±184.4 | 3.4±1.0 | 892.0±1711.7 | 3.8±1.6 |
(2)TS-1を癌患者に25〜200mg/body経口投与注1)した後のFT、CDHP、Oxo及び5-FUのAUC、Cmaxはほぼ用量に依存して上昇した2)。
(3)癌患者にTS-1のOD錠(水なし又は水ありで服用)とカプセル(水で服用)を空腹時に、各々40mg(20mg×2)で経口投与した場合、両製剤は生物学的に同等であることが確認された。
| 薬剤・投与法 | 5-FU | |
| Cmax(ng/mL) | AUC(0-48hr)(ng・hr/mL) | |
| OD錠、水あり(I群) | 101.8 | 573.4 |
| OD錠、水なし(II群) | 116.3 | 684.8 |
| カプセル(I群/II群)a | 106.4/112.1 | 594.2/642.4 |
16.1.2 反復投与
TS-1を癌患者10名に32〜40mg/m2で1日2回28日間連日投与した時の1、7、14、28日の血漿中濃度を測定した結果、速やかに定常状態に達した。また、連日投与後においても内因性のウラシル(Ura)の減少は速やかであり、CDHPによるDPD阻害は可逆的で、増強作用を示さなかった1)。
16.3 分布
各配合成分及び5-FUのヒト血清での蛋白結合率はFT 49〜56%、CDHP 32〜33%、Oxo 7〜10%、5-FU 17〜20%であった3)(in vitro)。
16.4 代謝
FTから5-FUへの代謝に関与するヒト肝ミクロゾームのチトクロームP450の分子種としてCYP2A6が主であるとの報告がある4)(in vitro)。
16.5 排泄
TS-1を癌患者12名に32〜40mg/m2で食後単回経口投与した時、尿中には72時間までに投与量に対しCDHP 52.8%、FT 7.8%、Oxo 2.2%、CA 11.4%、5-FU 7.4%が排泄された1)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
(1)薬物動態が詳細に検討された臨床試験症例(臨床薬理試験、膵癌、胆道癌)について、投与前血清クレアチニン値、性別、年齢及び体重からCockcroft-Gault式注2)を用いて算出したクレアチニンクリアランス値(Ccr推定値)に基づき腎機能が正常と判断される患者群と軽度腎機能障害と判断される患者群に分けて、それぞれのAUCを示す5)。[2.3、9.2.2参照]
| (Ccr推定値) | AUC(0-8hr) | |
| >80mL/min | 50-80mL/min | |
| FT | 10060±1842 | 11320±2717 |
| 5-FU | 541.2±174.8 | 812.4±244.9 |
| CDHP | 977.8±327.9 | 1278.0±306.6 |
| Oxo | 155.7±97.5 | 458.2±239.7 |
16.7 薬物相互作用
17. 臨床成績
17.1 有効性及び安全性に関する試験
<効能共通>
17.1.1 国内臨床試験(単独投与)
TS-1(FT 80〜150mg相当量/日)、1日2回分割経口投与による臨床成績を集計した結果、奏効率は胃癌46.5%(60/129例)、結腸・直腸癌32.6%(42/129例)、頭頸部癌34.1%(29/85例)、非小細胞肺癌(未治療例)18.2%(18/99例)、手術不能又は再発乳癌21.8%(12/55例)、膵癌32.2%(19/59例)、胆道癌(乳頭部癌、胆嚢癌及び肝外胆管癌の化学療法未治療例)30.5%(18/59例)であった8)9)10)11)12)13)14)15)16)17)18)19)20)21)。なお、非小細胞肺癌の前期臨床第II相試験における既治療例16例(化学療法は9例、その他は手術あるいは放射線治療)では奏効例は認められなかった。
単独投与による臨床試験(下記の前治療有乳癌症例、膵癌症例及び胆道癌症例を除く)において、副作用評価可能症例は578例であり、副作用発現率は87.2%(504例)であった。また、前治療(タキサン系抗悪性腫瘍剤)を有する手術不能又は再発乳癌(前治療有乳癌と略す)、膵癌及び胆道癌では、副作用発現率がそれぞれ96.4%、98.3%及び94.9%と他の癌腫に比較して高かった。また、膵癌では重度の発現率も高く、特に食欲不振・悪心・嘔吐・下痢等の胃腸障害で顕著であった。
臨床上重要と考えられる副作用は次のとおりであった。(TS-1カプセルの効能追加時)
臨床上重要と考えられる副作用は次のとおりであった。(TS-1カプセルの効能追加時)
| 副作用 | 単独投与時発現率 | |||
| 全体a (578例) | 前治療有乳癌 (55例) | 膵癌 (59例) | 胆道癌 (59例) | |
| 副作用発現率 (グレード3以上)b | 87.2% (22.5%) | 96.4% (30.9%) | 98.3% (42.4%) | 94.9% (30.5%) |
| 白血球減少 (2000/mm3未満) | 45.8% (2.8%) | 69.1% (9.1%) | 32.2% (0%) | 49.2% (3.4%) |
| 好中球減少 (1000/mm3未満) | 43.9% (8.5%) | 72.7% (10.9%) | 27.1% (6.8%) | 42.4% (5.1%) |
| ヘモグロビン減少 (8g/dL未満) | 38.1% (5.7%) | 45.5% (3.6%) | 50.8% (5.1%) | 50.8% (6.8%) |
| 血小板減少 (5×104/mm3未満) | 10.9% (1.6%) | 38.2% (1.8%) | 33.9% (1.7%) | 23.7% (0%) |
| AST上昇 | 11.1% | 34.5% | 18.6% | 37.3% |
| ALT上昇 | 11.1% | 29.1% | 16.9% | 27.1% |
| 食欲不振 (グレード3以上) | 33.9% (3.5%) | 54.5% (5.5%) | 61.0% (13.6%) | 33.9% (6.8%) |
| 悪心 (グレード3以上) | 22.3% (0%) | 47.3% (0%) | 55.9% (10.2%) | 32.2% (3.4%) |
| 嘔吐 (グレード3以上) | 7.8% (0.5%) | 30.9% (0%) | 35.6% (5.1%) | 20.3% (1.7%) |
| 下痢 (グレード3以上) | 18.7% (2.9%) | 38.2% (5.5%) | 37.3% (6.8%) | 22.0% (1.7%) |
| 全身倦怠感c | 22.3% | 47.3% | 47.5% | 35.6% |
| 口内炎 | 17.1% | 41.8% | 25.4% | 27.1% |
| 色素沈着 | 21.3% | 47.3% | 39.0% | 42.4% |
| 発疹 | 11.8% | 16.4% | 22.0% | 22.0% |
本剤の投与において重要と考えられた副作用について、胃癌、結腸・直腸癌、頭頸部癌、非小細胞肺癌(単独投与)、手術不能又は再発乳癌、膵癌及び胆道癌の後期臨床第II相試験の453例を対象として副作用の発現時期に関する解析を行った結果、次のごとくであった。[7.2参照]
白血球数3000/mm3未満、ヘモグロビン8g/dL未満又は血小板数7.5×104/mm3未満の基準に至った中で最も低下した臨床検査異常値において、当該コース開始から最低値に至るまでの期間を検討した結果、それぞれの中央値は27日、25日、24日であった。
一方、そのうち上記基準以上へ回復したことを確認できた症例の最低値から回復までの期間を検討した結果、それぞれの中央値は7日、5.5日、6日であった。
一方、そのうち上記基準以上へ回復したことを確認できた症例の最低値から回復までの期間を検討した結果、それぞれの中央値は7日、5.5日、6日であった。
| 臨床検査項目 | 発現例数 | 最低値までの期間:中央値(範囲) | 回復確認例数 | 回復までの期間:中央値(範囲) |
| 白血球減少 | 92例 | 27日(4〜43日) | 85例 | 7日(1〜93日) |
| ヘモグロビン減少 | 29例 | 25日(5〜43日) | 24例 | 5.5日(1〜21日) |
| 血小板減少 | 28例 | 24日(9〜51日) | 25例 | 6日(1〜46日) |
また、臨床所見において薬剤との関連性を重視し、副作用と判定された下痢、発疹、口内炎で初回投与開始から初発までの期間を検討した結果、それぞれの中央値は24.5日、21日、28日であった。
一方、各症状の最高グレードから消失までの期間を検討した結果、それぞれの中央値は9日、14日、13.5日であった。
一方、各症状の最高グレードから消失までの期間を検討した結果、それぞれの中央値は9日、14日、13.5日であった。
| 臨床所見 | 発現例数 | 初発までの期間:中央値(範囲) | 回復確認例数 | 消失までの期間:中央値(範囲) |
| 下痢 | 100例 | 24.5日(2〜189日) | 95例 | 9日(1〜62日) |
| 発疹 | 67例 | 21日(2〜248日) | 63例 | 14日(2〜254日) |
| 口内炎 | 100例 | 28日(3〜262日) | 94例 | 13.5日(2〜99日) |
<非小細胞肺癌>
17.1.2 国内第II相試験(併用投与)
非小細胞肺癌(未治療例)に対する後期臨床第II相試験として行った併用試験(本剤21日間連日経口投与に、シスプラチン60mg/m2を第8日目に投与)における臨床成績を集計した結果、奏効率は47.3%(26/55例)であった22)。
副作用評価可能症例は55例であり、全例に何らかの副作用が発現した。
臨床上重要と考えられる副作用は次のとおりであった。(TS-1カプセルの効能追加時)
副作用評価可能症例は55例であり、全例に何らかの副作用が発現した。
臨床上重要と考えられる副作用は次のとおりであった。(TS-1カプセルの効能追加時)
| 副作用 | 併用投与時発現率 |
| 非小細胞肺癌(55例) | |
| 副作用発現率(グレード3以上)a | 100.0%(61.8%) |
| 白血球減少(2000/mm3未満) | 52.7%(5.5%) |
| 好中球減少(1000/mm3未満) | 65.5%(29.1%) |
| ヘモグロビン減少(8g/dL未満) | 90.9%(21.8%) |
| 血小板減少(5×104/mm3未満) | 60.0%(1.8%) |
| AST上昇 | 14.5% |
| ALT上昇 | 14.5% |
| 食欲不振(グレード3以上) | 78.2%(12.7%) |
| 悪心(グレード3以上) | 65.5%(10.9%) |
| 嘔吐(グレード3以上) | 38.2%(7.3%) |
| 下痢(グレード3以上) | 34.5%(7.3%) |
| 口内炎 | 25.5% |
| 色素沈着 | 23.6% |
| 発疹 | 9.1% |
<胃癌>
17.1.3 国内第III相試験(術後補助療法)
Stage II、IIIの胃癌治癒切除症例を対象とし、TS-1投与(手術後1年間)群(529例)と手術単独群(530例)を比較検討した結果(観察期間の中央値:手術後3.0年)、生存期間のハザード比は0.675(95%信頼区間:0.523-0.871、ログランク検定p=0.0024)で、TS-1投与群は手術単独群と比較して死亡リスクを32%低下させた。手術後3年の生存率は、手術単独群70.1%、TS-1投与群80.5%であった。また、無再発生存期間のハザード比は0.622(95%信頼区間:0.501-0.772、ログランク検定p<0.0001)で、TS-1投与群は手術単独群と比較して再発リスクを38%低下させた。3年無再発生存率は、手術単独群60.1%、TS-1投与群72.2%であった。
なお、割付後の3年生存率は、手術単独群70.1%、TS-1投与群80.1%であり、3年無再発生存率は手術単独群59.6%、TS-1投与群72.2%であった23)。
なお、割付後の3年生存率は、手術単独群70.1%、TS-1投与群80.1%であり、3年無再発生存率は手術単独群59.6%、TS-1投与群72.2%であった23)。
<ホルモン受容体陽性かつHER2陰性で再発高リスクの乳癌における術後薬物療法>
17.1.4 国内第III相試験(術後薬物療法)
Stage I〜IIIBのエストロゲン受容体陽性かつHER2陰性で再発高リスク注1)の乳癌の術後患者注2)を対象に、TS-1と内分泌療法の併用群(979例)と内分泌療法単独群(980例)の有効性及び安全性を比較する無作為化非盲検比較試験を実施した。用法・用量はクレアチニンクリアランス及び体表面積に応じて、TS-1(FT60〜120mg相当量/日)を1日2回、14日間連日経口投与後7日間休薬し、これを繰り返すこととされた。内分泌療法は、試験責任医師の選択する標準的な内分泌療法剤注3)を投与することとされた。いずれも再発又は投与中止基準に該当するまで、TS-1は最長1年間、内分泌療法は最長5年間継続することとされた。主要評価項目である浸潤性疾患のない生存期間のハザード比は0.61(95%信頼区間:0.47〜0.80、ログランク検定p=0.0002)であった24)。(2018年11月1日データカットオフ)注4)
TS-1と内分泌療法の併用群の安全性解析対象とされた954例において、有害事象発現率は99.0%(944例)であった。主な有害事象は、白血球減少54.4%、色素沈着50.3%、ALT上昇42.9%、好中球減少42.0%、血中ビリルビン増加40.8%、疲労39.1%、AST上昇38.6%、貧血34.9%、悪心34.5%、下痢32.3%、血小板減少32.2%であった。[5.4参照]
TS-1と内分泌療法の併用群の安全性解析対象とされた954例において、有害事象発現率は99.0%(944例)であった。主な有害事象は、白血球減少54.4%、色素沈着50.3%、ALT上昇42.9%、好中球減少42.0%、血中ビリルビン増加40.8%、疲労39.1%、AST上昇38.6%、貧血34.9%、悪心34.5%、下痢32.3%、血小板減少32.2%であった。[5.4参照]
注1)再発高リスクとして、以下の[1]又は[2]の患者と定義された。
[1]腋窩リンパ節転移が陽性の患者(術前又は術後薬物療法を実施している患者では、薬物療法実施前に腋窩リンパ節転移が陽性の患者)。
[2]腋窩リンパ節転移が陰性で下記の1)〜3)のいずれかに該当する患者。
1)術前薬物療法歴がない場合
手術検体において(i)浸潤径3cm以上、(ii)組織学的グレード(HG)3、(iii)明らかな脈管侵襲が認められる、(iv)HG2かつ浸潤径2cm以上3cm未満、(v)HG2、浸潤径2cm未満かつ増殖マーカー高値※、又は(vi)HG1、浸潤径2cm以上3cm未満かつ増殖マーカー高値※。
2)術前化学療法歴がある場合
原発巣又は腋窩リンパ節の手術検体において浸潤癌の残存が認められる。
3)術前内分泌療法歴がある場合
手術検体において(i)浸潤径3cm以上、(ii)HG3、(iii)明らかな脈管侵襲が認められる、(iv)HG2かつ浸潤径2cm以上3cm未満、(v)HG2、浸潤径2cm未満かつ増殖マーカー高値※又は(vi)HG1、浸潤径2cm以上3cm未満かつ増殖マーカー高値※。
※:中央病理判定によるKi-67 labeling index 30%以上、又はKi-67 labeling index 14%以上30%未満の場合はOncotype DXの測定が実施され、recurrence score(RS)18以上の場合に適格とされた。
注2)術後放射線療法が行われている場合には、登録の2週間以上前に終了していることとされ、本剤と放射線療法との同時併用及び本剤投与終了後の放射線療法は行わないこととされた。
注3)以下のいずれかから選択された。なお、術前内分泌療法歴がある場合には、術前と術後内分泌療法の投与期間として合計5年間投与することとされた。
・閉経前の場合
タモキシフェン又はトレミフェン。ゴセレリン又はリュープロレリン2年間との併用も可とされた。
・閉経後の場合
アナストロゾール、レトロゾール又はエキセメスタン。アロマターゼ阻害剤が不適格の場合には、タモキシフェン又はトレミフェンも可とされた。
注4)有効性の解析対象の症例数はTS-1と内分泌療法の併用群で952例、内分泌療法単独群で967例であった。
17.2 製造販売後調査等
17.2.1 腎障害時の副作用
胃癌を対象とした製造販売後調査において、投与前血清クレアチニン値、性別、年齢及び体重からCockcroft-Gault式を用いて算出したクレアチニンクリアランス値(Ccr推定値)別に副作用発現率を集計した結果、Ccr推定値低値症例ほど副作用発現率が高く、かつその程度が重度化していた。また、減量(主に1段階)して投与を開始した症例においては、基準量投与開始例に比し副作用発現率が低下していた。[9.2.2参照]
| Ccr推定値(mL/min) | 基準量投与開始症例 | 減量投与開始症例 | ||
| 副作用発現率 | 高度(Grade3)以上副作用発現率 | 副作用発現率 | 高度(Grade3)以上副作用発現率 | |
| 80≦ | 79.2% (835/1054) | 26.8% (282/1054) | 70.7% (224/317) | 24.3% (77/317) |
| 50≦ <80 | 80.8% (1087/1345) | 32.3% (434/1345) | 71.7% (309/431) | 26.0% (112/431) |
| 30≦ <50 | 87.4% (319/365) | 42.5% (155/365) | 79.9% (123/154) | 33.8% (52/154) |
| <30 | 90.0% (18/20) | 75.0% (15/20) | 82.4% (14/17) | 47.1% (8/17) |
18. 薬効薬理
18.1 作用機序
TS-1はFT、CDHP及びOxoの三成分を含有する製剤であり、経口投与後の抗腫瘍効果は体内でFTから徐々に変換される5-FUに基づいている。
CDHPは主として肝に多く分布する5-FU異化代謝酵素のDPDを選択的に拮抗阻害することによって、FTより派生する5-FU濃度を上昇させる。この生体内5-FU濃度の上昇に伴って、腫瘍内では5-FUのリン酸化代謝物である5-フルオロヌクレオチドが高濃度持続し、抗腫瘍効果が増強する。また、Oxoは経口投与により主として消化管組織に分布してorotate phosphoribosyltransferaseを選択的に拮抗阻害し、5-FUから5-フルオロヌクレオチドへの生成を選択的に抑制する。その結果TS-1投与により5-FUの強い抗腫瘍効果を損なうことなく消化器毒性が軽減されると考えられている。
5-FUの作用機序は主として活性代謝物であるFdUMPがdUMPと拮抗し、thymidylate synthase及び還元葉酸とternary complexを形成することによるDNA生合成阻害による。また、FUTPに変換されてRNA機能を障害するともいわれている25)26)27)28)29)。
CDHPは主として肝に多く分布する5-FU異化代謝酵素のDPDを選択的に拮抗阻害することによって、FTより派生する5-FU濃度を上昇させる。この生体内5-FU濃度の上昇に伴って、腫瘍内では5-FUのリン酸化代謝物である5-フルオロヌクレオチドが高濃度持続し、抗腫瘍効果が増強する。また、Oxoは経口投与により主として消化管組織に分布してorotate phosphoribosyltransferaseを選択的に拮抗阻害し、5-FUから5-フルオロヌクレオチドへの生成を選択的に抑制する。その結果TS-1投与により5-FUの強い抗腫瘍効果を損なうことなく消化器毒性が軽減されると考えられている。
5-FUの作用機序は主として活性代謝物であるFdUMPがdUMPと拮抗し、thymidylate synthase及び還元葉酸とternary complexを形成することによるDNA生合成阻害による。また、FUTPに変換されてRNA機能を障害するともいわれている25)26)27)28)29)。
18.2 抗腫瘍効果
19. 有効成分に関する理化学的知見
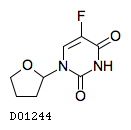
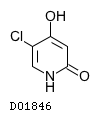
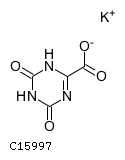
19.1. テガフール
19.2. ギメラシル
19.3. オテラシルカリウム
20. 取扱い上の注意
開封後は湿気を避けて保存すること。
22. 包装
<エスワンタイホウ配合OD錠T20>
PTP包装(乾燥剤入り)
56錠(14錠×2×2)、140錠(14錠×2×5)
<エスワンタイホウ配合OD錠T25>
PTP包装(乾燥剤入り)
56錠(14錠×2×2)、140錠(14錠×2×5)
23. 主要文献
- Hirata,K.et al., Clin.Cancer Res., 5 (8), 2000-2005, (1999) »PubMed
- 田口鐵男 他, 癌と化学療法, 24 (15), 2253-2264, (1997) »PubMed
- 増田啓年 他, 薬物動態, 12 (4), 301-321, (1997) »DOI
- Ikeda,K.et al., Clin.Cancer Res., 6 (11), 4409-4415, (2000) »PubMed
- 池田和正, S-1の正常及び軽度腎機能低下患者での薬物動態パラメータの比較,大鵬薬品工業(株)社内資料,研究報告書No.253
- 池田和正 他, 腎障害モデルにおけるS-1動態変化の検討,大鵬薬品工業(株)社内資料,研究報告書No.138
- 吉末訓弘 他, 新規抗悪性腫瘍薬S-1のソリブジンあるいはその他の5-FU系薬剤との相互作用に関する検討,大鵬薬品工業(株)社内資料,研究報告書No.135
- Sugimachi,K.et al., Oncology., 57 (3), 202-210, (1999) »PubMed
- Sakata,Y.et al., Eur.J.Cancer., 34 (11), 1715-1720, (1998) »PubMed
- Koizumi,W.et al., Oncology., 58 (3), 191-197, (2000) »PubMed
- Ohtsu,A.et al., Br.J.Cancer., 83 (2), 141-145, (2000) »PubMed
- Shirao,K.et al., Cancer., 100 (11), 2355-2361, (2004) »PubMed
- 犬山征夫 他, 癌と化学療法, 25 (8), 1151-1158, (1998) »PubMed
- 犬山征夫 他, 癌と化学療法, 28 (10), 1381-1390, (2001) »PubMed
- Furuse,K.et al., Int.J.Clin.Oncol., 6 (5), 236-241, (2001) »PubMed
- Kawahara,M.et al., Br.J.Cancer., 85 (7), 939-943, (2001) »PubMed
- 転移性乳癌患者を対象としたTaxane系抗悪性腫瘍剤無効例に対するS-1後期臨床第II相試験,大鵬薬品工業(株)社内資料,研究報告書No.235
- Ueno,H.et al., Oncology., 68 (2-3), 171-178, (2005) »PubMed
- Okusaka,T.et al., Cancer Chemother.Pharmacol., 61 (4), 615-621, (2008) »PubMed
- Ueno,H.et al., Br.J.Cancer., 91 (10), 1769-1774, (2004) »PubMed
- Furuse,J.et al., Cancer Chemother.Pharmacol., 62 (5), 849-855, (2008) »PubMed
- Ichinose,Y.et al., Clin.Cancer Res., 10 (23), 7860-7864, (2004) »PubMed
- Sakuramoto,S.et al., N.Engl.J.Med., 357 (18), 1810-1820, (2007) »PubMed
- Toi,M et al., Lancet Oncol., 22 (1), 74-84, (2021) »PubMed
- Shirasaka,T.et al., Anti-Cancer Drugs., 7 (5), 548-557, (1996) »PubMed
- Tatsumi,K.et al., Jpn.J.Cancer Res., 78 (7), 748-755, (1987) »PubMed
- Shirasaka,T.et al., Cancer Res., 53 (17), 4004-4009, (1993) »PubMed
- Spears,C.P.et al., Cancer Res., 44 (9), 4144-4150, (1984) »PubMed
- Wilkinson,D.S.et al., Cancer Res., 35 (11), 3014-3020, (1975)
- Takechi,T.et al., Cancer Chemother.Pharmacol., 39 (3), 205-211, (1997) »PubMed
- Shirasaka,T.et al., Cancer Res., 56 (11), 2602-2606, (1996) »PubMed
- Fukushima,M.et al., Int.J.Oncol., 13, 693-698, (1998) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
岡山大鵬薬品株式会社
お客様相談窓口
〒705-8555
岡山県備前市久々井字沖1775-1
電話:0120-96-9771
FAX:0869-64-1130
製品情報問い合わせ先
岡山大鵬薬品株式会社
お客様相談窓口
〒705-8555
岡山県備前市久々井字沖1775-1
電話:0120-96-9771
FAX:0869-64-1130
26. 製造販売業者等
26.1 製造販売元
岡山大鵬薬品株式会社
岡山県備前市久々井字沖1775-1