医薬品情報
| 総称名 | モンテルカスト |
|---|---|
| 一般名 | モンテルカストナトリウム |
| 欧文一般名 | Montelukast Sodium |
| 薬効分類名 | ロイコトリエン受容体拮抗剤 気管支喘息治療剤 |
| 薬効分類番号 | 4490 |
| ATCコード | R03DC03 |
| KEGG DRUG |
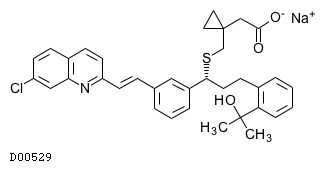
D00529
モンテルカストナトリウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年8月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| モンテルカストチュアブル錠5mg「TCK」 (後発品) | MONTELUKAST Chewable Tablets 「TCK」 | 辰巳化学 | 4490026F1125 | 18.1円/錠 |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、6歳以上の小児にはモンテルカストとして5mgを1日1回就寝前に経口投与する。
7. 用法及び用量に関連する注意
7.1 モンテルカストチュアブル錠はモンテルカストフィルムコーティング錠及びOD錠と生物学的に同等ではないため、モンテルカストチュアブル錠5mgとモンテルカストフィルムコーティング錠5mg及びOD錠5mgをそれぞれ相互に代用しないこと。
7.2 1歳以上6歳未満の小児に対しては、モンテルカスト細粒4mgを1日1回就寝前に投与すること。[9.7.1参照]
8. 重要な基本的注意
8.1 本剤は、喘息の悪化時ばかりでなく、喘息が良好にコントロールされている場合でも継続して服用するよう、患者、保護者又はそれに代わり得る適切な者に十分説明しておくこと。
8.2 本剤は気管支拡張剤、ステロイド剤等と異なり、すでに起こっている喘息発作を緩解する薬剤ではないので、このことは患者、保護者又はそれに代わり得る適切な者に十分説明しておく必要がある。
8.3 本剤を投与中、大発作をみた場合は、気管支拡張剤あるいはステロイド剤を投与する必要がある。
8.4 本剤投与によりステロイド維持量を減量し得た患者で、本剤の投与を中止する場合は、原疾患再発のおそれがあるので注意すること。
8.5 本剤との因果関係は明らかではないが、うつ病、自殺念慮、自殺及び攻撃的行動を含む精神症状が報告されているので、患者の状態を十分に観察すること。[15.1参照]
8.6 本剤を含めロイコトリエン拮抗剤使用時に好酸球性多発血管炎性肉芽腫症様の血管炎を生じたとの報告がある。これらの症状は、おおむね経口ステロイド剤の減量・中止時に生じている。本剤使用時は、特に好酸球数の推移及びしびれ、四肢脱力、発熱、関節痛、肺の浸潤影等の血管炎症状に注意すること。
8.7 本剤投与により効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 長期ステロイド療法を受けている患者
本剤投与によりステロイドの減量をはかる場合は十分な管理下で徐々に行うこと。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。海外の市販後において、妊娠中に本剤を服用した患者から出生した新生児に先天性四肢奇形がみられたとの報告がある。これらの妊婦のほとんどは妊娠中、他の喘息治療薬も服用していた。本剤とこれらの事象の因果関係は明らかにされていない。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が報告されている。
9.7 小児等
10. 相互作用
相互作用序文
本剤は、主として薬物代謝酵素チトクロームP450(CYP)3A4で代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| フェノバルビタール[16.7.1参照] | 本剤の作用が減弱するおそれがある。 | フェノバルビタールがCYP3A4を誘導し、本剤の代謝が促進される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
11.1.2 血管浮腫(頻度不明)
11.1.3 劇症肝炎、肝炎、肝機能障害、黄疸(いずれも頻度不明)
11.1.4 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑(いずれも頻度不明)
11.1.5 血小板減少(頻度不明)
初期症状として、紫斑、鼻出血、歯肉出血等の出血傾向があらわれることがある。
11.2 その他の副作用
| 0.1〜5%未満注) | 頻度不明 | |
| 過敏症 | 皮疹 | そう痒、蕁麻疹、肝臓の好酸球浸潤 |
| 精神神経系 | 頭痛、傾眠 | 異夢、易刺激性、情緒不安、痙攣、不眠、幻覚、めまい、感覚異常(しびれ等)、激越、振戦、夢遊症、失見当識、集中力低下、記憶障害、せん妄、強迫性症状 |
| 呼吸器 | − | 肺好酸球増多症 |
| 消化器系 | 下痢、腹痛、胃不快感、嘔気、胸やけ、嘔吐、便秘 | 消化不良、口内炎 |
| 肝臓 | 肝機能異常、AST上昇、ALT上昇、Al-P上昇、γ-GTP上昇、総ビリルビン上昇 | − |
| 筋骨格系 | − | 筋痙攣を含む筋痛、関節痛 |
| その他 | 口渇、尿潜血、血尿、尿糖、浮腫、倦怠感、白血球数増加、尿蛋白、トリグリセリド上昇 | 出血傾向(鼻出血、紫斑等)、挫傷、動悸、頻尿、発熱、脱力、疲労、脱毛、遺尿 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は、食事の有無にかかわらず投与できる。
14.1.3 本剤は、口中で溶かすか、かみくだいて服用すること。
15. その他の注意
15.1 臨床使用に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人8例にモンテルカストフィルムコーティング錠10mg注)を空腹時に単回経口投与したとき、モンテルカストの血漿中濃度は投与3.9時間後に最高血漿中濃度(Cmax)526ng/mLに達し、消失半減期(t1/2)4.6時間で消失した。また、血漿中濃度−時間曲線下面積(AUC0-∞)は3840ng・hr/mLであった3)。
16.1.2 反復投与
軽症から中等症の小児気管支喘息患者にモンテルカストチュアブル錠5mgを1日1回7日間食後反復経口投与したとき、1日目は投与後3.1時間、7日目は投与後4.3時間にCmax(630ng/mL及び628ng/mL)に達し、t1/2はいずれもおよそ4時間であった(下図)。1日目及び7日目のAUC0-24hrはそれぞれ4170ng・hr/mL及び4910ng・hr/mLであった。血漿中にモンテルカストはほとんど蓄積しないことが示唆された(表1)3)4)。
図 小児患者におけるモンテルカストチュアブル錠5mg反復経口投与時の血漿中濃度推移
| 被験者 | 投与日数 | Tmax (hr) | Cmax (ng/mL) | t1/2† (hr) | AUC0-24hr (ng・hr/mL) | AUC0-∞ (ng・hr/mL) |
| 小児患者 | 1日目 | 3.1±1.6 | 630±234 | 3.99±0.42 | 4170±1000 | 4250±1000 |
| 7日目 | 4.3±1.4 | 628±222 | 4.08±0.55 | 4910±1260 | 5030±1280 | |
| 健康成人 | 1日目 | 5.3±1.0 | 580±136 | 4.68±0.41 | 4470±1120 | 4690±1210 |
| 7日目 | 3.3±1.0 | 660±124 | 5.06±0.32 | 4680±1030 | 4960±1120 |
16.1.3 チュアブル錠とフィルムコーティング錠の薬物動態の比較
健康成人にモンテルカストチュアブル錠10mg注)及びモンテルカストフィルムコーティング錠10mg注)を投与した場合の薬物動態パラメータは下記のとおりである(表2)5)(外国人データ)。
| 用量及び剤形 | Tmax† (hr) | Cmax (ng/mL) | t1/2 (hr) | AUC0-∞ (ng・hr/mL) |
| 10mg CT | 2.0±0.3 | 493.7±83.1 | 4.8±0.3 | 2938.8±583.1 |
| 10mg FCT | 4.0±1.4 | 333.4±109.6 | 4.6±0.6 | 2447.6±779.0 |
16.1.4 生物学的同等性試験
モンテルカストチュアブル錠5mg「TCK」とキプレスチュアブル錠5mgを、クロスオーバー法によりそれぞれ1錠(モンテルカストとして5mg)健康成人男子に絶食下、口中溶解後、単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された6)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→24hr(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| モンテルカストチュアブル錠5mg「TCK」 | 2171.45±876.88 | 328.91±108.92 | 3.00±0.56 | 4.18±0.90 |
| キプレスチュアブル錠5mg | 2160.72±649.17 | 339.62±70.63 | 2.50±1.17 | 4.46±1.06 |
口中溶解後、水なし投与
| 判定パラメータ | 参考パラメータ | |||
| AUC0→24hr(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| モンテルカストチュアブル錠5mg「TCK」 | 2077.73±604.43 | 309.63±72.49 | 2.75±0.84 | 4.69±1.09 |
| キプレスチュアブル錠5mg | 2097.48±469.83 | 326.54±68.79 | 2.55±0.87 | 4.69±1.13 |
口中溶解後、水あり投与
モンテルカストチュアブル錠5mg「TCK」とキプレスチュアブル錠5mgを、クロスオーバー法によりそれぞれ1錠(モンテルカストとして5mg)健康成人男子に絶食下、咀嚼後、単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された6)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→24hr(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| モンテルカストチュアブル錠5mg「TCK」 | 2157.02±689.98 | 323.19±80.22 | 2.65±0.81 | 4.19±1.55 |
| キプレスチュアブル錠5mg | 2149.09±671.26 | 339.86±90.64 | 2.15±0.71 | 4.49±1.63 |
咀嚼後、水なし投与
| 判定パラメータ | 参考パラメータ | |||
| AUC0→24hr(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| モンテルカストチュアブル錠5mg「TCK」 | 2121.58±733.63 | 286.23±62.31 | 2.95±1.04 | 5.18±2.94 |
| キプレスチュアブル錠5mg | 2134.42±598.88 | 308.24±58.13 | 2.80±0.82 | 4.34±1.04 |
咀嚼後、水あり投与
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 食事の影響
健康成人にモンテルカストチュアブル錠5mgを食後投与することにより空腹時に比べて最高血漿中濃度到達時間(Tmax)は2.3±0.9時間から4.0±1.9時間に遅延した。また、Cmaxは488±66ng/mLから256±82ng/mLに48%減少し、AUCは2730±743ng・hr/mLから2386±498ng・hr/mLに13%減少した7)(外国人データ)。
16.2.2 生物学的利用率
健康成人注)にモンテルカストチュアブル錠5mg及びモンテルカストフィルムコーティング錠10mgを投与したときの生物学的利用率はそれぞれ約73%及び約64%であった7)(外国人データ)。
16.3 分布
16.3.1 蛋白結合率
モンテルカストのヒト血漿蛋白との結合率は99.6%であった。モンテルカストは生理的な濃度のアルブミン及びα1-酸性糖蛋白質の両方に99%以上結合した8)(in vitro)。
16.4 代謝
ヒトにおけるモンテルカストの主要代謝物は側鎖メチル基の水酸化体及びベンジル位メチレン基の水酸化体であった。これら代謝物の生成にはそれぞれチトクロームP450(CYP)の分子種であるCYP2C8/2C9及び3A4が関与しており、CYP2C8がモンテルカストの主要代謝酵素であった。[10.参照]
更に側鎖メチル基の水酸化体はカルボン酸体まで酸化的代謝を受けることが確認されている。In vitro試験により治療時の血漿中濃度では、モンテルカストはCYP3A4、2C9、1A2、2A6、2C19又は2D6を阻害しないことが示された9)10)11)12)13)。
また、in vitro試験によりモンテルカストはCYP2C8を阻害することが示されたが、in vivoにおいてはモンテルカストは主にCYP2C8で代謝される代表的な薬剤であるロシグリタゾンとの臨床薬物相互作用試験で、CYP2C8を阻害しないことが示された14)(外国人データ)。したがって、モンテルカストはCYP2C8で代謝される薬剤(パクリタキセル等)の代謝に影響を及ぼさないと考えられる。
更に側鎖メチル基の水酸化体はカルボン酸体まで酸化的代謝を受けることが確認されている。In vitro試験により治療時の血漿中濃度では、モンテルカストはCYP3A4、2C9、1A2、2A6、2C19又は2D6を阻害しないことが示された9)10)11)12)13)。
また、in vitro試験によりモンテルカストはCYP2C8を阻害することが示されたが、in vivoにおいてはモンテルカストは主にCYP2C8で代謝される代表的な薬剤であるロシグリタゾンとの臨床薬物相互作用試験で、CYP2C8を阻害しないことが示された14)(外国人データ)。したがって、モンテルカストはCYP2C8で代謝される薬剤(パクリタキセル等)の代謝に影響を及ぼさないと考えられる。
16.5 排泄
16.5.1 健康成人にモンテルカストカプセル剤400mg注)を単回経口投与したとき尿中に未変化体は検出されなかった3)。
16.5.2 健康成人に14C標識モンテルカストカプセル剤102mg注)を単回経口投与した後5日間の糞中及び尿中放射能排泄率はそれぞれ約86%及び0.1%であった15)(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
16.6.2 高齢者
16.7 薬物相互作用
16.7.1 フェノバルビタール
16.7.2 テオフィリン
健康成人にモンテルカストカプセル剤を高用量(200mg注)を1日1回6週間反復あるいは1日3回8日間反復)で経口投与し、テオフィリンの経口投与(250mg単回)あるいは静脈内投与(5mg/kg単回)を併用したとき、血漿中テオフィリン濃度の低下が認められたが、モンテルカストフィルムコーティング錠10mg(10日間反復)の経口投与とテオフィリン5mg/kg(単回)の静脈内投与の併用では血漿中テオフィリン濃度の変化は認められなかった21)(外国人データ)。
16.7.3 プレドニゾン、プレドニゾロン
健康成人にモンテルカスト200mg注)(6週間反復)とプレドニゾン20mg(単回)を経口投与により併用したとき、プレドニゾンのAUC0-∞及びプレドニゾロンのt1/2がプラセボ群と比較して有意に低下したが、その他の薬物動態パラメータに変化はなかった。また、健康成人にモンテルカスト200mg注)(6週間反復)とプレドニゾロン20mg(単回)を静脈内投与により併用したとき、プレドニゾン及びプレドニゾロンの薬物動態はいずれも影響を受けなかった22)(外国人データ)。
16.7.4 経口避妊薬(エチニルエストラジオール35μg/ノルエチンドロン1mg)
健康成人にモンテルカスト100mg注)(8日間反復)と経口避妊薬(エチニルエストラジオール35μg/ノルエチンドロン1mg単回)を経口投与により併用したとき、エチニルエストラジオール及びノルエチンドロンの薬物動態はいずれも影響を受けなかった23)(外国人データ)。
16.7.5 ジゴキシン
健康成人にモンテルカスト10mg(7日間反復)とジゴキシン0.5mg(単回)を経口投与により併用したとき、免疫反応性ジゴキシンの薬物動態は影響を受けなかった24)(外国人データ)。
16.7.6 ワルファリン
健康成人にモンテルカスト10mg注)(7日間反復)とワルファリン30mg(単回)を経口投与により併用したとき、ワルファリンの血漿中総薬物濃度は影響を受けなかった。また、プロトロンビン時間への影響もなかった25)(外国人データ)。
注)承認された用法及び用量は、6歳以上の小児に1回5mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験(小児)
17.1.2 海外第III相二重盲検比較試験(小児)
小児気管支喘息患者196例を対象とした第III相プラセボ対照二重盲検比較試験において、モンテルカストチュアブル錠5mg投与により1秒量が8.7%増加した。
副作用発現率は6.5%(13/201例)であり、主な副作用は頭痛7例(3.5%)、腹痛3例(1.5%)、不眠症2例(1.0%)であった。なお、臨床検査値異常の副作用はなかった30)。
副作用発現率は6.5%(13/201例)であり、主な副作用は頭痛7例(3.5%)、腹痛3例(1.5%)、不眠症2例(1.0%)であった。なお、臨床検査値異常の副作用はなかった30)。
17.1.3 国内臨床試験(成人)
二重盲検比較試験を含む成人注)気管支喘息患者を対象とした臨床試験におけるモンテルカストフィルムコーティング錠10mg注)群の最終全般改善度の有効率は55.6%(145/261例)であった31)。
17.1.4 国内第III相二重盲検比較試験(成人)
気管支喘息患者を対象とした第III相二重盲検比較試験におけるモンテルカストフィルムコーティング錠10mg注)群の最終全般改善度の有効率は58.5%(83/142例)であり、プランルカスト水和物450mg群[46.0%(63/137例)]に対する非劣性が検証された(非劣性マージンΔ=10%)32)。
副作用発現率は11.0%(20/182例)であり、主な副作用は胸やけ3例(1.6%)、眼瞼浮腫、胃痛、胃不快感、食欲不振、嘔気、下痢が各2例(1.1%)であった。また臨床検査値異常変動は8.8%(16/182例)であり、主な臨床検査値異常変動はALT上昇2.2%(4/182例)、尿潜血1.6%(3/182例)であった32)。
副作用発現率は11.0%(20/182例)であり、主な副作用は胸やけ3例(1.6%)、眼瞼浮腫、胃痛、胃不快感、食欲不振、嘔気、下痢が各2例(1.1%)であった。また臨床検査値異常変動は8.8%(16/182例)であり、主な臨床検査値異常変動はALT上昇2.2%(4/182例)、尿潜血1.6%(3/182例)であった32)。
17.2 製造販売後調査等
17.2.1 国内二重盲検比較市販後臨床試験(小児)
6歳から14歳の小児気管支喘息患者を対象とした二重盲検比較市販後臨床試験の結果、2週時ピークフロー改善値(起床時)はモンテルカスト(5 mg/日)が13.4±3.1L/min、対照薬のケトチフェン(ドライシロップ剤:6歳;1.2mg/日、7歳以上;2mg/日)が3.6±3.1L/min(最小二乗平均±標準誤差)であった33)。副作用発現率は7.6%(7/92例)であり、主な副作用は尿蛋白増加2例(2.2%)であった。
注)承認された用法及び用量は、6歳以上の小児に1回5mgである。
18. 薬効薬理
18.1 作用機序
モンテルカストは、システイニルロイコトリエン タイプ1受容体(CysLT1受容体)に選択的に結合し、炎症惹起メディエーターであるLTD4やLTE4による病態生理学的作用(気管支収縮、血管透過性の亢進、及び粘液分泌促進)を抑制する。この作用機序に基づき、モンテルカストは抗喘息作用として、喘息性炎症の種々の因子を改善する34)。
18.2 LT受容体拮抗作用(受容体結合試験)
受容体結合試験(モルモット肺細胞膜、U937細胞膜及びTHP-1細胞膜)で、LTD4の受容体結合を強力に阻害し、その作用は血液成分による影響を受けなかった。LTC4及びLTB4に対する受容体拮抗作用は弱かった35)。
18.3 気管支収縮抑制作用(摘出臓器及び動物試験)
モルモット摘出気管におけるLTD4の収縮を競合的に阻害した。また、モルモット及びリスザルにおいてLTD4誘発気管支収縮反応に対して強力かつ持続的な阻害作用を示した。一方、モンテルカストは、LTC4(LTC4の代謝を阻害した条件下)による摘出組織の収縮を阻害しなかった。また、モルモットを用いたヒスタミン、アラキドン酸、セロトニン及びアセチルコリン誘発の気管支収縮をほとんど阻害しなかった35)。
18.4 抗原誘発による気管支収縮抑制作用
18.5 即時型及び遅発型気管支収縮反応に対する抑制作用
感作リスザルの抗原誘発による即時型及び遅発型気管支収縮反応を経口投与で抑制した35)。
18.6 アナフィラキシーショックに対する抑制作用
感作モルモットの卵アルブミンによるアナフィラキシーショックを部分的に抑制した37)。
18.7 肺機能の改善作用
軽症から中等症の慢性気管支喘息患者において、1秒量及び最大呼気流量を改善した38)。
18.8 好酸球に対する効果
19. 有効成分に関する理化学的知見
19.1. モンテルカストナトリウム
20. 取扱い上の注意
アルミニウム袋開封後は、遮光して保存すること。
22. 包装
100錠(10錠(PTP)×10)
23. 主要文献
- Philip, G. et al., J. Allergy Clin. Immunol., 124, 691-696, (2009) »PubMed
- Philip, G. et al., J. Allergy Clin. Immunol., 124, 699-706, (2009) »PubMed
- 大西明弘 他, 臨床医薬, 17, 443-470, (2001)
- 飯倉洋治 他, 臨床医薬, 17, 597-608, (2001)
- フィルムコーティング錠とチュアブル錠の血漿中動態(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ヘ.3.(3).2))
- 社内資料:生物学的同等性試験
- 食事の影響(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ヘ.3.(3).2))
- モンテルカストの蛋白との結合(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ヘ.2.(2).1))
- Filppula, A.M. et al., Drug Metab. Dispos., 39, 904-911, (2011) »PubMed
- Karonen, T. et al., Br. J. Clin. Pharmacol., 73, 257-267, (2012) »PubMed
- Karonen, T. et al., Clin. Pharmacol. Ther., 88, 223-230, (2010) »PubMed
- Chiba, M. et al., Drug Metab. Dispos., 25, 1022-1031, (1997) »PubMed
- In vitroにおける代謝(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ヘ.2.(3).4))
- Friedman, E. et al., Clin. Pharmacol. Ther., 79, 72, (2006)
- Balani, S.K. et al., Drug Metab. Dispos., 25, 1282-1287, (1997) »PubMed
- 肝機能不全患者における検討(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ヘ.3.(4))
- 肝機能不全患者における薬物動態試験(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ト.1.(1))
- Zhao, J.J. et al., Biopharm. Drug Dispos., 18, 769-777, (1997) »PubMed
- 高齢者における薬物動態試験(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ト.1.(1))
- Holland, S. et al., Clin. Pharmacol. Ther., 63, 231, (1998)
- Malmstrom, K. et al., Am. J. Ther., 5, 189-195, (1998) »PubMed
- 薬物間相互作用(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ヘ.3.(5))
- Schwartz, J. et al., Clin. Pharmacol. Ther., 61, 162, (1997)
- Depre, M. et al., J. Clin. Pharmacol., 39, 941-944, (1999) »PubMed
- Van Hecken, A. et al., J. Clin. Pharmacol., 39, 495-500, (1999) »PubMed
- 第II相オープン試験−小児気管支喘息−(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ト.1.(2).2))
- 6歳以上小児長期投与試験(治療期)(シングレア細粒/キプレス細粒:2007年7月31日承認、申請資料概要2.7.6.5)
- 6歳以上小児二重盲検比較市販後臨床試験(シングレア細粒/キプレス細粒:2007年7月31日承認、申請資料概要2.7.6.16)
- 6歳以上小児吸入ステロイド併用市販後臨床試験(シングレア細粒/キプレス細粒:2007年7月31日承認、申請資料概要2.7.6.17)
- 小児気管支喘息(6歳〜14歳)におけるプラセボ対照二重盲検比較試験(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ト.1.(2).5))
- 成人気管支喘息に対する検討(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ト.1.(1))
- 宮本昭正 他, 臨床医薬, 17, 519-558, (2001)
- 西間三馨 他, 臨床医薬, 21, 605-636, (2005)
- 効力を裏付ける薬理試験(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ホ.1)
- Jones, T.R. et al., Can. J. Physiol. Pharmacol., 73, 191-201, (1995) »PubMed
- Diamant, Z. et al., Clin. Exp. Allergy., 29, 42-51, (1999) »PubMed
- モンテルカストのアナフィラキシーショックに対する抑制作用(シングレア錠/キプレス錠/シングレアチュアブル錠/キプレスチュアブル錠:2001年6月20日承認、申請資料概要ホ.1.(2).2))
- 宮本昭正 他, 臨床医薬, 17, 577-595, (2001)
- Minoguchi, K. et al., Chest., 121, 732-738, (2002) »PubMed
- 古庄巻史 他, 臨床医薬, 17, 609-621, (2001)
- 古庄巻史 他, 臨床医薬, 21, 1019-1029, (2005)
24. 文献請求先及び問い合わせ先
文献請求先
辰巳化学株式会社
薬事・学術課
〒921-8164
金沢市久安3丁目406番地
電話:076-247-2132
FAX:076-247-5740
製品情報問い合わせ先
辰巳化学株式会社
薬事・学術課
〒921-8164
金沢市久安3丁目406番地
電話:076-247-2132
FAX:076-247-5740
26. 製造販売業者等
26.1 製造販売元
辰巳化学株式会社
金沢市久安3丁目406番地