医薬品情報
| 総称名 | アレンドロン酸 |
|---|---|
| 一般名 | アレンドロン酸ナトリウム水和物 |
| 欧文一般名 | Alendronate Sodium Hydrate |
| 製剤名 | アレンドロン酸ナトリウム水和物注射液 |
| 薬効分類名 | 骨粗鬆症治療剤 |
| 薬効分類番号 | 3999 |
| ATCコード | M05BA04 |
| KEGG DRUG |
D00939
アレンドロン酸ナトリウム水和物
|
| KEGG DGROUP |
DG03232
骨粗鬆症治療薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年1月 改訂(第2版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アレンドロン酸点滴静注バッグ900μg「DK」 (後発品) | Alendronate Bag for Intravenous Infusion 900μg「DK」 | 大興製薬 | 3999419G1032 | 1051円/袋 | 劇薬, 処方箋医薬品注) |
2. 禁忌
4. 効能または効果
5. 効能または効果に関連する注意
本剤の適用にあたっては、日本骨代謝学会の診断基準等を参考に、骨粗鬆症との診断が確定している患者を対象とすること。
6. 用法及び用量
通常、成人には4週に1回アレンドロン酸として900μgを30分以上かけて点滴静脈内投与する。
8. 重要な基本的注意
8.1 患者には、食事等から十分なカルシウムを摂取させること。[11.1.2参照]
8.2 低カルシウム血症がある場合には、本剤投与前に低カルシウム血症を治療すること。また、ビタミンD欠乏症又はビタミンD代謝異常のようなミネラル代謝障害がある場合には、あらかじめ治療を行うこと。[2.2、11.1.2参照]
8.3 ビスホスホネート系薬剤による治療を受けている患者において、顎骨壊死・顎骨骨髄炎があらわれることがある。報告された症例の多くが抜歯等の顎骨に対する侵襲的な歯科処置や局所感染に関連して発現している。リスク因子としては、悪性腫瘍、化学療法、血管新生阻害薬、コルチコステロイド治療、放射線療法、口腔の不衛生、歯科処置の既往等が知られている。
本剤の投与開始前は口腔内の管理状態を確認し、必要に応じて、患者に対し適切な歯科検査を受け、侵襲的な歯科処置をできる限り済ませておくよう指導すること。本剤投与中に侵襲的な歯科処置が必要になった場合には本剤の休薬等を考慮すること。
また、口腔内を清潔に保つこと、定期的な歯科検査を受けること、歯科受診時に本剤の使用を歯科医師に告知して侵襲的な歯科処置はできる限り避けることなどを患者に十分説明し、異常が認められた場合には、直ちに歯科・口腔外科を受診するように指導すること。[11.1.4参照]
本剤の投与開始前は口腔内の管理状態を確認し、必要に応じて、患者に対し適切な歯科検査を受け、侵襲的な歯科処置をできる限り済ませておくよう指導すること。本剤投与中に侵襲的な歯科処置が必要になった場合には本剤の休薬等を考慮すること。
また、口腔内を清潔に保つこと、定期的な歯科検査を受けること、歯科受診時に本剤の使用を歯科医師に告知して侵襲的な歯科処置はできる限り避けることなどを患者に十分説明し、異常が認められた場合には、直ちに歯科・口腔外科を受診するように指導すること。[11.1.4参照]
8.4 ビスホスホネート系薬剤を使用している患者において、外耳道骨壊死が発現したとの報告がある。これらの報告では、耳の感染や外傷に関連して発現した症例も認められることから、外耳炎、耳漏、耳痛等の症状が続く場合には、耳鼻咽喉科を受診するよう指導すること。[11.1.5参照]
8.5 ビスホスホネート系薬剤を長期使用している患者において、非外傷性又は軽微な外力による大腿骨転子下、近位大腿骨骨幹部、近位尺骨骨幹部等の非定型骨折が発現したとの報告がある。これらの報告では、完全骨折が起こる数週間から数ヵ月前に大腿部、鼠径部、前腕部等において前駆痛が認められている報告もあることから、このような症状が認められた場合には、X線検査等を行い、適切な処置を行うこと。また、両側性の骨折が生じる可能性があることから、片側で非定型骨折が起きた場合には、反対側の部位の症状等を確認し、X線検査を行うなど、慎重に観察すること。X線検査時には骨皮質の肥厚等、特徴的な画像所見がみられており、そのような場合には適切な処置を行うこと。[11.1.6参照]
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害のある患者
9.4 生殖能を有する者
妊娠する可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
ビスホスホネート系薬剤は骨基質に取り込まれた後に全身循環へ徐々に放出される。全身循環への放出量はビスホスホネート系薬剤の投与量・期間に相関する。ビスホスホネート系薬剤の中止から妊娠までの期間と危険性との関連は明らかではない。
ビスホスホネート系薬剤は骨基質に取り込まれた後に全身循環へ徐々に放出される。全身循環への放出量はビスホスホネート系薬剤の投与量・期間に相関する。ビスホスホネート系薬剤の中止から妊娠までの期間と危険性との関連は明らかではない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
動物実験(ラット)でアレンドロン酸が乳汁中に移行することが報告されている。
動物実験(ラット)でアレンドロン酸が乳汁中に移行することが報告されている。
9.7 小児等
小児等の骨粗鬆症を対象とした臨床試験は実施していない。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
副作用の頻度は35mg錠(35mg/週)の臨床試験及び特定使用成績調査の合計より算出した。
副作用の頻度は35mg錠(35mg/週)の臨床試験及び特定使用成績調査の合計より算出した。
11.1.1 肝機能障害、黄疸(いずれも頻度不明)
AST、ALTの上昇を伴う肝機能障害、黄疸があらわれることがある。
11.1.2 低カルシウム血症(0.09%)
痙攣、テタニー、しびれ、失見当識、QT延長等を伴う低カルシウム血症があらわれることがある。異常が認められた場合にはカルシウム剤の点滴投与等を考慮すること。[2.2、8.1、8.2、9.2.1参照]
11.1.3 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
11.1.4 顎骨壊死・顎骨骨髄炎(0.03%)[8.3参照]
11.1.5 外耳道骨壊死(頻度不明)[8.4参照]
11.1.6 大腿骨転子下、近位大腿骨骨幹部、近位尺骨骨幹部等の非定型骨折(頻度不明)[8.5参照]
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 消化器 | 胃痛・心窩部痛、胃不快感・胃重感・腹部不快感 | 腹痛、嘔吐、食欲不振、腹部膨満感、口内炎、胃酸逆流、咽喉頭痛、咽喉頭不快感、おくび、嘔気、便秘、下痢、胃炎、消化不良 | 鼓腸放屁、口内乾燥、嚥下困難、歯肉腫脹 |
| 皮膚・皮膚付属器 | 発疹、かゆみ、脱毛、蕁麻疹 | 紅斑、湿疹 | |
| 血液 | 貧血(赤血球数減少、ヘモグロビン低下等)、白血球数減少、血小板数減少 | ||
| 肝臓 | 肝機能異常(AST上昇、ALT上昇、γ-GTP上昇等) | ||
| 腎臓 | BUN上昇 | 頻尿、排尿困難 | |
| 中枢・末梢神経系 | 浮動性めまい、頭痛 | 回転性めまい、知覚減退 | |
| 筋・骨格系 | 関節痛注)、背(部)痛注)、筋肉痛注)、骨痛注)、筋痙攣 | ||
| 精神・神経系 | 不眠(症) | ||
| 電解質代謝 | 血清リン低下、血清カリウム上昇 | ||
| 眼 | 眼症状(かすみ、異和感等)、強膜炎 | ぶどう膜炎、上強膜炎 | |
| その他 | 胸痛、倦怠(感)、味覚倒錯、末梢性浮腫、顔面浮腫、動悸、脱力(感)、発熱、気分不良、ほてり(顔面紅潮、熱感等)、CK上昇、血圧上昇 | 血管浮腫、LDH上昇、総コレステロール値上昇、血清アルブミン低下、下肢痛 |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 本剤は点滴静脈内投与にのみ使用し、30分以上かけてゆっくり投与すること。
14.1.2 カルシウム又はマグネシウムイオンと結合して不溶性沈殿物を形成することがあるので、カルシウム又はマグネシウムを含有する点滴溶液とは混和しないこと。
16. 薬物動態
16.1 血中濃度
16.1.1 閉経後の女性にアレンドロン酸として100、200、400、800、1,600及び2,000μgを含有する注射剤を30分間かけて単回持続点滴静脈内投与したとき、tmaxは持続投与終了時である投与開始後0.5時間であった。Cmax、AUCt、血中消失半減期の幾何平均値(CV%)は、以下のとおりであった2)。
| 投与量(μg) | Cmax注1)(ng/mL) | AUCt注1)(ng・h/mL) | 血中消失半減期注1)(h) |
| 100 (n=7) | 8.89(8.3) | 8.53(8.9) | 0.650(3.6) |
| 200 (n=7) | 16.28(7.0) | 16.04(6.4) | 0.649(9.5) |
| 400 (n=7) | 35.32(13.4) | 34.62(12.4) | 0.632(5.9) |
| 800 (n=7) | 70.32(10.3) | 68.28(10.3) | 0.642(9.0) |
| 1,600 (n=7) | 141.18(8.0) | 137.69(6.0) | 0.645(5.6) |
| 2,000 (n=8) | 170.86(11.9) | 163.64(12.0) | 0.626(4.7) |
16.1.2 閉経後の女性に2パネル2期クロスオーバー法によるオープン試験にて、アレンドロン酸として200μgの単回点滴静脈内投与(n=23)及びアレンドロン酸として35mgの単回経口投与(n=24)を行ったとき、Cmaxの幾何平均値(CV%)はそれぞれ17.28(16.6)及び10.25(142.4)ng/mLであった。AUCtの幾何平均値(CV%)はそれぞれ16.35(15.8)及び16.29(149.7)ng・h/mLであり、AUCinfの幾何平均値(CV%)はそれぞれ18.59(14.6)及び26.59(126.1)ng・h/mLであった3)。
16.4 代謝
アレンドロン酸ナトリウム水和物投与により、動物又はヒトで代謝物は認められていない。
16.5 排泄
16.5.1 閉経後の女性にアレンドロン酸として100、200、400、800、1,600及び2,000μgを含有する注射剤を、30分間かけて単回持続点滴静脈内投与したとき、投与開始から48時間まで(2,000μg群は投与開始から36時間まで)のアレンドロン酸の累積尿中排泄量の幾何平均値(CV%)は、以下のとおりであった。
| 投与量(μg) | 累積尿中排泄量注2)(μg) |
| 100 (n=8) | 46.19(17.6) |
| 200 (n=7) | 106.27(6.0) |
| 400 (n=8) | 186.27(17.5) |
| 800 (n=8) | 384.21(10.6) |
| 1,600 (n=8) | 855.10(7.6) |
| 2,000 (n=8) | 962.27(7.3) |
以上より累積尿中排泄量は、用量に依存して増加した。そのほとんどは投与後8時間までに排泄された2)。
16.5.2 閉経後の女性に2パネル2期クロスオーバー法によるオープン試験にて、朝食30分前にアレンドロン酸として200μgの単回点滴静脈内投与(n=23)及びアレンドロン酸として35mgの単回経口投与(n=24)を行ったとき、投与開始時から48時間までの累積尿中排泄量の幾何平均値(CV%)はそれぞれ98.55(12.5)μg及び103.59(124.3)μgであった。累積尿中排泄率及び生物学的利用率は下記の結果が得られた3)。
| 対象 | 尿中排泄率注3)(%) | 生物学的利用率注3)(%) | |
| 静脈内投与 | 経口投与 | ||
| 閉経後女性 | 49.28(12.5) | 0.30(124.3) | 0.60(122.1) |
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
閉経後女性の腎機能正常者(n=7)及び軽度(n=8)・中等度(n=7)・高度(n=4)の腎機能低下患者にアレンドロン酸として900μgを含有する注射剤を単回投与したとき、各群の腎機能正常者に対するCmaxの幾何平均値の比率は、軽度群、中等度群、高度群でそれぞれ1.1、1.1、1.0であった。AUCtの幾何平均値の比率は、軽度群、中等度群、高度群でそれぞれ1.1、1.2、1.3であった。また、血中消失半減期の幾何平均値(CV%)は、腎機能正常者群、軽度群、中等度群、高度群でそれぞれ1.224(5.3)、1.381(7.2)、1.342(13.5)、1.692(6.8)hであった。また、投与開始から48時間までのアレンドロン酸の累積尿中排泄量の幾何平均値(CV%)は、正常者群、軽度群、中等度群、高度群でそれぞれ423.69(18.5)、445.73(17.2)、298.02(29.2)、154.47(25.8)μgであった。投与後48時間までの累積尿中排泄率の幾何平均値(CV%)は、正常者群、軽度群、中等度群、高度群でそれぞれ47.08(18.5)、49.53(17.2)、33.11(29.2)、17.15(25.9)%であった4)。[9.2.1参照]
(注)本剤の承認された用法及び用量は4週に1回アレンドロン酸として900μg点滴静脈内投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 骨密度試験
(1)国内第III相試験
退行期骨粗鬆症患者(有効性評価対象325例、うち男性患者は、アレンドロン酸ナトリウム水和物注射剤(900μg/4週)7/162例、対照薬35mg錠(35mg/週)12/163例)における52週間の二重盲検試験において、腰椎(L2-L4)骨密度増加率の最小二乗平均値±標準誤差は、アレンドロン酸ナトリウム水和物注射剤(900μg/4週)投与6.1±0.3%、対照薬の35mg錠(35mg/週)投与5.5±0.3%であった。アレンドロン酸ナトリウム水和物注射剤(900μg/4週)投与と35mg錠(35mg/週)投与の腰椎(L2-L4)骨密度増加率(投与52週後)の最小二乗平均値の差(差の95%信頼区間)は0.60(−0.22〜1.42)であり、アレンドロン酸ナトリウム水和物注射剤(900μg/4週)投与は35mg錠(35mg/週)投与に劣らないことが検証された。また、投与52週後における大腿骨骨密度増加率の最小二乗平均値±標準誤差は、それぞれ2.4±0.2%(900μg/4週)及び2.0±0.2%(35mg/週)であった。アレンドロン酸ナトリウム水和物注射剤(900μg/4週)投与と35mg錠(35mg/週)投与の大腿骨骨密度増加率(投与52週後)の最小二乗平均値の差(差の95%信頼区間)は0.48(−0.03〜0.99)であり、同程度の骨密度増加効果を示した。
本試験におけるアレンドロン酸ナトリウム水和物注射剤投与群(900μg/4週)の安全性評価対象162例中28例(17.3%)に44件の副作用が認められた。主な副作用は、背部痛8件(4.9%)、筋肉痛3件(1.9%)、発熱3件(1.9%)、白血球数減少2件(1.2%)であった。なお、安全性において、アレンドロン酸ナトリウム水和物注射剤(900μg/4週)投与の副作用発現率は、35mg錠(35mg/週)投与と同程度であった5)。
(2)国内第III相試験(参考)
退行期骨粗鬆症患者(有効性評価対象297例)における52週間の二重盲検試験において、腰椎(L1-L4)骨密度増加率(投与52週後)の最小二乗平均値±標準誤差は、35mg錠(35mg/週)投与6.3±0.4%、対照薬の5mg錠(5mg/日)投与5.8±0.4%であった。35mg錠投与と5mg錠投与の腰椎(L1-L4)骨密度増加率(投与52週後)の最小二乗平均値の差(差の95%信頼区間)は0.58(−0.31〜1.48)であり、骨密度増加効果は同等であった。また、大腿骨骨密度(投与52週)においても、それぞれ3.0±0.4%(35mg/週)及び2.8±0.4%(5mg/日)であり、同程度の骨密度増加効果を示した。35mg錠投与と5mg錠投与の大腿骨骨密度増加率(投与52週後)の最小二乗平均値の差(差の95%信頼区間)は0.15(−0.65〜0.95)であった。なお、安全性において、35mg錠(35mg/週)投与の副作用発現率は、5mg錠(5mg/日)投与と同程度であった6)。
本試験における35mg錠(35mg/週)の安全性評価対象168例中22例(13.1%)に28件の副作用が認められた。主な症状は消化管障害であり、24件[上腹部痛4件(2.4%)、胃不快感4件(2.4%)、胃潰瘍3件(1.8%)、胃炎3件(1.8%)等]であった。また、臨床検査値異常変動は168例中6例(3.6%)に10件認められた。主なものはγ-GTP上昇4件(2.4%)、AST上昇2件(1.2%)、ALT上昇2件(1.2%)であった。なお、5%を超える頻度の副作用は認められなかった。
17.1.2 骨折試験(参考)
(1)国内第III相試験
退行期骨粗鬆症患者365例における2年間の二重盲検比較試験(骨折発生頻度)において、胸腰椎の新規骨折発生率は5mg錠(5mg/日)投与で12.2%、対照薬(アルファカルシドール、1μg/日)で16.7%であり、対照薬に対する5mg錠(5mg/日)の非劣性が検証された。この試験において、投与6ヵ月以降に発生した胸腰椎の新規骨折発生率は、5mg錠(5mg/日)投与では対照薬に比して8.4%低く統計的に有意差を認めた(相対危険減少率66%)。また、2年間における胸腰椎での複数の新規骨折発生率は5mg錠(5mg/日)投与では対照薬に比して4.9%低かった(相対危険減少率67%)7)。さらに、延長試験として実施された3年間の成績においても投与6ヵ月以降に発生した胸腰椎の新規骨折発生率は、5mg錠(5mg/日)投与で7.8%、対照薬で18.8%であり、5mg錠(5mg/日)の有意な椎体骨折抑制効果が3年間にわたり確認された8)。
(2)海外第III相試験
閉経後骨粗鬆症患者2,027例における錠剤3年間のプラセボ対照二重盲検比較試験において、最初の2年間は5mg/日、3年目は10mg/日投与した結果は下表のとおりである9)。
| 骨折の種類 | 骨折抑制率(%) |
| 胸腰椎の新規骨折注) | 47% |
| 2個以上の胸腰椎の新規骨折注) | 90% |
| 新規大腿骨近位部骨折 | 51% |
(注)国内における錠剤の承認された用法及び用量はアレンドロン酸として週1回35mg、あるいは1日1回5mgである。
18. 薬効薬理
18.1 作用機序
18.2 骨量減少に対する作用
| 動物種 | 方法 | 結果 |
| 卵巣摘出ラット15) | アレンドロン酸として0.04〜5mg/kg/日を卵巣摘出の翌日から2ヵ月間経口投与 | 卵巣摘出による骨量減少をアレンドロン酸として1mg/kg/日以上の投与量で骨石灰化に障害を与えずに抑制した。 |
| 卵巣摘出ラット | アレンドロン酸として0.1、0.5mg/kg/日を卵巣摘出の翌日から12ヵ月間経口投与 | アレンドロン酸として0.5mg/kg/日の1年間の経口投与により、卵巣摘出による腰椎の骨量の減少を抑制し、卵巣非摘出ラットと同様の骨強度を維持した。 |
| 卵巣摘出ラット16) | アレンドロン酸として0.224、1.12、5.6、28mg/kg/月(28日間)を、それぞれ週2回、週1回又は2週に1回の投与頻度で、卵巣摘出の翌日から3ヵ月間皮下投与 | 卵巣摘出による大腿骨及び脛骨の骨量の減少を投与頻度にかかわらず、同程度抑制した。また、骨形態により骨吸収亢進も同程度抑制した。 |
| 卵巣摘出ヒヒ17) | アレンドロン酸として0.04、0.19mg/kgを、卵巣摘出後2週に1回、2年間静脈内投与 | アレンドロン酸として0.04mg/kg以上で骨代謝回転亢進が卵巣非摘出群レベルまで抑制されることが、生化学的マーカー及び骨形態により示された。また、海綿骨量を骨石灰化を障害せずに増加させ、皮質骨の粗鬆性の亢進を防止した。腰椎の海綿骨の強度はアレンドロン酸ナトリウム水和物投与により増加し、骨量と骨強度には正の相関が認められた。 |
18.3 骨石灰化に対する影響
アレンドロン酸ナトリウム水和物は、上記の骨量減少モデルにおいて1年以上の投与(ラット:1年、ヒヒ:2年)を行ったとき、骨量減少を抑制する投与量では骨石灰化障害を示唆する結果が得られていない17)。成長過程のラット(Schenk評価系)において、骨吸収を抑制する投与量は骨石灰化を障害する投与量の約1/6,000であり、広い安全域が示されている。
18.4 骨強度、骨折治癒過程に対する影響
19. 有効成分に関する理化学的知見
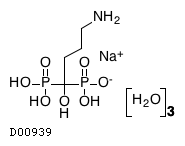
19.1. アレンドロン酸ナトリウム水和物
20. 取扱い上の注意
20.1 製品の品質を保持するため、本品を包んでいる外袋は使用時まで開封しないこと。また、開封後は速やかに使用すること。
20.2 包装内に水滴が認められるものや内容液が着色又は混濁しているものは使用しないこと。
20.3 容器の液目盛りは、およその目安として使用すること。
22. 包装
100mL×5バッグ
23. 主要文献
- MID-NETを用いた調査結果の概要(MID-NETを用いたビスホスホネート製剤の腎機能障害患者における低カルシウム血症のリスク評価に関するデータベース調査), (https://www.pmda.go.jp/files/000249186.pdf)
- 薬物動態(閉経後女性、単回)(ボナロン点滴静注バッグ900μg:2012年1月18日承認、申請資料概要2.7.6.2)
- 薬物動態(閉経後女性、単回)(ボナロン点滴静注バッグ900μg:2012年1月18日承認、申請資料概要2.7.6.3)
- 蓮沼智子ほか, 臨床薬理, 43 (6), 365-73, (2012) »DOI
- アレンドロネート35mg対照無作為化二重盲検比較試験(退行期骨粗鬆症患者)(ボナロン点滴静注バッグ900μg:2012年1月18日承認、申請資料概要2.7.6.5)
- Uchida S,et al., J Bone Miner Metab., 23 (5), 382-8, (2005) »PubMed
- Kushida K,et al., Curr Ther Res., 63 (9), 606-20, (2002)
- Kushida K,et al., J Bone Miner Metab., 22 (5), 462-8, (2004) »PubMed
- Black DM,et al., Lancet., 348 (9041), 1535-41, (1996) »PubMed
- Shiraki M,et al., Osteoporosis Int., 10 (3), 183-92, (1999) »PubMed
- Liberman UA,et al., N Engl J Med., 333 (22), 1437-43, (1995) »PubMed
- Hochberg MC,et al., Arthritis Rheum., 42 (6), 1246-54, (1999) »PubMed
- Masarachia P,et al., Bone., 19 (3), 281-90, (1996) »PubMed
- Sato M,et al., J Clin Invest., 88 (6), 2095-105, (1991) »PubMed
- Azuma Y,et al., J Pharmacol Exp Ther., 286 (1), 128-35, (1998) »PubMed
- Seedor JG,et al., J Bone Miner Res., 6 (4), 339-46, (1991) »PubMed
- Balena R,et al., J Clin Invest., 92 (6), 2577-86, (1993) »PubMed
- Peter CP,et al., J Pharmacol Exp Ther., 276 (1), 271-6, (1996) »PubMed
- Balena R,et al., J Pharmacol Exp Ther., 276 (1), 277-83, (1996) »PubMed
- Peter CP,et al., J Orthop Res., 14 (1), 74-9, (1996) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
大興製薬株式会社
安全管理部
〒350-1155
埼玉県川越市下赤坂560番地1
電話:049-266-6061
FAX:049-266-6078
製品情報問い合わせ先
大興製薬株式会社
安全管理部
〒350-1155
埼玉県川越市下赤坂560番地1
電話:049-266-6061
FAX:049-266-6078
26. 製造販売業者等
26.1 製造販売元
大興製薬株式会社
埼玉県川越市下赤坂560番地1