医薬品情報
| 総称名 | コムクロ |
|---|---|
| 一般名 | クロベタゾールプロピオン酸エステル |
| 欧文一般名 | Clobetasol Propionate |
| 製剤名 | クロベタゾールプロピオン酸エステル シャンプー |
| 薬効分類名 | 外用合成副腎皮質ホルモン剤 |
| 薬効分類番号 | 2646 |
| ATCコード | D07AD01 |
| KEGG DRUG |
D01272
クロベタゾールプロピオン酸エステル
|
| KEGG DGROUP |
DG01955
副腎皮質ステロイド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年1月 改訂(再審査結果)(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| コムクロシャンプー0.05% | Comclo Shampoo | マルホ | 2646713Q2029 | 18.3円/g | 劇薬 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 頭部に皮膚感染症のある患者[感染を悪化させるおそれがある]
2.3 頭部に潰瘍性病変のある患者[皮膚の再生が抑制され、治癒が遅れるおそれがある]
4. 効能または効果
頭部の下記疾患
尋常性乾癬、湿疹・皮膚炎
6. 用法及び用量
通常、1日1回、乾燥した頭部に患部を中心に適量を塗布し、約15分後に水又は湯で泡立て、洗い流す。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
8.1 本剤の使用により症状の改善がみられない場合又は症状の悪化をみる場合は使用を中止すること。
8.2 眼及び眼瞼皮膚へ付着した場合、白内障、緑内障を含む眼障害が発現する可能性がある。眼及び眼瞼皮膚へ付着しないよう注意し、付着した場合は直ちに水で洗い流すこと。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で催奇形作用が報告されている1)。
9.7 小児等
<頭部の尋常性乾癬>
小児等を対象とした臨床試験は実施していない。
<頭部の湿疹・皮膚炎>
12歳未満の小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下しているので、注意すること。
11. 副作用
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 過敏症 | 接触皮膚炎 | 灼熱感、疼痛、そう痒感、浮腫、蕁麻疹、発疹、紅斑 | |
| 皮膚の感染症注1) | 毛包炎 | ざ瘡 | |
| その他の皮膚症状 | 刺激感 | 不快感、毛細血管拡張、乾癬の悪化、皮膚萎縮、乾燥、脱毛症、ツッパリ感、色素沈着、膿疱性皮疹、毛髪成長異常、多毛 | |
| 下垂体・副腎皮質系注2) | クッシング症候群、副腎皮質系機能の抑制 | ||
| 眼 | 眼刺激、眼部刺痛、眼の灼熱感、眼の異常感、霧視、緑内障、中心性漿液性網脈絡膜症 | ||
| その他 | 頭痛 |
14. 適用上の注意
14.1 薬剤使用時の注意
薬剤の浸透性が高まる可能性があることから、塗布部位を覆わないこと。
14.2 薬剤使用後の注意
本剤使用後は、完全に洗い流し、よく手を洗うこと。
15. その他の注意
16. 薬物動態
16.1 血中濃度
頭部乾癬患者を対象とした海外臨床試験において、本剤又はプラセボを4週間反復投与後に、クロベタゾールプロピオン酸エステルの血漿中濃度を測定した。126検体を採取して分析した結果、血漿中クロベタゾールプロピオン酸エステルは本剤群の1例のみで検出され(0.43ng/mL)、残りは定量下限(0.2ng/mL)未満であった4)(外国人データ)。
16.3 分布
ヒト皮膚組織に本剤を16時間塗布した際の角層を含む表皮中には、塗布量の19%のクロベタゾールプロピオン酸エステルが検出された。一方、臨床用法・用量に従い、本剤を塗布後15分間で除去した場合は、塗布量の0.1%であった。また、真皮及びレセプター液中クロベタゾールプロピオン酸エステル量は、いずれの塗布時間でもほとんどの試料で定量下限(5ng/mL)未満であった5)(in vitro)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<頭部の尋常性乾癬>
17.1.1 国内第III相臨床試験(二重盲検比較試験)
日本人の頭部の尋常性乾癬患者注1)157例を対象に、本剤又はプラセボを1日1回4週間投与した二重盲検比較試験6)を実施した。
4週後のPSSI(Psoriasis Scalp Severity Index)スコア注2)が75%以上改善した患者の割合(PSSI 75達成率)は次のとおりであり、両群間で統計学的に有意な差が認められた。[7.参照]
副作用は、本剤群では認められなかった。
4週後のPSSI(Psoriasis Scalp Severity Index)スコア注2)が75%以上改善した患者の割合(PSSI 75達成率)は次のとおりであり、両群間で統計学的に有意な差が認められた。[7.参照]
副作用は、本剤群では認められなかった。
| 本剤 | プラセボ | |
| 4週後のPSSI 75達成率 (例数) | 29.5% (23/78例) | 7.6% (6/79例) |
| 群間差 [95%信頼区間] P値※ | 21.9% [10.2%,33.6%] P<0.001 | |
注1)PSSI皮疹重症度合計スコアが6以上、かつ頭部面積に対する病変面積の割合が30%以上の患者
注2)皮疹重症度スコア(紅斑、浸潤/肥厚、鱗屑:それぞれ0〜4、0.5刻みの9段階評価)の合計に病変範囲スコア(0〜6の7段階評価)を乗じて算出
<頭部の湿疹・皮膚炎>
17.1.2 国内第III相臨床試験(二重盲検比較試験)
日本人(12歳以上)の頭部の脂漏性皮膚炎患者注3)93例を対象に、本剤又はプラセボを1日1回4週間投与した二重盲検比較試験7)を実施した。
4週後のTSS(Total Severity Score)注4)変化量の差の最小二乗平均は次のとおりであり、群間に統計学的に有意な差が認められた。[7.参照]
本剤群での副作用発現頻度は4.3%(2/46例)で、適用部位毛包炎2.2%(1/46例)、ざ瘡2.2%(1/46例)、接触皮膚炎2.2%(1/46例)であった。
4週後のTSS(Total Severity Score)注4)変化量の差の最小二乗平均は次のとおりであり、群間に統計学的に有意な差が認められた。[7.参照]
本剤群での副作用発現頻度は4.3%(2/46例)で、適用部位毛包炎2.2%(1/46例)、ざ瘡2.2%(1/46例)、接触皮膚炎2.2%(1/46例)であった。
| 本剤(46例) | プラセボ(47例) | |
| ベースライン | 6.65±0.82 | 6.78±0.80 |
| 4週後の変化量 | −4.91±1.36 | −3.07±1.78 |
| 差の最小二乗平均 [95%信頼区間] P値※ | −1.87 [−2.53,−1.21] P<0.0001 | |
注3)紅斑、鱗屑及びそう痒がいずれも中等症以上(スコア2以上)、かつ頭皮の病変範囲が30%以上の患者
注4)紅斑、鱗屑及びそう痒のスコア(それぞれ0〜3、0.5刻みの7段階評価)の合計値
17.1.3 国内第III相臨床試験(一般臨床試験)
日本人(12歳以上)の脂漏性皮膚炎を除く頭部の湿疹・皮膚炎患者注5)60例を対象に、本剤を1日1回4週間投与した非対照、非盲検試験8)を実施した。
4週後のIGA(Investigator Global Assessment)注6)が2段階以上改善かつ0又は1となった被験者の割合は76.3%(45/59例)であった。[7.参照]
副作用発現頻度は6.7%(4/60例)で、適用部位毛包炎5.0%(3/60例)、適用部位刺激感1.7%(1/60例)であった。
4週後のIGA(Investigator Global Assessment)注6)が2段階以上改善かつ0又は1となった被験者の割合は76.3%(45/59例)であった。[7.参照]
副作用発現頻度は6.7%(4/60例)で、適用部位毛包炎5.0%(3/60例)、適用部位刺激感1.7%(1/60例)であった。
注5)疾患重症度が中等度以上(IGAが3以上)の患者
注6)皮膚所見に基づく疾患重症度評価(0〜4の5段階評価)
18. 薬効薬理
18.1 作用機序
クロベタゾールプロピオン酸エステルは、標的細胞のグルココルチコイド受容体と結合し、炎症・免疫反応に関わる標的遺伝子の転写の活性化やNF-κB等の転写調節因子の活性化を直接阻害することで、炎症性サイトカインの産生抑制やT細胞等の増殖抑制などの作用が総合的に作用して抗炎症効果を発揮するものと考えられている9)。
18.2 短時間塗布による抗炎症作用
TPA(12-O-テトラデカノイルフォルボール-13-アセテート)誘発マウス皮膚炎モデルにおいて、本剤を1〜30分間塗布することにより耳介腫脹を有意に抑制した10)。
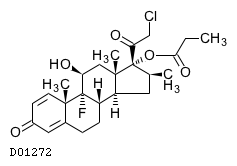
19. 有効成分に関する理化学的知見
19.1. クロベタゾールプロピオン酸エステル
20. 取扱い上の注意
20.1 本剤を子供の手の届かない、高温にならない所に保管すること。一般のシャンプーなどと区別して保管すること。
20.2 開封後、6ヵ月以上経過したものは使用しないこと。
22. 包装
ボトル
125mL(125g)×1
23. 主要文献
- 倉本昌明ら, 基礎と臨床, 9 (13), 3259-3283, (1975)
- Saeki H.,et al., J.Dermatol., 35 (9), 601-603, (2008) »PubMed
- Hellgren L., Ann.Clin.Res., 8 (5), 317-319, (1976) »PubMed
- 社内資料:頭皮乾癬患者を対象とした第III相臨床試験(反復経皮投与後の血漿中濃度[外国人データ])(2017年3月30日承認、CTD2.7.6.13)
- 社内資料:皮内分布(ヒト皮膚組織を用いたin vitro透過性試験)(2017年3月30日承認、CTD2.6.4.4.1)
- Nakagawa H.,et al., 臨床医薬, 33 (2), 163-181, (2017)
- 社内資料:頭皮の脂漏性皮膚炎患者を対象とした第III相試験(プラセボ対照試験)
- 社内資料:脂漏性皮膚炎を除く頭皮の湿疹・皮膚炎患者を対象とした第III相試験(一般臨床試験)
- Adcock I.M., Pulm.Pharmacol.Ther., 13 (3), 115-126, (2000) »PubMed
- 社内資料:TPA誘発皮膚炎モデルにおける短時間塗布による抗炎症作用(2017年3月30日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
マルホ株式会社
製品情報センター
〒531-0071
大阪市北区中津1-11-1
電話:0120-12-2834
製品情報問い合わせ先
マルホ株式会社
製品情報センター
〒531-0071
大阪市北区中津1-11-1
電話:0120-12-2834
26. 製造販売業者等
26.1 製造販売(輸入)
マルホ株式会社
大阪市北区中津1-5-22
26.2 提携
GALDERMA