医薬品情報
| 総称名 | セフジニル |
|---|---|
| 一般名 | セフジニル |
| 欧文一般名 | Cefdinir |
| 薬効分類名 | 経口用セフェム系抗生物質製剤 |
| 薬効分類番号 | 6132 |
| ATCコード | J01DD15 |
| KEGG DRUG |
D00917
セフジニル
|
| KEGG DGROUP |
DG01488
セフェム系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年9月 改訂(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 12.臨床検査結果に及ぼす影響 15.その他の注意 16.薬物動態 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| セフジニル細粒小児用10%「トーワ」 (後発品) | CEFDINIR FINE GRANULES FOR PEDIATRIC 10%"TOWA" | 東和薬品 | 6132013C1163 | 45円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者[9.1.1参照]
4. 効能または効果
<適応菌種>
<適応症>
表在性皮膚感染症、深在性皮膚感染症、リンパ管・リンパ節炎、慢性膿皮症、咽頭・喉頭炎、扁桃炎、急性気管支炎、肺炎、膀胱炎、腎盂腎炎、中耳炎、副鼻腔炎、猩紅熱
5. 効能または効果に関連する注意
<咽頭・喉頭炎、扁桃炎、急性気管支炎、中耳炎、副鼻腔炎>
「抗微生物薬適正使用の手引き」1)を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
6. 用法及び用量
通常、小児に対してセフジニルとして1日量9〜18mg(力価)/kgを3回に分割して経口投与する。
なお、年齢及び症状に応じて適宜増減する。
なお、年齢及び症状に応じて適宜増減する。
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
8.2 ショックがあらわれるおそれがあるので、十分な問診を行うこと。[11.1.1参照]
8.3 汎血球減少、無顆粒球症、血小板減少、溶血性貧血があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[11.1.4参照]
8.4 急性腎障害等の重篤な腎障害があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[11.1.7参照]
8.5 劇症肝炎等の重篤な肝炎、著しいAST、ALT、Al-Pの上昇等を伴う肝機能障害、黄疸があらわれることがあるので、定期的に検査を行うなど観察を十分に行うこと。[11.1.8参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 セフェム系又はペニシリン系抗生物質に対し過敏症の既往歴のある患者(ただし、本剤に対し過敏症の既往歴のある患者には投与しないこと)[2.参照]
9.1.2 本人又は両親、兄弟に気管支喘息、発疹、蕁麻疹等のアレルギー症状を起こしやすい体質を有する患者
9.1.3 経口摂取の不良な患者又は非経口栄養の患者、全身状態の悪い患者
観察を十分に行うこと。ビタミンK欠乏症状があらわれることがある。
9.2 腎機能障害患者
9.2.1 高度の腎障害のある患者
腎障害の程度に応じて投与量を減量し、投与の間隔をあけて使用すること。血中濃度が持続する。[16.6.1参照]
9.7 小児等
低出生体重児、新生児を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| 鉄剤 | 本剤の吸収を約10分の1まで阻害するので、併用は避けることが望ましい。やむを得ず併用する場合には、本剤の投与後3時間以上間隔をあけて投与する。 | 腸管内において鉄イオンとほとんど吸収されない錯体を形成する。 |
| ワルファリンカリウム | ワルファリンカリウムの作用が増強されるおそれがある。ただし、本剤に関する症例報告はない。 | 腸内細菌によるビタミンKの産生を抑制することがある。 |
| 制酸剤(アルミニウム又はマグネシウム含有) | 本剤の吸収が低下し、効果が減弱されるおそれがあるので、本剤の投与後2時間以上間隔をあけて投与する。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(0.1%未満)
不快感、口内異常感、喘鳴、眩暈、便意、耳鳴、発汗等があらわれた場合には投与を中止し、適切な処置を行うこと。[8.2参照]
11.1.2 アナフィラキシー(0.1%未満)
アナフィラキシー(呼吸困難、全身潮紅、血管浮腫、蕁麻疹等)があらわれることがある。
11.1.3 皮膚障害(頻度不明)
中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(各0.1%未満)があらわれることがあるので、発熱、頭痛、関節痛、皮膚や粘膜の紅斑・水疱、皮膚の緊張感・灼熱感・疼痛等が認められた場合には投与を中止し、適切な処置を行うこと。
11.1.4 血液障害(頻度不明)
汎血球減少、無顆粒球症(初期症状:発熱、咽頭痛、頭痛、倦怠感等)、血小板減少(初期症状:点状出血、紫斑等)、溶血性貧血(初期症状:発熱、ヘモグロビン尿、貧血症状等)(各0.1%未満)があらわれることがある。[8.3参照]
11.1.5 大腸炎(0.1%未満)
偽膜性大腸炎等の血便を伴う重篤な大腸炎があらわれることがある。腹痛、頻回の下痢があらわれた場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.6 間質性肺炎、PIE症候群(各0.1%未満)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎、PIE症候群等があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.7 腎障害(0.1%未満)
急性腎障害等の重篤な腎障害があらわれることがある。[8.4参照]
11.1.8 劇症肝炎、肝機能障害、黄疸(各0.1%未満)
劇症肝炎等の重篤な肝炎、著しいAST、ALT、Al-Pの上昇等を伴う肝機能障害、黄疸があらわれることがある。[8.5参照]
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | 蕁麻疹、紅斑、浮腫 | そう痒、発熱 |
| 血液 | 好酸球増多 | 顆粒球減少 | |
| 腎臓 | BUN上昇 | ||
| 消化器 | 下痢 | 腹痛、嘔吐、悪心、食欲不振 | 胃部不快感、胸やけ、便秘 |
| 菌交代症 | 口内炎、カンジダ症 | 黒毛舌 | |
| ビタミン欠乏症 | ビタミンK欠乏症状(低プロトロンビン血症、出血傾向等)、ビタミンB群欠乏症状(舌炎、口内炎、食欲不振、神経炎等) | ||
| その他 | めまい | 頭痛、胸部圧迫感、しびれ |
12. 臨床検査結果に及ぼす影響
12.1 テステープ反応を除くベネディクト試薬、フェーリング試薬による尿糖検査では偽陽性を呈することがあるので注意すること。
12.2 直接クームス試験陽性を呈することがあるので注意すること。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 粉ミルク、経腸栄養剤など鉄添加製品との併用により、便が赤色調を呈することがある。
15.1.2 尿が赤色調を呈することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 生物学的同等性試験
セフジニル細粒小児用10%「トーワ」とセフゾン細粒小児用10%を、クロスオーバー法によりそれぞれ1g(セフジニルとして100mg(力価))健康成人男子に絶食単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された。2)
| 製剤投与量 (セフジニルとして) | 判定パラメータ | 参考パラメータ | |||
| AUC0-12 (ng・h/mL) | Cmax (ng/mL) | Tmax (h) | t1/2 (h) | ||
| セフジニル細粒小児用10%「トーワ」 | 1g (100mg(力価)) | 6499±1663 | 1262±368 | 3.5±0.7 | 1.52±0.04 |
| セフゾン細粒小児用10% | 1g (100mg(力価)) | 6222±1412 | 1211±284 | 3.4±1.0 | 1.50±0.19 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.6 特定の背景を有する患者
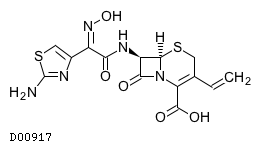
19. 有効成分に関する理化学的知見
19.1. セフジニル
20. 取扱い上の注意
20.1 バラ包装は開栓後、光、湿気を避けて保存すること。
20.2 分包品はアルミピロー包装開封後、光、湿気を避けて保存すること。
22. 包装
0.5g×120包[分包、乾燥剤入り]
100g[バラ、乾燥剤入り]
23. 主要文献
- 厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
- 陶 易王 他, 医学と薬学, 61 (4), 593-602, (2009)
- 西谷嘉夫 他, 日本化学療法学会雑誌, 37 (S-2), 823-840, (1989)
24. 文献請求先及び問い合わせ先
文献請求先
東和薬品株式会社
学術部DIセンター
〒570-0081
大阪府守口市日吉町2丁目5番15号
電話:0120-108-932
FAX:06-7177-7379
製品情報問い合わせ先
東和薬品株式会社
学術部DIセンター
〒570-0081
大阪府守口市日吉町2丁目5番15号
電話:0120-108-932
FAX:06-7177-7379
26. 製造販売業者等
26.1 製造販売元
東和薬品株式会社
大阪府門真市新橋町2番11号