医薬品情報
| 総称名 | アレサガ |
|---|---|
| 一般名 | エメダスチンフマル酸塩 |
| 欧文一般名 | Emedastine Fumarate |
| 製剤名 | エメダスチンフマル酸塩経皮吸収型製剤 |
| 薬効分類名 | 経皮吸収型 アレルギー性鼻炎治療剤 |
| 薬効分類番号 | 4490 |
| ATCコード | S01GX06 |
| KEGG DRUG |
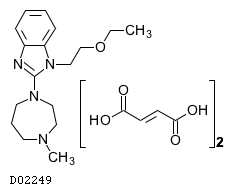
D02249
エメダスチンフマル酸塩
|
| KEGG DGROUP |
DG01482
ヒスタミンH1受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年5月 改訂(再審査結果)(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 12.臨床検査結果に及ぼす影響 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アレサガテープ4mg | ALLESAGA Tapes 4mg | 久光製薬 | 4490700S1029 | 53.8円/枚 | 処方箋医薬品注) |
| アレサガテープ8mg | ALLESAGA Tapes 8mg | 久光製薬 | 4490700S2025 | 72.1円/枚 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、成人にはエメダスチンフマル酸塩として1回4mgを胸部、上腕部、背部又は腹部のいずれかに貼付し、24時間毎に貼り替える。なお、症状に応じて1回8mgに増量できる。
8. 重要な基本的注意
8.1 眠気を催すことがあるので、本剤使用中の患者には自動車の運転等危険を伴う機械の操作には従事させないよう十分注意すること。更に、日常生活に支障がみられる場合があるので、本剤使用に際してはこのことを患者に十分説明しておくこと。
8.2 本剤4mg使用時と比べ、本剤8mg使用時には眠気の発現率が高い傾向があるため、眠気等の発現に特に注意すること。
8.3 季節性の患者に使用する場合は、好発季節を考えて、その直前から使用を開始し、好発季節終了時まで続けることが望ましい。
8.4 効果が認められない場合には、漫然と長期にわたり使用しないように注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 長期ステロイド療法を受けている患者
ステロイドの減量を図る場合には十分な管理下で徐々に行うこと。
9.3 肝機能障害患者
肝機能異常があらわれるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に、生理機能が低下している。
10. 相互作用
10.2 併用注意
| 向精神薬 鎮静剤 催眠剤等 抗ヒスタミン剤 | 相互に作用を増強するおそれがある。 | 本剤の中枢神経抑制作用により、作用が増強されると考えられる。 |
| アルコール | 本剤の中枢神経系での副作用(主に眠気)を増強するおそれがある。 | 本剤の中枢神経抑制作用により、作用が増強されると考えられる。 |
11. 副作用
11.2 その他の副作用
| 5%以上 | 0.1%以上5%未満 | 頻度不明 | |
| 皮膚 | 適用部位紅斑 | 適用部位そう痒感、適用部位丘疹、適用部位色素沈着、適用部位発疹 | 適用部位皮膚炎 |
| 精神神経 | 眠気 | 脱力感、頭痛・頭重感、頭がボーッとする、ふらつき | |
| 肝臓 | ALT上昇、AST上昇 | LDH上昇、γ-GTP上昇 | |
| 泌尿器・腎臓 | 血中尿酸増加 | ||
| 血液 | 好中球減少、リンパ球増加 | ||
| 消化器 | 口渇 | 腹痛 | |
| その他 | 倦怠感、血中コレステロール増加、鼻乾燥 |
12. 臨床検査結果に及ぼす影響
本剤はアレルゲン皮内反応を抑制するため、アレルゲン皮内反応検査を実施する前は本剤を使用しないこと。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 使用するまでは包装袋を開封せず、開封後は速やかに貼付すること。
14.1.2 使用する際には、ライナーを剥がして使用すること。
14.1.3 1日毎に貼り替えるため、貼付開始時刻の設定にあたっては入浴等の時間を考慮することが望ましい。
14.2 薬剤投与時の注意
14.2.1 創傷面又は湿疹・皮膚炎等がみられる部位は避けて貼付すること。
14.2.2 貼付部位の皮膚を拭い、清潔にしてから本剤を貼付すること。また、貼付部位の水分は十分に取り除くこと。
14.2.3 貼付による皮膚刺激を避けるため、貼付箇所を毎回変更すること。
14.3 薬剤投与中の注意
途中ではがれ落ちた場合は、直ちに新たな本剤を貼付すること。また、次の貼り替え予定時間には新たな本剤に貼り替えること。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性12例に本剤(エメダスチンフマル酸塩として1.5、3、6、12及び24mg)注)を胸部に24時間単回投与したとき、血漿中エメダスチンの薬物動態パラメータ(Cmax、AUC0-t及びAUC0-∞)は、1.5〜24mgにおいて線形性が確認された1)。
血漿中エメダスチン濃度推移(平均値+標準偏差、12例)
| 投与量 (例数) | Cmax(ng/mL) | AUC0-t(ng・hr/mL) | AUC0-∞(ng・hr/mL) | tmaxa)(hr) | t1/2(hr) |
| 1.5mg (12) | 0.320±0.112 | 8.48±3.03 | 9.15±2.97 | 26 | 11.7±3.19 |
| 3mg (12) | 0.642±0.235 | 18.4±5.44 | 19.3±5.41 | 16,26 | 13.2±2.00 |
| 6mg (12) | 1.59±0.567 | 43.8±13.2 | 46.2±13.1 | 26 | 13.8±2.29 |
| 12mg (12) | 3.09±1.01 | 86.4±25.3 | 90.5±24.9 | 16 | 13.0±2.47 |
| 24mg (12) | 5.43±1.89 | 156±53.3 | 164±52.7 | 26 | 13.0±2.84 |
16.1.2 反復投与
季節性アレルギー性鼻炎患者に本剤(エメダスチンフマル酸塩として4、8及び12mg注))を胸部に1日1回14日間反復投与したとき、血漿中エメダスチンの薬物動態パラメータ(Cmax及びAUC0-24)は、4〜12mg間で投与量にほぼ比例して増加することが確認された。また、血漿中エメダスチン濃度は投与後7日目までに定常状態に到達した2)。
| 投与量 (例数) | Cmax(ng/mL) | AUC0-24(ng・hr/mL) | tmaxa)(hr) | t1/2(hr) | |
| 1日目 | 4mg (23) | 1.16±0.419 | 16.3±7.54 | 20 | − |
| 8mg (24) | 2.32±0.832 | 31.7±14.9 | 20 | − | |
| 12mg (24) | 2.94±1.49 | 38.8±24.1 | 20 | − | |
| 7日目 | 4mg (22) | 1.80±0.579 | 36.0±10.9 | 16 | − |
| 8mg (24) | 3.98±1.18 | 79.5±23.8 | 12 | − | |
| 12mg (24) | 5.49±2.62 | 112±57.1 | 16 | − | |
| 14日目 | 4mg (21) | 2.03±0.641 | 40.6±12.3 | 12,16 | 15.5±2.36 |
| 8mg (24) | 4.42±1.40 | 88.8±30.3 | 12,16 | 15.5±1.59 | |
| 12mg (24) | 6.28±2.86 | 128±62.1 | 12 | 16.2±2.83 |
16.2 吸収
16.2.1 単回投与
健康成人男性20例に本剤(エメダスチンフマル酸塩として8mg)を胸部、上腕部、背部、腹部又は腰部に24時間単回投与したとき、投与部位間におけるAUC0-tの幾何平均値の比の推定値は、胸部に対して上腕部で0.930、背部で1.000、腹部で0.923、腰部で0.740であった。腰部へ投与したときのAUC0-tは、胸部、上腕部、背部及び腹部へ投与したときよりも低かった3)。
16.3 分布
16.3.1 組織分布
16.3.2 胎児・乳汁移行
[14C]エメダスチンフマル酸塩を妊娠ラットに単回経口投与したとき、胎児中へ放射能の移行が認められた。また、授乳期ラットにおいては乳汁中への移行が認められた6)。
16.4 代謝
16.5 排泄
健康成人男性12例に本剤(エメダスチンフマル酸塩として1.5、3、6、12及び24mg)注)を胸部に24時間単回投与したとき、投与開始後0〜96時間のエメダスチン及びエメダスチンと代謝物(6-水酸化体、5-水酸化体及び各抱合体)の合計の累積尿中排泄率の平均値は2.9〜4.4%及び12.4〜15.9%であった1)。
注)本剤の承認された1回用量は4又は8mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(二重盲検比較試験)
季節性アレルギー性鼻炎患者を対象に本剤(エメダスチンフマル酸塩として4又は8mg)を1日1回2週間投与した結果、主要評価項目である鼻症状(くしゃみ発作、鼻汁、鼻閉)の合計スコアの変化量において、プラセボ群に対し有意な改善効果が認められた9)。
| 投与群 (例数) | 投与前値 | 最終評価時 | 変化量 | プラセボに対する差a) (95%CI) | |
| プラセボ群 (383) | 6.45±1.63 | 6.16±2.03 | −0.29±1.86 | − | − |
| 4mg群 (384) | 6.56±1.65 | 5.46±1.98 | −1.10±1.89 | −0.77 (−1.02〜−0.51) | p<0.0001b) |
| 8mg群 (380) | 6.47±1.61 | 5.12±2.13 | −1.35±1.98 | −1.05 (−1.30〜−0.80) | p<0.0001b) |
副作用発現頻度は本剤4mg群で11.2%(43/384例)、本剤8mg群で14.2%(54/381例)であった。主な副作用は、本剤4mg群で適用部位紅斑3.9%(15/384例)、傾眠3.4%(13/384例)、適用部位そう痒感2.3%(9/384例)等、本剤8mg群で適用部位紅斑5.0%(19/381例)、傾眠4.7%(18/381例)、適用部位そう痒感2.6%(10/381例)等であった。
17.1.2 国内第III相試験(長期投与試験)
通年性アレルギー性鼻炎患者を対象に本剤(エメダスチンフマル酸塩として4又は8mg)を1日1回、最長52週間投与した結果、主要評価項目である鼻症状(くしゃみ発作、鼻汁、鼻閉)の合計スコアの変化量において、投与開始後1週からスコアの低下が認められ、その後、52週までスコアの低下が維持した10)。
| 投与群 (例数) | 投与前値 | 最終評価時 | 変化量 |
| 4mg群 (124) | 6.45±1.81 | 3.86±1.99 | −2.59±1.93 |
| 8mg群 (123) | 6.35±1.58 | 3.88±1.84 | −2.47±1.99 |
副作用発現頻度は本剤4mg群で26.6%(33/124例)、本剤8mg群で23.6%(29/123例)であった。主な副作用は、本剤4mg群で適用部位紅斑16.9%(21/124例)、適用部位そう痒感11.3%(14/124例)、傾眠6.5%(8/124例)、色素沈着障害4.0%(5/124例)等、本剤8mg群で適用部位紅斑15.4%(19/123例)、傾眠10.6%(13/123例)、適用部位そう痒感9.8%(12/123例)等であった。
18. 薬効薬理
18.1 作用機序
18.2 抗ヒスタミン作用
18.3 ヒスタミン受容体に対する親和性
モルモット及びラット前脳を用いた結合試験において、エメダスチンフマル酸塩はヒスタミンH1受容体に高い親和性を示し、ヒスタミンH2及びH3受容体にはほとんど親和性を示さなかった16)(in vitro)。
18.4 ケミカルメディエーター遊離抑制作用
18.5 好酸球遊走抑制作用
エメダスチンフマル酸塩はロイコトリエンB4によるヒト好酸球の遊走を抑制した15)(in vitro)。
19. 有効成分に関する理化学的知見
19.1. エメダスチンフマル酸塩
22. 包装
<アレサガテープ4mg>
70枚[(1枚/1袋)×70袋]
<アレサガテープ8mg>
70枚[(1枚/1袋)×70袋]
23. 主要文献
- 久光製薬社内資料 第I相単回投与試験(2018年1月19日承認、CTD2.7.2.2.2.1)
- 久光製薬社内資料 第I/II相反復投与試験(2018年1月19日承認、CTD2.7.2.2.2.2)
- 久光製薬社内資料 第I相投与部位検討試験(2018年1月19日承認、CTD2.7.2.2.2.1)
- 久光製薬社内資料 ラット単回投与試験(2018年1月19日承認、CTD2.6.4.4.1)
- 久光製薬社内資料 ラット反復投与試験(2018年1月19日承認、CTD2.6.4.4.1)
- Sakai T,et al., 薬物動態, 2 (2), 147-54, (1987) »DOI
- 久光製薬社内資料 in vitro代謝試験(2018年1月19日承認、CTD2.6.4.5.3)
- 石田光裕 ほか, 基礎と臨床, 31 (10), 3089-93, (1997)
- 久光製薬社内資料 第III相比較試験(2018年1月19日承認、CTD2.7.3.2.2)
- 久光製薬社内資料 第III相長期投与試験(2018年1月19日承認、CTD2.7.3.2.3)
- 久光製薬社内資料 ラットヒスタミン誘発血管透過性亢進モデルを用いた薬効評価(2018年1月19日承認、CTD2.6.2.2)
- Fukuda T,et al., Arzneimittelforschung, 34 (7), 801-5, (1984) »PubMed
- Nishimura N,et al., Immunopharmacol Immunotoxicol, 9 (4), 511-21, (1987) »PubMed
- Saito T,et al., Jpn J Pharmacol, 62 (2), 137-43, (1993) »DOI
- 斉藤忠之 ほか, 西日本皮膚科, 55 (6), 1081-5, (1993) »DOI
- Sharif NA,et al., J Ocul Pharmacol, 10 (4), 653-64, (1994) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
久光製薬株式会社
お客様相談室 受付時間/9:00-17:50(土日・祝日・会社休日を除く)
〒135-6008
東京都江東区豊洲三丁目3番3号
電話:0120-381332
FAX:03-5293-1723
製品情報問い合わせ先
久光製薬株式会社
お客様相談室 受付時間/9:00-17:50(土日・祝日・会社休日を除く)
〒135-6008
東京都江東区豊洲三丁目3番3号
電話:0120-381332
FAX:03-5293-1723
26. 製造販売業者等
26.1 製造販売元
久光製薬株式会社
〒841-0017
鳥栖市田代大官町408番地