医薬品情報
| 総称名 | ナルフラフィン塩酸塩 |
|---|---|
| 一般名 | ナルフラフィン塩酸塩 |
| 欧文一般名 | Nalfurafine Hydrochloride |
| 製剤名 | ナルフラフィン塩酸塩カプセル |
| 薬効分類名 | 経口そう痒症改善剤 |
| 薬効分類番号 | 1190 |
| ATCコード | V03AX02 |
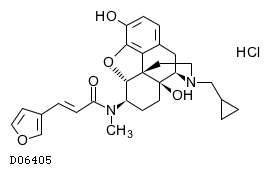
| KEGG DRUG |
D06405
ナルフラフィン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年11月 改訂(効能変更)(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ナルフラフィン塩酸塩カプセル2.5μg「トーワ」 (後発品) | NALFURAFINE HYDROCHLORIDE CAPSULES 2.5μg"TOWA" | シー・エイチ・オー新薬 | 1190015M1096 | 234.2円/カプセル | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
次の患者におけるそう痒症の改善(既存治療で効果不十分な場合に限る)
○透析患者
○慢性肝疾患患者
6. 用法及び用量
通常、成人には、ナルフラフィン塩酸塩として1日1回2.5μgを夕食後又は就寝前に経口投与する。なお、症状に応じて増量することができるが、1日1回5μgを限度とする。
7. 用法及び用量に関連する注意
<血液透析患者におけるそう痒症の改善の場合>
7.1 本剤の投与から血液透析開始までは十分な間隔をあけること。本剤は血液透析により除去されることから、本剤服用から血液透析までの時間が短い場合、本剤の血中濃度が低下する可能性がある。[16.8.1参照]
<腹膜透析患者におけるそう痒症の改善の場合>
7.2 本剤の投与から透析液交換までは十分な間隔をあけること。本剤服用から透析液交換までの時間が短い場合、本剤の血中濃度が低下する可能性がある。[16.1.1参照]
<慢性肝疾患患者におけるそう痒症の改善の場合>
7.3 本剤の投与は1日1回2.5μgから開始し、効果不十分な場合に1日1回5μgへの増量を検討すること。
8. 重要な基本的注意
8.1 重度(Child-Pugh分類グレードC)の肝障害のある患者に対する本剤の投与にあたっては、リスク・ベネフィットを勘案し、投与中は患者の状態を十分に観察すること。[9.3.1、16.1.1参照]
8.2 眠気、めまい等があらわれることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作には従事させないよう注意すること。
8.3 本剤の使用により効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
8.4 本剤の投与により、プロラクチン値上昇等の内分泌機能異常があらわれることがあるので、適宜検査を実施することが望ましい。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
<慢性肝疾患患者におけるそう痒症の改善の場合>
血中濃度が上昇するおそれがある。
9.3 肝機能障害患者
<効能共通>
9.3.1 重度(Child-Pugh分類グレードC)の肝障害のある患者
<透析患者におけるそう痒症の改善の場合>
9.3.2 中等度(Child-Pugh分類グレードB)の肝障害のある患者
血中濃度が上昇するおそれがある。[16.1.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。動物実験(ラット)において、胎盤通過、生存胎児数の減少、出産率の低下及び出生児体重の減少が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)において、乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に、生理機能が低下していることが多い。
10. 相互作用
相互作用序文
本剤は、主として肝代謝酵素CYP3A4によって代謝される。[16.4.1参照]
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| CYP3A4阻害作用のある薬剤等 アゾール系抗真菌剤(イトラコナゾール等)、ミデカマイシン、リトナビル、シクロスポリン、ニフェジピン、シメチジン、グレープフルーツジュース等 [16.7.1、16.7.2参照] | 本剤の血漿中濃度が上昇する可能性があるため、併用の開始、用量の変更並びに中止時には、患者の状態を十分に観察するなど注意すること。 | CYP3A4阻害作用のある薬剤等との併用により本剤の代謝が阻害され、血漿中濃度が上昇する可能性がある。 |
| 睡眠薬、抗不安薬、抗うつ薬、抗精神病薬、抗てんかん薬 | 本剤との併用により、不眠、幻覚、眠気、浮動性めまい、振戦、せん妄等が認められる可能性があるので、併用の開始、用量の変更並びに中止時には、副作用の発現に注意すること。 | 本剤による中枢性の副作用が増強される可能性がある。 |
| オピオイド系薬剤 | 本剤の作用が増強あるいは減弱されるおそれがある。 | 両剤の薬理学的な相互作用(増強又は拮抗)が考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、Al-P、γ-GTPの著しい上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 精神・神経系 | 不眠注1)、注2) | 眠気注1)、注2)、浮動性めまい、頭痛 | いらいら感、幻覚、構語障害、レストレスレッグス症候群、振戦、しびれ | 不穏、せん妄、易怒性 |
| 消化器系 | 便秘注1)、注2) | 口渇、悪心、下痢 | 嘔吐、食欲不振、腹部不快感、胃炎、口内炎 | |
| 皮膚 | そう痒の悪化、湿疹、発疹 | 蕁麻疹、紅斑、丘疹 | 色素沈着 | |
| 肝臓 | 総胆汁酸上昇 | AST上昇、ALT上昇、Al-P上昇、γ-GTP上昇、ビリルビン上昇 | LDH上昇 | |
| 腎臓 | 頻尿・夜間頻尿注2)、注3) | 多尿注3) | ||
| 循環器系 | 動悸、ほてり、血圧上昇 | |||
| 内分泌系 | プロラクチン上昇 | テストステロン低下、甲状腺刺激ホルモン低下、甲状腺刺激ホルモン上昇、抗利尿ホルモン上昇 | 女性化乳房 | |
| 血液 | 好酸球増多、貧血 | |||
| 尿 | 尿中血陽性注3)、尿中蛋白陽性注3) | |||
| その他 | 倦怠感 | 胸部不快感、脱力感、回転性めまい、異常感、浮腫、血中リン低下 |
13. 過量投与
13.1 症状
過量投与により、幻覚、不安、重度の眠気、不眠等があらわれるおそれがある。
13.2 処置
投与を中止し、必要に応じ適切な対症療法を行うこと。なお、本剤は血液透析により除去されることが示されている。[16.8.1参照]
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、さらには穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 動物実験(イヌ静脈内投与、0.1μg/kg以上)において全身麻酔下での血圧低下が報告されている。
15.2.2 動物実験(ラット筋肉内投与、40μg/kg/day以上)において受胎率の低下が報告されている。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1)血液透析患者(16例)にナルフラフィン塩酸塩(カプセル)2.5又は5μgを経口単回投与した時、未変化体の薬物動態パラメータは以下の通りであった1)。
| 投与群 (μg) | 例数 | Cmax (pg/mL) | Tmax (hr) | AUC0-∞ (pg・hr/mL) | t1/2 (hr) |
| 2.5 | 8 | 3.15±0.82 | 4.25±1.58 | 66.26±15.54※ | 14.21±4.93※ |
| 5 | 8 | 6.51±2.76 | 3.00±0.93 | 120.59±71.90 | 14.03±7.44 |
(2)腹膜透析患者(16例)にナルフラフィン塩酸塩(カプセル)2.5又は5μgを経口単回投与した時、未変化体の薬物動態パラメータは以下の通りであった。腹膜透析の方法(連続携行式腹膜透析(CAPD)、持続的周期的腹膜透析(CCPD))、自動腹膜潅流装置(APD)の有無及び透析液の種類により、未変化体の薬物動態パラメータに明らかな差異は認められなかった。なお、ナルフラフィン塩酸塩(カプセル)5μg投与群において、ナルフラフィン塩酸塩(カプセル)投与から初回の透析液交換までの時間が3時間と規定された5例のうち1例で、未変化体のCmax及びAUC0-∞がそれぞれ5.37pg/mL及び156.54pg・h/mLと低下する傾向が認められた2)。[7.2参照]
| 投与群 (μg) | 例数 | Cmax (pg/mL) | Tmax※ (hr) | AUC0-∞ (pg・hr/mL) | t1/2 (hr) |
| 2.5 | 5 | 3.81±0.88 | 1.00 | 92.67±23.47 | 20.99±4.22 |
| 5 | 11 | 8.28±3.00 | 2.00 | 193.74±57.52 | 24.77±3.23 |
(3)軽度(Child-Pugh分類グレードA)の代償性肝硬変患者(12例)にナルフラフィン塩酸塩(カプセル)2.5又は5μgを経口単回投与した時、未変化体の薬物動態パラメータは以下の通りであった。健康成人男子と比較してCmaxやAUCが上昇する傾向は認められなかった3)。
| 投与群 (μg) | 例数 | Cmax (pg/mL) | Tmax (hr) | AUC0-∞ (pg・hr/mL) | t1/2 (hr) |
| 2.5 | 6 | 3.63±1.26 | 2.33±1.03 | 34.58±13.55※ | 5.37±2.11※ |
| 5 | 6 | 6.76±2.03 | 1.50±0.55 | 58.06±26.28 | 6.61±2.46 |
(4)中等度(Child-Pugh分類グレードB)の慢性肝疾患患者(延べ30例)にナルフラフィン塩酸塩(カプセル)2.5又は5μgを経口単回投与した時、未変化体の薬物動態パラメータは以下の通りであった。軽度(Child-Pugh分類グレードA)の肝障害患者と比較してCmaxとAUCは上昇する傾向が認められた4)。[9.3.2参照]
| 投与群 (μg) | 例数 | Cmax (pg/mL) | Tmax (hr) | AUC0-∞ (pg・hr/mL) | t1/2 (hr) |
| 2.5 | 16 | 6.36±2.62 | 1.81±1.52 | 117.4±51.4 | 17.52±10.69 |
| 5 | 14 | 11.71±4.45 | 1.50±1.02 | 197.7±97.0 | 14.59±5.27 |
16.1.2 反復投与
血液透析患者(14〜16例)にナルフラフィン塩酸塩(カプセル)2.5又は5μgを経口反復投与した時、未変化体の薬物動態パラメータは以下の通りであった1)。
| 投与群 (μg) | 例数 | Cmax (pg/mL) | Tmax (hr) | AUC0-∞ (pg・hr/mL) | t1/2 (hr) |
| 2.5 | 7 | 5.70±3.85 | 4.14±1.35 | 210.25±144.28※ | 25.33±10.52※ |
| 5 | 7 | 10.25±1.74 | 3.86±1.21 | 358.86±179.24 | 28.34±8.55 |
また、透析時では非透析時と比較しt1/2が短縮しており、透析時及び非透析時のt1/2はそれぞれ、5.11〜11.17(hr)、13.55〜64.37(hr)であった。
16.1.3 生物学的同等性試験
ナルフラフィン塩酸塩カプセル2.5μg「トーワ」及びレミッチカプセル2.5μgを、クロスオーバー法によりそれぞれ1カプセル(ナルフラフィン塩酸塩として2.5μg)健康成人男性(n=20)に絶食単回経口投与して血漿中ナルフラフィン濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された5)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0→24 (pg・hr/mL) | Cmax (pg/mL) | Tmax (hr) | t1/2 (hr) | |
| ナルフラフィン塩酸塩カプセル2.5μg「トーワ」 | 21.29±3.93 | 2.02±0.45 | 3.2±1.1 | 9.5±1.7 |
| レミッチカプセル2.5μg | 22.76±4.88 | 2.30±0.60 | 2.7±0.8 | 9.2±2.4 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 食事の影響
健康成人男子(12例)を対象に、ナルフラフィン塩酸塩(カプセル)10μgを食後に経口単回投与した時のAUC0-48hr及びCmaxは空腹時投与の場合とほぼ同等であり、食事の影響は認められなかった6)。
(注1)通常1回投与量は2.5μgである。
(注2)開発段階の製剤での試験成績であるが、当該製剤はレミッチカプセルと溶出挙動の類似性から同等であると考えられている。
| 投与方法 | Cmax (pg/mL) | Tmax (hr) | AUC0-48hr (pg・hr/mL) | t1/2 (hr) |
| 空腹時投与 | 12.67±3.95 | 3.1±1.1 | 114.46±34.26 | 5.99±1.35 |
| 食後投与 | 13.68±3.65 | 3.2±1.3 | 126.03±38.10 | 5.90±1.10 |
16.3 分布
16.3.1 ヒト血漿タンパク結合率は、73.3〜76.3%であり、性差は認められなかった7)(in vitro)。
16.3.2 ラットに経口単回投与した後の全身オートラジオグラム及び組織中放射能濃度測定結果から、投与後15分に食道、肝臓、消化管及びその内容物に高い放射能の分布が認められた。また、投与後168時間では肝臓、腎臓、甲状腺及び腸内容物に放射能が認められた7)。
16.4 代謝
16.5 排泄
16.5.1 健康成人男子(6例)を対象に、トリチウムで標識したナルフラフィン塩酸塩を静脈内単回投与した時の薬物動態を検討したところ、投与後14日間での糞中排泄率は56.0%、尿中の排泄率は36.2%で、累積排泄率は92.2%となった。尿中では主に未変化体として、糞中では主に脱シクロプロピルメチル体として排泄された9)。主代謝物は脱シクロプロピルメチル体であり、その他にグルクロン酸抱合体が認められた(外国人データ)。
16.5.2 4種の透析膜を用いて透析による除去について検討したところ、未変化体の透析膜面積1.5m2換算クリアランスは44.6〜61.8mL/minと算出され、健康成人男子における未変化体の腎クリアランス170〜210mL/minと比較すると小さいものの、未変化体は膜種に関係なく透析により除去されるものと考えられた。また、代謝物(脱シクロプロピルメチル体及びグルクロン酸抱合体)についても膜種に関係なく除去されるものと考えられた7)。
16.7 薬物相互作用
16.7.1 ケトコナゾール(経口剤:国内未発売)との併用
健康成人男子(22例)を対象に、ナルフラフィン塩酸塩(液剤)10μgを単独で経口単回投与した時とケトコナゾールを反復投与で併用した時、AUC0-∞はケトコナゾールを併用することにより160.5%となり、ケトコナゾールはナルフラフィン塩酸塩の薬物動態に影響した10)(外国人データ)。[10.2参照]
(注)通常1回投与量は2.5μgである。
16.7.2 in vitro試験、代謝
16.7.3 ヒトP糖タンパク(MDR1)発現LLC-PK1細胞を用いたin vitro試験
16.7.4 非吸収性薬剤とのin vitro吸着試験
16.8 その他
17. 臨床成績
17.1 有効性及び安全性に関する試験
ナルフラフィン塩酸塩(カプセル)の成績を以下に示す。
<血液透析患者におけるそう痒症の改善の場合>
17.1.1 国内第III相試験
既存治療抵抗性のそう痒症を有する血液透析患者337例を対象に、1日1回、14日間経口反復投与した際の有効性を、かゆみの指標であるVAS(Visual Analogue Scale)を用い、多施設二重盲検比較試験により検討した。その結果、投与前後でのVAS変化量において、2.5μg及び5μg投与群で有効性が確認された16)17)。
| 例数 | 平均VAS値±標準偏差 | 共分散分析 (片側2.5%検定) | |||
| 投与前 (mm) | 投与後 (mm) | プラセボ群との差※ (mm) [95%信頼区間] | p値 | ||
| プラセボ群 | 111 | 73.78±11.47 | 58.55±22.06 | 9.13 [3.78,14.49] | p=0.0005 |
| 2.5μg投与群 | 112 | 76.71±11.79 | 52.19±23.71 | ||
| 例数 | 平均VAS値±標準偏差 | 共分散分析 (片側2.5%検定) | |||
| 投与前 (mm) | 投与後 (mm) | プラセボ群との差※ (mm) [95%信頼区間] | p値 | ||
| プラセボ群 | 111 | 73.78±11.47 | 58.55±22.06 | 8.26 [3.05,13.47] | p=0.0010 |
| 5μg投与群 | 114 | 73.03±11.54 | 49.63±22.30 | ||
副作用発現率は、2.5μg群で25.0%(28/112例)、5μg群で35.1%(40/114例)であった。主な副作用は、2.5μg群で不眠7.1%(8/112例)、眠気4.5%(5/112例)、便秘及びプロラクチン上昇2.7%(3/112例)、5μg群で不眠14.0%(16/114例)、便秘7.0%(8/114例)、眠気3.5%(4/114例)、そう痒の悪化、プロラクチン上昇及び甲状腺刺激ホルモン上昇2.6%(3/114例)であった。
17.1.2 国内第III相試験(長期投与試験)
既存治療抵抗性のそう痒症を有する血液透析患者211例を対象に、1日1回、ナルフラフィン塩酸塩5μgを52週間経口反復投与した際の有効性を、VASを用い、オープン試験により検討した。その結果、投与前後でのVAS変化量において、有効性が確認された18)。
| 投与前 | 2週目 | 4週目 | 12週目 | 24週目 | 36週目 | 52週目 | |
| 例数 | 211 | 208 | 198 | 184 | 163 | 155 | 145 |
| 平均VAS値±標準偏差 (mm) | 75.22±12.41 | 50.95±24.38 | 47.17±25.32 | 39.39±25.83 | 33.60±27.73 | 31.85±24.91 | 30.87±25.92 |
ナルフラフィン塩酸塩の依存性について、精神依存及び身体依存を示す症例は認められなかった。また耐性が211例中5例に認められている18)。
副作用発現率は、48.8%(103/211例)であった。主な副作用は、不眠症19.4%(41/211例)、便秘7.1%(15/211例)、プロラクチン上昇3.3%(7/211例)、眠気2.4%(5/211例)であった。
副作用発現率は、48.8%(103/211例)であった。主な副作用は、不眠症19.4%(41/211例)、便秘7.1%(15/211例)、プロラクチン上昇3.3%(7/211例)、眠気2.4%(5/211例)であった。
<腹膜透析患者におけるそう痒症の改善の場合>
17.1.3 国内第III相試験
既存治療抵抗性のそう痒症を有する腹膜透析患者37例を対象に、ナルフラフィン塩酸塩2.5μgを2週間、続いて5μgを2週間経口反復投与した際の有効性を、かゆみの指標であるVASを用い、非盲検非対照試験により検討した。その結果、2.5μg投与期間2週目(LOCF※)における投与前後でのVAS変化量の平均値は24.93mm(90%信頼区間:18.67, 31.19mm)であり、90%信頼区間の下限値は、事前に設定されたVAS変化量の閾値(15.24mm)を上回った19)。
※ LOCF:Last Observation Carried Forward
副作用発現率は、45.9%(17/37例)であった。主な副作用は、不眠及びプロラクチン上昇13.5%(5/37例)、眠気及びテストステロン低下8.1%(3/37例)、嘔吐5.4%(2/37例)であった。
<慢性肝疾患患者におけるそう痒症の改善の場合>
17.1.4 国内第III相試験
抗ヒスタミン薬又は抗アレルギー薬による治療が奏効しない難治性のそう痒症を有する慢性肝疾患患者※1317例を対象に、1日1回、12週間経口反復投与した際の有効性を、かゆみの指標であるVASを用い、多施設二重盲検比較試験により検討した。主要評価項目は、投与期間4週目(LOCF)のVAS変化量とした。その結果、投与前後でのVAS変化量において、2.5μg及び5μg投与群で有効性が確認された20)21)。
※1 原疾患が確定しており、肝臓の炎症が6ヵ月以上持続している又は画像診断により肝炎からさらに病態が進展した状態にあると判断された肝疾患患者
| 例数 | 平均VAS値±標準偏差 | 共分散分析 (片側2.5%検定) | |||
| 投与前 (mm) | 投与後 (mm) | プラセボ群との差※2 (mm) [95%信頼区間] | p値 | ||
| プラセボ群 | 103 | 77.26±10.50 | 58.02±24.11 | 9.31 [2.94,15.69] | p=0.0022 |
| 2.5μg投与群 | 105 | 77.30±11.04 | 48.74±25.27 | ||
| 例数 | 平均VAS値±標準偏差 | 共分散分析 (片側2.5%検定) | |||
| 投与前 (mm) | 投与後 (mm) | プラセボ群との差※2 (mm) [95%信頼区間] | p値 | ||
| プラセボ群 | 103 | 77.26±10.50 | 58.02±24.11 | 8.22※3 [1.88,14.55] | p=0.0056 |
| 5μg投与群 | 109 | 77.29±11.07 | 49.79±25.50※3 | ||
副作用発現率は、2.5μg群で60.0%(63/105例)、5μg群で54.1%(59/109例)であった。主な副作用は、2.5μg群でプロラクチン上昇13.3%(14/105例)、抗利尿ホルモン上昇及び総胆汁酸上昇7.6%(8/105例)、甲状腺刺激ホルモン上昇6.7%(7/105例)、不眠症、頻尿・夜間頻尿及び眠気5.7%(6/105例)、5μg群で、頻尿・夜間頻尿、便秘、眠気、プロラクチン上昇及び抗利尿ホルモン上昇7.3%(8/109例)、浮動性めまい5.5%(6/109例)であった。
17.1.5 国内第III相試験(長期投与試験)
抗ヒスタミン薬又は抗アレルギー薬による治療が奏効しない難治性のそう痒症を有する慢性肝疾患患者※122例を対象に、1日1回、ナルフラフィン塩酸塩5μgを52週間経口反復投与した際の有効性を、VASを用い、オープン試験により検討した。その結果、投与前後でのVAS変化量において有効性が確認された22)。
※ 原疾患が確定しており、肝臓の炎症が6ヵ月以上持続している又は画像診断により肝炎からさらに病態が進展した状態にあると判断された肝疾患患者
| 投与前 | 2週目 | 4週目 | 12週目 | 24週目 | 36週目 | 52週目 | |
| 例数 | 122 | 122 | 121 | 116 | 110 | 103 | 99 |
| 平均VAS値±標準偏差 (mm) | 78.05±11.73 | 56.70±24.57 | 50.09±26.94 | 42.88±28.61 | 37.67±27.23 | 31.31±25.43 | 27.77±24.73 |
ナルフラフィン塩酸塩の依存性について、精神依存を示す症例は認められなかった。また、122例中、身体依存が1例、耐性が4例に認められている22)。
副作用発現率は、75.4%(92/122例)であった。主な副作用は、頻尿・夜間頻尿13.1%(16/122例)、プロラクチン上昇11.5%(14/122例)、便秘10.7%(13/122例)、浮動性めまい7.4%(9/122例)、抗利尿ホルモン上昇6.6%(8/122例)、総胆汁酸上昇5.7%(7/122例)であった。
副作用発現率は、75.4%(92/122例)であった。主な副作用は、頻尿・夜間頻尿13.1%(16/122例)、プロラクチン上昇11.5%(14/122例)、便秘10.7%(13/122例)、浮動性めまい7.4%(9/122例)、抗利尿ホルモン上昇6.6%(8/122例)、総胆汁酸上昇5.7%(7/122例)であった。
18. 薬効薬理
18.1 作用機序
ヒトオピオイド受容体発現細胞を用いたin vitroの受容体結合試験及び受容体作動性試験の結果から、選択的なオピオイドκ受容体作動薬であることが示されている23)。
| 試験項目 | κ | μ | δ | κ:μ:δ比 |
| 結合試験 Ki値(nmol/L) | 0.244±0.0256 | 2.21±0.214 | 484±59.6 | 1:9:1984 |
| 作動性試験 EC50(nmol/L) | 0.00816±0.00138 | 1.66±0.09 | 21.3±1.0 | 1:203:2610 |
18.2 そう痒に対する作用
18.3 依存性
19. 有効成分に関する理化学的知見
19.1. ナルフラフィン塩酸塩
20. 取扱い上の注意
未使用の場合はアルミピロー包装のまま保存し、開封後は遮光保存すること。また、服用時にPTPシートから取り出すこと。
22. 包装
14カプセル[14カプセル×1;PTP]
140カプセル[14カプセル×10;PTP]
23. 主要文献
- 血液透析患者における薬物動態の検討(レミッチカプセル:2009年1月21日承認、申請資料概要2.7.6)
- 腹膜透析患者における薬物動態の検討(レミッチカプセル/OD錠/ノピコールカプセル:2017年9月22日承認、審査報告書)
- 代償性肝硬変患者における薬物動態の検討(ノピコールカプセル:2014年12月26日承認、申請資料概要2.7.6.7)
- Child-Pugh分類グレードBの肝硬変患者における薬物動態の検討(ノピコールカプセル:2014年12月26日承認、申請資料概要2.7.6.8)
- 社内資料:生物学的同等性試験
- 健康成人における食事の影響の検討(レミッチカプセル:2009年1月21日承認、申請資料概要2.7.6)
- 中尾薫 他, 日本薬理学雑誌, 135 (5), 205-214, (2010) »PubMed
- Ando, A.et al., Biopharm.Drug Dispos., 33 (5), 257-264, (2012) »PubMed
- 健康成人における吸収、代謝、排泄の検討(レミッチカプセル:2009年1月21日承認、申請資料概要2.7.6)
- 健康成人における薬物相互作用の検討(レミッチカプセル:2009年1月21日承認、申請資料概要2.7.6)
- 薬物相互作用の検討(レミッチカプセル:2009年1月21日承認、申請資料概要2.6.4.7)
- ヒトP糖タンパク(MDR1)発現LLC-PK1細胞を用いたin vitro試験(ノピコールカプセル:2014年12月26日承認、申請資料概要2.6.4.7)
- 非吸収性薬剤(吸着剤)との薬物相互作用の検討(ノピコールカプセル:2014年12月26日承認、申請資料概要2.6.4.7)
- 非吸収性薬剤(吸着剤)との薬物相互作用の検討(2)(レミッチカプセル/OD錠/ノピコールカプセル:2017年9月22日承認、審査報告書)
- 血液透析の影響(レミッチカプセル:2009年1月21日承認、審査報告書)
- 血液透析患者におけるそう痒症に対する効果の検討(検証的試験)(レミッチカプセル:2009年1月21日承認、申請資料概要2.7.6)
- 血液透析患者におけるそう痒症に対する効果の検討(検証的試験)(2)(レミッチカプセル:2009年1月21日承認、審査報告書)
- 血液透析患者におけるそう痒症に対する効果の検討(長期投与試験)(レミッチカプセル:2009年1月21日承認、申請資料概要2.7.6)
- 腹膜透析患者におけるそう痒症に対する効果の検討(一般臨床試験)(レミッチカプセル/OD錠/ノピコールカプセル:2017年9月22日承認、審査報告書)
- 慢性肝疾患患者におけるそう痒症に対する効果の検討(検証的試験)(ノピコールカプセル:2014年12月26日承認、審査報告書)
- 慢性肝疾患患者におけるそう痒症に対する効果の検討(検証的試験)(2)(ノピコールカプセル:2014年12月26日承認、申請資料概要2.7.6.13)
- 慢性肝疾患患者におけるそう痒症に対する効果の検討(長期投与試験)(ノピコールカプセル:2014年12月26日承認、申請資料概要2.7.6.14)
- 中尾薫 他, 日本神経精神薬理学雑誌, 28 (2), 75-83, (2008) »PubMed
- 各種受容体、トランスポーターおよびイオンチャネルに対する結合試験(ノピコールカプセル:2014年12月26日承認、申請資料概要2.6.2.2)
- Umeuchi, H.et al., Eur.J.Pharmacol., 477 (1), 29-35, (2003) »PubMed
- Togashi, Y.et al., Eur.J.Pharmacol., 435 (2-3), 259-264, (2002) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
東和薬品株式会社
学術部DIセンター
〒570-0081
大阪府守口市日吉町2丁目5番15号
電話:0120-108-932
FAX:06-7177-7379
製品情報問い合わせ先
東和薬品株式会社
学術部DIセンター
〒570-0081
大阪府守口市日吉町2丁目5番15号
電話:0120-108-932
FAX:06-7177-7379
26. 製造販売業者等
26.1 製造販売元
シー・エイチ・オー新薬株式会社
徳島市国府町府中439番地
26.2 発売
東和薬品株式会社
大阪府門真市新橋町2番11号