医薬品情報
| 総称名 | ドボベット |
|---|---|
| 一般名 | カルシポトリオール水和物 ベタメタゾンジプロピオン酸エステル |
| 欧文一般名 | Calcipotriol Hydrate Betamethasone Dipropionate |
| 製剤名 | カルシポトリオール水和物/ベタメタゾンジプロピオン酸エステル配合剤 |
| 薬効分類名 | 尋常性乾癬治療剤 |
| 薬効分類番号 | 2699 |
| ATCコード | D05AX52 |
| KEGG DRUG |
D10534
カルシポトリオール・ベタメタゾンジプロピオン酸エステル
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年12月 改訂(第3版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ドボベットゲル | Dovobet Gel | レオファーマ | 2699802Q1026 | 154.1円/g | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対して過敏症のある患者
2.2 細菌・真菌・スピロヘータ・ウイルス皮膚感染症及び動物性皮膚疾患(疥癬、けじらみ等)[これらの疾患が増悪するおそれがある。]
2.3 潰瘍(ベーチェット病は除く)、第2度深在性以上の熱傷・凍傷[皮膚の再生が抑制され、治癒が遅延するおそれがある。]
4. 効能または効果
6. 用法及び用量
通常、1日1回、患部に適量塗布する。
7. 用法及び用量に関連する注意
7.1 1週間に90gを超える使用は行わないこと。
7.2 本剤による治療にあたっては経過を十分に観察した上で、使用開始後4週間を目安に本剤の必要性を検討し、漫然と使用を継続しないこと。[17.1.1参照]
8. 重要な基本的注意
8.1 本剤はカルシポトリオール水和物とベタメタゾンジプロピオン酸エステルの配合剤であり、カルシポトリオールとベタメタゾンジプロピオン酸エステル双方の副作用が発現するおそれがあるため、本剤の適切な使用を検討すること。
8.2 本剤は活性型ビタミンD3を含有しており、血清カルシウム値が上昇する可能性がある。また、高カルシウム血症に伴い、腎機能が低下する可能性があるので、本剤の使用に際しては血清カルシウム及び腎機能(クレアチニン、BUN等)の検査を定期的(開始2〜4週後に1回、その後は適宜)に行うこと。なおこれらの値に異常が認められた場合には正常域に戻るまで使用を中止すること。[11.1.1、11.1.2参照]
8.4 皮膚萎縮、ステロイド潮紅等の局所的副作用が発現しやすいので、特に頸、陰部、間擦部位の皮疹への使用には、症状の程度を十分考慮すること。
8.5 本剤は副腎皮質ホルモンを含有しており、同一病変に対する他の副腎皮質ホルモン剤との併用は避けること。大量または長期にわたる広範囲の使用〔特に密封療法(ODT)〕により、副腎皮質ホルモン剤を全身投与した場合と同様な症状があらわれることがあるので、特別な場合を除き長期大量使用やODTを極力避けること。
8.6 本剤はカルシポトリオールを含有しており、ODTにおける安全性は確立していない。(皮膚刺激があらわれやすい。また、単純塗布に比べて皮膚からの吸収が助長され、全身性の副作用が発現しやすくなるおそれがある。)
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 高カルシウム血症及びそのおそれのある患者
血清カルシウム値を上昇させる可能性がある。
9.2 腎機能障害患者
血清カルシウム値を上昇させる可能性がある。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。カルシポトリオールは動物試験(ラット)で乳汁へ移行することが認められている2)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
使用が過度にならないように注意すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| ビタミンD及びその誘導体 アルファカルシドール、カルシトリオール、タカルシトール、マキサカルシトール等 | 高カルシウム血症があらわれるおそれがある。 | 相加作用 |
| シクロスポリン | 高カルシウム血症があらわれるおそれがある。 | 本剤による血清カルシウム値の上昇が、シクロスポリンによる腎機能の低下によりあらわれやすくなる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 高カルシウム血症(頻度不明)
11.1.2 急性腎障害(頻度不明)
血清カルシウムの上昇を伴った急性腎障害があらわれることがある。血清クレアチニン上昇、BUN上昇等の異常が認められた場合には使用を中止し、適切な処置を行うこと。[8.2参照]
11.2 その他の副作用
| 0.5%以上 | 0.5%未満 | 頻度不明 | |
| 過敏症 | 紅斑・発赤 | ||
| 皮膚 | 疼痛、乾癬の悪化 | そう痒、発疹、灼熱感、刺激感、皮膚炎、魚鱗癬様皮膚変化、皮膚乾燥、皮膚びらん、接触性皮膚炎、落屑、皮疹、腫脹 | |
| 皮膚の感染症注1) | 毛包炎 | 細菌感染症(伝染性膿痂疹、せつ等)、真菌症(カンジダ症、白癬等)、ウイルス感染症 | |
| その他の皮膚症状注2) | 膿疱性発疹、色素脱失 | 色素沈着、膿疱性乾癬、ざ瘡様発疹、酒さ様皮膚炎、ステロイド皮膚(皮膚萎縮、毛細血管拡張、紫斑)、多毛 | |
| 肝臓 | 肝機能異常 | AST、ALT、γ-GTP、LDH、ALP、総ビリルビンの上昇 | |
| 腎臓 | BUN、血清クレアチニンの上昇、尿中クレアチニン上昇 | ||
| 血液 | 白血球増加症、貧血 | 白血球減少・増多、ヘモグロビン減少、リンパ球減少、単球増多、好中球減少 | |
| 感染症 | 単純ヘルペス | ||
| 下垂体・副腎皮質系 | 下垂体・副腎皮質系機能の抑制注3) | ||
| その他 | 末梢性浮腫、挫傷、尿中ブドウ糖陽性、血清カルシウム上昇 | 尿中カルシウム上昇、血清リン上昇・低下、尿中リン低下、血清1α,25(OH)2D3上昇・低下、乾癬のリバウンド |
13. 過量投与
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 誤用(内服等)防止のため、薬剤の保管に十分注意させること。特に、小児の手のとどかない所に保存させること。万一、誤って内服した場合には、高カルシウム血症等の全身性の副作用があらわれることがあるので、医療機関を受診する等、適切な処置をとるよう指導すること。[11.1.1参照]
14.1.2 低温では有効成分が析出する可能性があるので、冷蔵庫等の低温の場所を避けて保存させること。
14.2 薬剤使用時の注意
14.2.1 使用部位
(1)顔面の皮疹及び粘膜には使用しないこと。
(2)眼科用として使用しないこと。
(3)患部以外には使用しないこと。
14.2.2 使用時
(1)本剤は振ってから使用すること。
(2)本剤に触れた手で、顔面、傷口等に触れないように注意すること。
(3)目に入らないように注意すること。
14.2.3 使用後
(1)本剤使用後、顔面等への付着を避けるため、よく手を洗うこと。
(2)使用直後のシャワーや入浴は避けること。
15. その他の注意
15.1 臨床使用に基づく情報
本剤による治療中あるいは治療中止後、乾癬性紅皮症、膿疱性乾癬等がみられたとの報告がある。
15.2 非臨床試験に基づく情報
雌雄アルビノ無毛マウスを用いて40週間にわたり光線(キセノンランプ)照射しカルシポトリオール液剤を塗布した実験で、雄において皮膚腫瘍誘発に必要な光線照射時間の有意な短縮が認められたとの報告がある。しかし、同液剤をマウスに単独で塗布した実験では皮膚腫瘍誘発は認められていない。
16. 薬物動態
16.1 血中濃度
<ドボベット軟膏>
13例の日本人重度尋常性乾癬患者に軟膏を1日1回、4週間塗布した試験で、血漿中カルシポトリオール濃度及びベタメタゾンジプロピオン酸エステル濃度は、ほとんどの被験者が定量下限値(それぞれ50.0pg/mL及び30.0pg/mL)未満であった。血漿中カルシポトリオール濃度が定量された被験者2例でのCmaxは56.1及び159pg/mL、AUClastは28.1及び311h・pg/mLであった。血漿中ベタメタゾンジプロピオン酸エステル濃度が定量された被験者1例でのCmaxは39.6pg/mL、AUClastは41.24h・pg/mLであった7)。
カルシポトリオールの主要代謝物の血漿中濃度は、各測定時で1〜3例で定量された。各血漿中濃度が定量された被験者におけるCmaxは26.4〜151pg/mLであり、AUClastは27.9〜736h・pg/mLであった。ベタメタゾンジプロピオン酸エステルの主要代謝物の血漿中濃度は、各測定時で5〜11例で定量された。各血漿中濃度が定量された被験者におけるCmaxは30.3〜910pg/mLであり、AUClastは15.91〜4732h・pg/mLであった7)。
カルシポトリオールの主要代謝物の血漿中濃度は、各測定時で1〜3例で定量された。各血漿中濃度が定量された被験者におけるCmaxは26.4〜151pg/mLであり、AUClastは27.9〜736h・pg/mLであった。ベタメタゾンジプロピオン酸エステルの主要代謝物の血漿中濃度は、各測定時で5〜11例で定量された。各血漿中濃度が定量された被験者におけるCmaxは30.3〜910pg/mLであり、AUClastは15.91〜4732h・pg/mLであった7)。
16.2 吸収
16.2.1 角層中薬物量
日本人健康成人男性16例の腕部に、ゲル及び軟膏を塗布した試験で、塗布24時間後の角層中カルシポトリオール量びベタメタゾンジプロピオン酸エステル量は、ゲルでそれぞれ7.0ng、63.0ng、軟膏でそれぞれ8.6ng、69.8ngであった8)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
<ドボベットゲル>
日本人尋常性乾癬患者を対象に実施したゲルと軟膏の非盲検比較試験において、4週終了時における標的病変の全般改善度(「略治」または「中等度改善」以上)は下記のとおりであった9)。
| 全般改善度 | ||
| ゲル投与群 | 軟膏投与群 | |
| 頭皮 | 97.9%(92/94) | 96.0%(96/100) |
| 頭皮以外 | 80.9%(76/94) | 95.0%(95/100) |
副作用発現頻度はゲル投与群及び軟膏投与群でそれぞれ5.9%(6/101例)及び1.9%(2/105例)であった。ゲル投与群での副作用の内訳は毛包炎及び尿中ブドウ糖陽性各2.0%(2/101例)、貧血及び白血球増加症各1.0%(1/101例)であった。軟膏投与群での副作用の内訳は毛包炎及び貧血各1.0%(1/100例)であった。
<ドボベット軟膏(承認時)>
日本人尋常性乾癬患者を対象に、カルシポトリオール製剤(1日2回塗布)及びベタメタゾンジプロピオン酸エステル製剤(1日1回塗布)を対照薬として実施した二重盲検比較試験において、ベースラインから塗布終了時(4週時)のPASI(Psoriasis Area and Severity Index)変法の平均変化率は下表のとおりであり、軟膏の1日1回塗布と対照薬との間に有意差が認められた10)。
| カルシポトリオール水和物/ベタメタゾンジプロピオン酸エステル製剤群 (226例) | カルシポトリオール製剤群 (227例) | ベタメタゾンジプロピオン酸エステル製剤群 (223例) | |
| ベースラインから塗布終了時(4週時)のPASI変法の平均変化率(±SD) | −64.3%(24.7) | −50.5%(32.1) | −53.6%(26.4) |
カルシポトリオール水和物/ベタメタゾンジプロピオン酸エステル製剤群での副作用発現頻度は4.0%(9/226例)で、副作用の内訳は毛包炎0.9%(2/226例)、末梢性浮腫、肝機能異常、単純ヘルペス、膿疱性皮疹、挫傷、乾癬、皮膚色素脱失各0.4%(1/226例)であった。[7.2参照]
18. 薬効薬理
18.1 作用機序
18.2 併用作用
カルシポトリオールとベタメタゾンジプロピオン酸エステルの両剤併用により、ヒト1型ヘルパーT細胞(Th1)及びIL-17産生性ヘルパーT細胞(Th17)の分化及び活性化を有意に抑制した。また、そのTh1/Th17細胞の分化及び活性化に対する抑制作用はカルシポトリオールまたはベタメタゾンジプロピオン酸エステル単独投与と比較して有意に強かった20)。
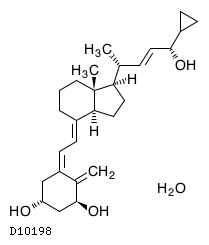
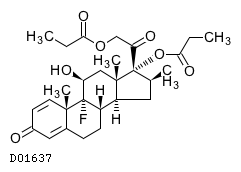
19. 有効成分に関する理化学的知見
19.1. カルシポトリオール水和物
19.2. ベタメタゾンジプロピオン酸エステル
22. 包装
15g[1本]、30g[1本]
23. 主要文献
- Russell,S.et al., Br J Dermatol., 130 (6), 795-796, (1994) »PubMed
- 富田正俊ほか, 薬物動態, 11 (1), 57-80, (1996) »DOI
- 長谷川靖彦ほか, 応用薬理, 8 (6), 705-720, (1974)
- 長谷川靖彦ほか, 基礎と臨床, 11 (6), 1672-1682, (1977)
- Dwyer,C.et al., Lancet., 338 (8769), 764-765, (1991) »PubMed
- Cunliffe,W.J.et al., J Am Acad Dermatol., 26 (5), 736-743, (1992)
- レオファーマ社内資料:薬物動態試験
- レオファーマ社内資料:角層中薬物量
- レオファーマ社内資料:非盲検比較試験
- レオファーマ社内資料:二重盲検比較試験
- Binderup L.et al., Biochem Pharmacol., 37 (5), 889-895, (1988)
- Kragballe K.et al., Arch Dermatol Res., 282 (3), 164-167, (1990)
- Kobayashi T.et al., J Eur Acad Dermatol Venereol., 5 (2), 132-138, (1995)
- Peric M et al., PLoS One., 4, e6340, (2009)
- Hegyi Z et al., J Invest Dermatol., 132, 1416-1424, (2012)
- Ahluwalia A., Mediators Inflamm., 7 (3), 183-193, (1998) »PubMed
- Umland SP.et al., J Allergy Clin Immunol., 100 (4), 511-519, (1997)
- Lange K.et al., Skin Pharmacol Appl Skin Physiol., 13 (2), 93-103, (2000)
- de Jong EC.et al., J Leukoc Biol., 66 (2), 201-204, (1999)
- レオファーマ社内資料:薬効薬理試験
24. 文献請求先及び問い合わせ先
文献請求先
レオファーマ株式会社
カスタマーコールセンター
〒101-0051
東京都千代田区神田神保町1-105
電話:0120-89-0056
製品情報問い合わせ先
レオファーマ株式会社
カスタマーコールセンター
〒101-0051
東京都千代田区神田神保町1-105
電話:0120-89-0056
26. 製造販売業者等
26.1 製造販売元
レオファーマ株式会社
東京都千代田区神田神保町1-105