医薬品情報
| 総称名 | チアトン |
|---|---|
| 一般名 | チキジウム臭化物 |
| 欧文一般名 | Tiquizium Bromide |
| 製剤名 | チキジウム臭化物カプセル |
| 薬効分類名 | キノリジジン系抗ムスカリン剤 |
| 薬効分類番号 | 1231 |
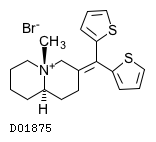
| KEGG DRUG |
D01875
チキジウム臭化物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年7月 改訂(第3版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| チアトンカプセル5mg | Thiaton Capsules | ヴィアトリス製薬 | 1231013M1040 | 6.1円/カプセル | |
| チアトンカプセル10mg | Thiaton Capsules | ヴィアトリス製薬 | 1231013M2179 | 8.6円/カプセル |
2. 禁忌
次の患者には投与しないこと
2.1 閉塞隅角緑内障の患者[抗コリン作用により眼圧が上昇し、症状を悪化させることがある。]
2.2 前立腺肥大による排尿障害のある患者[膀胱平滑筋の弛緩、膀胱括約筋の緊張により排尿困難を悪化させるおそれがある。]
2.3 重篤な心疾患のある患者[心拍数を増加させ、心臓に過負荷をかけるおそれがある。]
2.4 麻痺性イレウスの患者[消化管運動を抑制し、症状を悪化させるおそれがある。]
2.5 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
チキジウム臭化物として、通常成人1回5〜10mgを1日3回経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
羞明等を起こすことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に注意させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 前立腺肥大のある患者(ただし前立腺肥大による排尿障害のある患者を除く)
膀胱平滑筋の弛緩、膀胱括約筋の緊張により排尿困難を悪化させるおそれがある。[9.8参照]
9.1.2 甲状腺機能亢進症の患者
心悸亢進等の症状を悪化させるおそれがある。
9.1.3 うっ血性心不全のある患者(ただし重篤な心疾患のある患者を除く)
心拍数を増加させ、心臓に過負荷をかけるおそれがある。
9.1.4 不整脈のある患者(ただし重篤な心疾患のある患者を除く)
心拍数を増加させ、心臓に過負荷をかけるおそれがある。
9.1.5 潰瘍性大腸炎の患者
中毒性巨大結腸があらわれることがある。
9.1.6 高温環境にある患者
汗腺分泌を抑制し、体温調節を障害するおそれがある。
9.1.7 開放隅角緑内障の患者
抗コリン作用により眼圧が上昇し、症状を悪化させることがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続及び中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に前立腺肥大を伴っている場合が多い。[9.1.1参照]
10. 相互作用
10.2 併用注意
| 三環系抗うつ剤 アミトリプチリン イミプラミン等 フェノチアジン系薬剤 プロクロルペラジン クロルプロマジン等 抗ヒスタミン剤 クロルフェニラミン ジフェンヒドラミン等 | 本剤の作用が増強されることがある。 | 本剤及びこれらの薬剤はともに抗コリン作用を持つ。 |
| モノアミン酸化酵素阻害剤 | 本剤の作用が増強されるおそれがある。 | MAO阻害剤は抗コリン作用を増強させるおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
血圧低下、呼吸困難、発赤、蕁麻疹、血管浮腫等があらわれることがある。
11.1.2 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、Al-Pの著しい上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | ||
| 眼 | 羞明 | ||
| 精神神経系 | 頭重感、耳鳴 | 頭痛 | |
| 消化器 | 口渇、便秘、下痢、悪心・嘔吐 | 胸やけ、胃不快感、食欲不振 | 腹部膨満感 |
| 循環器 | 心悸亢進 | ||
| 泌尿器 | 排尿障害 | 頻尿 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
健康成人12例に本剤(チキジウム臭化物5mg、10mg及び20mg)を単回経口投与したときの血清中濃度推移及び薬物動態パラメータは以下のとおりであった1)。
注)本剤の承認された成人の1回用量は5〜10mgである。
経口投与時の血清中濃度推移
| 投与量 | Cmax(ng/mL) | Tmax(hr) | AUC(ng・hr/mL) |
| 5mg | 3.4±1.0 | 2.1±0.1 | 6.9±2.5 |
| 10mg | 10.9±4.4 | 1.5±0.4 | 22.6±8.2 |
| 20mg | 21.3±3.9 | 1.0±0.2 | 45.2±5.7 |
16.3 分布
16.3.1 ラットに14C-チキジウム臭化物10mg/kgを経口投与したところ、小腸、胃、肝、大腸、腎などに高い分布が認められたが、時間の経過とともに速やかに各臓器より消失し、いずれの部位にも蓄積性は認められなかった。また、中枢神経系には放射活性はほとんど認められなかった2)。
16.3.2 ヒト血漿での血漿蛋白結合率は46.5%であった3)(in vitro)。
16.4 代謝
健康成人22例に本剤(チキジウム臭化物20mg)を1日1回2日間経口投与したとき、尿中には未変化体、主要代謝物としてチオフェン環-O-スルフェート、微量ながらチオフェン環-O-グルクロナイドが検出された4)。
注)本剤の承認された成人の1回用量は5〜10mgである。
16.5 排泄
健康成人12例に本剤(チキジウム臭化物5mg、10mg及び20mg)を単回経口投与したとき、未変化体の尿中排泄は速やかであり、6時間までに総排泄量の90%以上が排泄され、24時間までの総排泄量は投与量の0.6〜0.9%であった1)。
注)本剤の承認された成人の1回用量は5〜10mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内臨床試験
承認時における有効性評価対象例は1,363例であり、その臨床成績は以下の通りであった。
| 疾患名 | 改善率(中等度改善以上) |
| 胃炎 | 68.8%(260/378例) |
| 胃・十二指腸潰瘍 | 62.9%(173/275例) |
| 腸炎 | 61.8%(34/55例) |
| 過敏性大腸症候群 | 65.9%(145/220例) |
| 胆のう・胆道疾患 | 50.5%(50/99例) |
| 尿路結石症 | 71.1%(239/336例) |
承認時における安全性評価対象例1,609例中、副作用は86例(5.34%)、95件に認められ、その主なものは口渇37件(2.30%)、便秘25件(1.55%)であった。また、本剤に起因すると考えられる臨床検査値の異常変動は認められなかった。
18. 薬効薬理
18.1 作用機序
18.2 攣縮緩解作用
19. 有効成分に関する理化学的知見
19.1. チキジウム臭化物
22. 包装
<チアトンカプセル5mg>
100カプセル[10カプセル(PTP)×10]
<チアトンカプセル10mg>
100カプセル[10カプセル(PTP)×10]
23. 主要文献
- 山田健久ほか, 薬学雑誌, 103 (12), 1319-1322, (1983) »DOI
- 高原義男ほか, 応用薬理, 23 (5), 795-802, (1982)
- 社内資料:生体内動態(血漿蛋白結合率)
- 社内資料:生体内動態(尿中代謝物)
- 久保信治ほか, 薬学雑誌, 101 (2), 174-181, (1981) »DOI
- 山崎光雄ほか, 応用薬理, 23 (3), 423-431, (1982)
- Oshita M,et al., Jpn J Pharmacol., 44 (2), 222-224, (1987) »PubMed
- 久保信治ほか, 日薬理誌, 78, 483-490, (1981) »PubMed
- 久保信治ほか, 応用薬理, 23 (3), 461-468, (1982)
- 久保信治ほか, 日薬理誌, 77 (1), 87-98, (1981) »PubMed
- 森川宏二ほか, 薬理と治療, 15 (7), 2783-2786, (1987)
- 中村忍ほか, 新薬と臨牀, 31 (4), 541-546, (1982)
24. 文献請求先及び問い合わせ先
文献請求先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
製品情報問い合わせ先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
26. 製造販売業者等
26.1 製造販売元
ヴィアトリス製薬合同会社
東京都港区麻布台一丁目3番1号