医薬品情報
| 総称名 | ベポタスチンベシル酸塩 |
|---|---|
| 一般名 | ベポタスチンベシル酸塩 |
| 欧文一般名 | Bepotastine Besilate |
| 薬効分類名 | 選択的ヒスタミンH1受容体拮抗・アレルギー性疾患治療剤 |
| 薬効分類番号 | 4490 |
| KEGG DRUG |
D01654
ベポタスチンベシル酸塩
|
| KEGG DGROUP |
DG01482
ヒスタミンH1受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年10月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
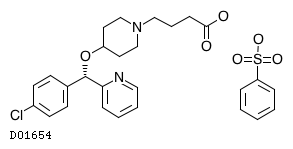
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ベポタスチンベシル酸塩錠5mg「DK」 (後発品) | Bepotastine Besilate Tablets"DK" | 大興製薬 | 4490022F1054 | 10.4円/錠 | |
| ベポタスチンベシル酸塩錠10mg「DK」 (後発品) | Bepotastine Besilate Tablets"DK" | 大興製薬 | 4490022F2050 | 10.7円/錠 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
<成人>
通常、成人にはベポタスチンベシル酸塩として1回10mgを1日2回経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
<小児>
通常、7歳以上の小児にはベポタスチンベシル酸塩として1回10mgを1日2回経口投与する。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
<効能共通>
8.1 眠気を催すことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械を操作する際には注意させること。[17.3.1参照]
8.2 効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
<アレルギー性鼻炎>
8.3 季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 長期ステロイド療法を受けている患者
本剤投与によりステロイドの減量を図る場合には十分な管理下で徐々に行うこと。
9.2 腎機能障害患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で胎児への移行が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が報告されている。
9.7 小児等
低出生体重児、新生児、乳児又は幼児を対象とした臨床試験は実施していない1)。
9.8 高齢者
高い血漿中濃度が持続するおそれがある。主として腎臓から排泄されるが、一般に高齢者では生理機能が低下していることが多い。[16.6.2参照]
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 血液 | 白血球数増加、白血球数減少、好酸球増多 | ||
| 精神神経系 | 眠気、倦怠感、頭痛、めまい | 頭重感 | |
| 消化器 | 口渇、悪心、胃痛、胃部不快感、下痢、口内乾燥、嘔吐 | 舌炎、腹痛 | 便秘 |
| 過敏症 | 発疹、蕁麻疹 | 腫脹 | |
| 肝臓 | AST、ALT、γ-GTPの上昇、LDH、総ビリルビンの上昇 | ||
| 腎臓 | 尿潜血、尿蛋白、尿糖、尿ウロビリノーゲン | 尿量減少、排尿困難、尿閉 | |
| その他 | 月経異常、浮腫、味覚異常 | 動悸、呼吸困難、しびれ |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
<成人>
16.1.1 反復投与
健康成人男性にベポタスチンベシル酸塩20mgを1日2回7日間反復投与した時、蓄積性は認められず、投与開始2日目には血漿中濃度推移はほぼ定常状態に達した(最終投与後のCmax=138.4±23.4ng/mL、平均値±標準偏差、n=6)2)。
<小児>
16.1.2 反復投与
7〜15歳の小児通年性アレルギー性鼻炎患者及び小児アトピー性皮膚炎患者にベポタスチンベシル酸塩10mgを1日2回2週間反復経口投与したときの投与後1〜3時間及び投与後9〜11時間の血漿中ベポタスチン濃度は以下のとおりである3)。
| 通年性アレルギー性鼻炎患者 | アトピー性皮膚炎患者 | ||
| C1-3hr※1 | C9-11hr※2 | C9-11hr※2 | |
| 平均値±標準偏差(例数) | 92.0±56.1(62) | 8.2±4.0(43) | 8.3±4.1(106) |
16.1.3 生物学的同等性
ベポタスチンベシル酸塩錠10mg「DK」とタリオン錠10mgを、クロスオーバー法によりそれぞれ1錠(ベポタスチンベシル酸塩として10mg)健康成人男子に絶食単回経口投与して血漿中ベポタスチン濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された4)。
| n | 判定パラメータ | 参考パラメータ | |||
| AUC0-10(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | ||
| ベポタスチンベシル酸塩錠10mg「DK」 | 19 | 373.12±63.15 | 105.40±25.12 | 1.4±0.4 | 2.5±0.4 |
| タリオン錠10mg | 19 | 375.48±55.28 | 102.55±25.68 | 1.3±0.8 | 2.5±0.3 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 食事の影響
血漿中ベポタスチン濃度に及ぼす食事の影響はほとんど認められなかった5)。
16.2.2 バイオアベイラビリティ
健康成人男性にベポタスチンベシル酸塩を単回経口投与したときの尿中排泄率からバイオアベイラビリティは約82%と推定された5)。
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能障害患者(クレアチニンクリアランス6〜70mL/min)にベポタスチンベシル酸塩5mgを単回経口投与した場合、腎機能正常者に比べ腎機能低下に伴い最高血漿中濃度は若干の上昇がみられ、AUCは明らかに上昇した。腎機能障害患者に反復経口投与したときの定常状態における最高血漿中濃度は腎機能正常者に比べ1.2〜1.8倍に増加することが予測された6)。[7.1、9.2参照]
| 腎機能障害患者の分類 (クレアチニンクリアランス) | Tmax(hr) | Cmax(ng/mL) | T1/2(hr) | AUC0-∞(ng・hr/mL) |
| 腎機能正常者(n=5) (>70mL/min) | 1.2±0.4 | 55.1±16.8 | 2.9±0.5 | 241.1±50.6 |
| 軽度腎機能障害患者(n=5) (51〜70mL/min) | 1.0±0.0 | 61.0±10.8 | 3.1±0.6 | 304.0±61.7 |
| 中等度又は高度腎機能障害患者(n=6) (6〜50mL/min) | 3.3±1.0 | 66.3±7.7 | 8.5±3.6 | 969.1±398.3 |
16.6.2 高齢者
16.8 その他
ベポタスチンベシル酸塩錠5mg「DK」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成18年11月24日薬食審査発第1124004号)」に基づき、ベポタスチンベシル酸塩錠10mg「DK」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた4)。
注)本剤の承認用量はベポタスチンベシル酸塩として1回10mg、1日2回である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<アレルギー性鼻炎>
17.1.1 国内前期第II相試験(成人)
アレルギー性鼻炎患者(通年性)を対象にベポタスチンベシル酸塩20mg/日(1回10mg、1日2回)を4週間経口投与したときの最終全般改善度注1)(中等度改善以上)は、65.0%(13/20例)であった。
副作用は眠気4.2%(1/24例)のみであった8)。
副作用は眠気4.2%(1/24例)のみであった8)。
17.1.2 国内後期第II相試験(成人)
アレルギー性鼻炎患者(通年性)を対象にベポタスチンベシル酸塩20mg/日(1回10mg、1日2回)を4週間経口投与したときの最終全般改善度注1)(中等度改善以上)は、65.3%(49/75例)であった。
副作用発現頻度は7.2%(6/83例)であった。主な副作用は眠気6.0%(5/83例)であった9)。
副作用発現頻度は7.2%(6/83例)であった。主な副作用は眠気6.0%(5/83例)であった9)。
17.1.3 国内第III相試験(成人)
アレルギー性鼻炎患者(通年性)を対象にベポタスチンベシル酸塩20mg/日(1回10mg、1日2回)を4週間経口投与したときの最終全般改善度注1)(中等度改善以上)は、62.1%(64/103例)であった。
副作用発現頻度は5.9%(7/118例)であった。主な副作用は眠気3.4%(4/118例)、口渇1.7%(2/118例)であった10)。
副作用発現頻度は5.9%(7/118例)であった。主な副作用は眠気3.4%(4/118例)、口渇1.7%(2/118例)であった10)。
17.1.4 国内第III相試験(小児)
小児(7〜15歳)のアレルギー性鼻炎患者(通年性)を対象とした投与2週間の二重盲検比較試験において、ベポタスチンベシル酸塩20mg/日(1回10mg、1日2回)群(240例)及びプラセボ群(232例)における鼻の3主徴(くしゃみ発作、鼻汁、鼻閉)合計スコア(最終評価時)のベースラインからの変化量(平均値±標準偏差)はそれぞれ−1.587±1.332及び−1.102±1.462であり、共分散分析(投与群を因子、投与前スコアを共変量)の結果、ベポタスチンベシル酸塩20mg/日のプラセボに対する優越性が検証された(p<0.001)。
副作用発現頻度は、ベポタスチンベシル酸塩20mg/日群で1.7%(4/240例)であった。副作用の内訳は尿中血陽性、ALT増加、AST増加、肝機能検査異常及び白血球数増加いずれも0.4%(1/240例)であった11)。
副作用発現頻度は、ベポタスチンベシル酸塩20mg/日群で1.7%(4/240例)であった。副作用の内訳は尿中血陽性、ALT増加、AST増加、肝機能検査異常及び白血球数増加いずれも0.4%(1/240例)であった11)。
17.1.5 国内第III相長期投与試験(小児)
小児(7〜15歳)のアレルギー性鼻炎患者(通年性)58例を対象とした投与12週間の長期投与試験(非盲検)において、ベポタスチンベシル酸塩20mg/日(1回10mg、1日2回)の鼻の3主徴(くしゃみ発作、鼻汁、鼻閉)合計スコアのベースラインからの変化量(平均値±標準偏差)は投与2週時−0.943±1.549、投与4週時−1.388±1.465、投与12週時−1.451±1.707であった。
副作用発現頻度は3.4%(2/58例)であった。副作用の内訳は傾眠、肝機能検査異常いずれも1.7%(1/58例)であった12)。
副作用発現頻度は3.4%(2/58例)であった。副作用の内訳は傾眠、肝機能検査異常いずれも1.7%(1/58例)であった12)。
<蕁麻疹>
17.1.6 国内前期第II相試験(成人)
慢性蕁麻疹患者を対象とした試験においてベポタスチンベシル酸塩20mg/日(1回10mg、1日2回)を2週間(14±4日間)経口投与したときの最終全般改善度注2)(中等度改善以上)は、75.0%(24/32例)であった。
副作用は眠気6.1%(2/33例)のみであった13)。
副作用は眠気6.1%(2/33例)のみであった13)。
17.1.7 国内後期第II相試験(成人)
慢性蕁麻疹患者を対象とした試験においてベポタスチンベシル酸塩20mg/日(1回10mg、1日2回)を2週間(14±4日間)経口投与したときの最終全般改善度注2)(中等度改善以上)は、76.1%(67/88例)であった。
副作用発現頻度は10.4%(10/96例)であった。主な副作用は眠気6.3%(6/96例)であった14)。
副作用発現頻度は10.4%(10/96例)であった。主な副作用は眠気6.3%(6/96例)であった14)。
17.1.8 国内第III相試験(成人)
慢性蕁麻疹患者を対象としてベポタスチンベシル酸塩20mg/日(1回10mg、1日2回)を2週間(14±4日間)経口投与したときの最終全般改善度注2)(中等度改善以上)は、76.9%(100/130例)であった。
副作用発現頻度は12.7%(18/142例)であった。主な副作用は眠気7.7%(11/142例)、口渇2.8%(4/142例)であった15)。
副作用発現頻度は12.7%(18/142例)であった。主な副作用は眠気7.7%(11/142例)、口渇2.8%(4/142例)であった15)。
17.1.9 国内第III相試験(成人)
投与期間を1週間(7+2日間)とし、プラセボを対照薬とした慢性蕁麻疹の二重盲検比較試験において、ベポタスチンベシル酸塩はプラセボと比較して、そう痒及び発斑の症状スコアを有意に減少させた。
| 症状 | 薬剤群 | 例数 | 投与前日 | 最終投与時 | 変化量 | 検定 (無制約LSD法) | |||
| 平均値 | 標準誤差 | 平均値 | 標準誤差 | 平均値 | 標準誤差 | ||||
| そう痒 | 10mg×2 | 55 | 2.75 | 0.091 | 1.13 | 0.122 | −1.62 | 0.141 | p<0.0001 |
| プラセボ | 54 | 2.70 | 0.086 | 2.56 | 0.120 | −0.15 | 0.133 | ||
| 発斑 | 10mg×2 | 55 | 2.33 | 0.064 | 0.84 | 0.118 | −1.49 | 0.124 | p<0.0001 |
| プラセボ | 54 | 2.30 | 0.063 | 1.83 | 0.114 | −0.46 | 0.111 | ||
副作用発現頻度は、ベポタスチンベシル酸塩群で10.9%(6/55例)であった。主な副作用は、眠気5.5%(3/55例)、悪心5.5%(3/55例)、めまい3.6%(2/55例)であった16)。
<皮膚疾患に伴うそう痒(湿疹・皮膚炎、痒疹、皮膚そう痒症)>
17.1.10 国内第III相試験(成人)
患者217例を対象としてベポタスチンベシル酸塩20mg/日(1回10mg、1日2回)を2週間(14±4日間)経口投与した一般臨床試験の最終全般改善度(中等度改善以上)は、全体で64.7%(119/184例)で、疾患群別では湿疹・皮膚炎群63.1%(65/103例)、痒疹群73.2%(30/41例)、皮膚そう痒症60.0%(24/40例)であった。
副作用発現頻度は、全体で9.2%(19/206例)で、疾患群別では湿疹・皮膚炎群8.5%(10/117例)、痒疹群6.7%(3/45例)、皮膚そう痒症13.6%(6/44例)であった。主な副作用は、いずれの群においても眠気で、全体で5.8%(12/206例)、湿疹・皮膚炎群4.3%(5/117例)、痒疹群4.4%(2/45例)、皮膚そう痒症11.4%(5/44例)であった17)。
副作用発現頻度は、全体で9.2%(19/206例)で、疾患群別では湿疹・皮膚炎群8.5%(10/117例)、痒疹群6.7%(3/45例)、皮膚そう痒症13.6%(6/44例)であった。主な副作用は、いずれの群においても眠気で、全体で5.8%(12/206例)、湿疹・皮膚炎群4.3%(5/117例)、痒疹群4.4%(2/45例)、皮膚そう痒症11.4%(5/44例)であった17)。
<アトピー性皮膚炎>
17.1.11 国内第III相試験(小児)
小児(7〜15歳)を対象とした投与2週間の二重盲検比較試験において、ベポタスチンベシル酸塩20mg/日(1回10mg、1日2回)群(151例)及びケトチフェンフマル酸塩群(152例)におけるそう痒スコア(最終評価時)のベースラインからの変化量(平均値±標準偏差)はそれぞれ−0.674±0.723及び−0.634±0.762であり、共分散分析(投与群を因子、投与前スコアを共変量)の結果、ベポタスチンベシル酸塩20mg/日のケトチフェンフマル酸塩ドライシロップに対する非劣性が検証された(スコア変化量の調整済平均値の群間差の95%信頼区間上限が0.4以下)。
副作用は、ベポタスチンベシル酸塩20mg/日群で傾眠2.0%(3/151例)のみであった18)。
副作用は、ベポタスチンベシル酸塩20mg/日群で傾眠2.0%(3/151例)のみであった18)。
17.3 その他
17.3.1 眠気及び精神運動能に対する影響
(1)プラセボを対照薬とした慢性蕁麻疹の二重盲検群間比較試験において、ベポタスチンベシル酸塩投与群〔20mg/日〕(55例)の眠気の副作用発現頻度は、プラセボ投与群(54例)と同程度であった16)。[8.1参照]
注1)主症状であるくしゃみ、鼻汁、鼻閉を中心に、症状・所見の推移をもとに5段階で判定(著明改善:著しい症状の改善を認める、中等度改善:かなり症状の改善を認める、軽度改善:わずかな症状の改善を認める、不変:症状に変化がない、悪化:観察期間に比べて症状の悪化を認める)
注2)そう痒及び発斑(膨疹・紅斑)の推移をもとに5段階で判定(著明改善:いずれも消失するかそう痒が消失して発斑が著しく軽快、中等度改善:いずれもかなり軽快、軽度改善:やや軽快、不変:変化がない、悪化)
18. 薬効薬理
18.1 作用機序
血管透過性亢進及び平滑筋収縮に関与するヒスタミンに対する拮抗作用、ならびに好酸球機能の活性化に関与するインターロイキン-5の産生抑制作用と考えられる。
18.2 ヒスタミンH1受容体拮抗作用
18.2.1 ベポタスチンベシル酸塩はH1受容体に対して選択的親和性を示し、5-HT2、α1、α2、muscarinic受容体等に対しては親和性を示さなかった21)(in vitro)。
18.3 I型アレルギー反応抑制作用
18.4 好酸球に対する作用
18.4.1 ベポタスチンベシル酸塩の経口投与は血小板活性化因子(PAF)(ラット)及び抗原による(モルモット)好酸球浸潤を抑制する26)。
18.4.2 ベポタスチンベシル酸塩の経口投与は抗原により誘発される末梢血中好酸球の増多(マウス)を抑制する27)。
18.5 サイトカインの産生に対する作用
ベポタスチンベシル酸塩はヒト末梢血単核球におけるインターロイキン-5の産生を抑制する28)(in vitro)。
18.6 一般薬理作用
18.6.1 ベポタスチンベシル酸塩の中枢神経系、呼吸・循環器系、消化器系、自律神経系・平滑筋、腎機能、代謝系及び血液系の一般薬理試験において特記すべき所見は認められていない(マウス、ラット、モルモット及びイヌ)21)29)。
18.6.2 ベポタスチンベシル酸塩の催不整脈作用(モルモット)について検討したがこれらの作用は認められなかった30)。
18.7 ヒスタミン誘発皮内反応試験
健康成人を対象としたヒスタミン誘発皮内反応試験において、ベポタスチンベシル酸塩5、10mgの経口投与で、膨疹及び紅斑を用量依存的に抑制し、投与後12時間においてもプラセボに比し有意に抑制した20)。
19. 有効成分に関する理化学的知見
19.1. ベポタスチンベシル酸塩
20. 取扱い上の注意
開封後は湿気を避けて保存すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<ベポタスチンベシル酸塩錠5mg「DK」>
100錠[10錠(PTP)×10]
<ベポタスチンベシル酸塩錠10mg「DK」>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
23. 主要文献
- 馬場駿吉, 臨床医薬, 18 (12), 1371-87, (2002)
- 門阪利雄他, 臨床医薬, 13 (5), 1155-68, (1997)
- 小児と成人の薬物動態の比較(タリオン錠/OD錠:2015年5月26日承認、申請資料概要2.7.2.3.1)
- 大興製薬株式会社:生物学的同等性に関する資料(社内資料)
- 横田秀雄他, 臨床医薬, 13 (5), 1137-53, (1997)
- 川島一剛他, 臨床医薬, 19 (6), 637-48, (2003)
- 熊谷雄治他, 臨床医薬, 13 (5), 1169-85, (1997)
- 馬場駿吉他, 臨床医薬, 13 (5), 1217-35, (1997)
- 馬場駿吉他, 臨床医薬, 13 (5), 1259-86, (1997)
- 馬場駿吉他, 臨床医薬, 13 (5), 1307-35, (1997)
- 小児通年性アレルギー性鼻炎患者を対象とした検証的試験(タリオン錠/OD錠:2015年5月26日承認、申請資料概要2.7.6.4)
- 小児通年性アレルギー性鼻炎患者を対象とした長期投与試験(タリオン錠/OD錠:2015年5月26日承認、申請資料概要2.7.6.6)
- 石橋康正他, 臨床医薬, 13 (5), 1199-215, (1997)
- 石橋康正他, 臨床医薬, 13 (5), 1237-57, (1997)
- 石橋康正他, 臨床医薬, 13 (5), 1287-306, (1997)
- 川島眞他, 臨床医薬, 18 (4), 501-19, (2002)
- 石橋康正他, 臨床医薬, 13 (5), 1383-400, (1997)
- 川島眞他, 臨床医薬, 31 (3), 235-51, (2015)
- 小児通年性アレルギー性鼻炎患者を対象とした検証的試験(タリオン錠/OD錠:2015年5月26日承認、申請資料概要2.7.6.3)
- 石橋康正他, 臨床医薬, 13 (5), 1187-97, (1997)
- Kato M,et al., Arzneimittelforschung., 47 (10), 1116-24, (1997) »PubMed
- 谷藤直子他, 日本薬理学雑誌, 110, 19-29, (1997) »PubMed
- 本田浩子他, 薬理と治療, 25 (4), 879-88, (1997)
- 坂本修身他, 薬理と治療, 25 (4), 889-94, (1997)
- 村田隆司他, アレルギー, 46 (7), 576-84, (1997) »DOI
- Ueno M,et al., Pharmacology., 57 (4), 206-14, (1998) »PubMed
- Sakai A,et al., Arzneimittelforschung., 47 (8), 954-58, (1997) »PubMed
- Kaminuma O,et al., Biol Pharm Bull., 21 (4), 411-3, (1998) »PubMed
- 成田寛他, 薬理と治療, 25 (4), 907-24, (1997)
- Shigenobu K,et al., Res Commun Pharmacol Toxicol., 2 (3), 163-74, (1997)
24. 文献請求先及び問い合わせ先
文献請求先
大興製薬株式会社
安全管理部
〒350-1155
埼玉県川越市下赤坂560番地1
電話:049-266-6061
FAX:049-266-6078
製品情報問い合わせ先
大興製薬株式会社
安全管理部
〒350-1155
埼玉県川越市下赤坂560番地1
電話:049-266-6061
FAX:049-266-6078
26. 製造販売業者等
26.1 製造販売元
大興製薬株式会社
埼玉県川越市下赤坂560番地1
26.2 販売元
江州製薬株式会社
滋賀県湖南市三雲143-1