医薬品情報
| 総称名 | オラビ |
|---|---|
| 一般名 | ミコナゾール |
| 欧文一般名 | miconazole |
| 製剤名 | ミコナゾール付着錠 |
| 薬効分類名 | 口腔粘膜付着型 口腔咽頭カンジダ症治療剤 |
| 薬効分類番号 | 6290 |
| ATCコード | A01AB09 A07AC01 D01AC02 G01AF04 J02AB01 |
| KEGG DRUG |
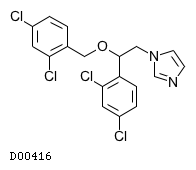
D00416
ミコナゾール
|
| KEGG DGROUP |
DG00004
ミコナゾール
DG01883
イミダゾール系抗真菌薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年4月 改訂(第4版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オラビ錠口腔用50mg | ORAVI Mucoadhesive Tablets 50mg | ネクセラファーマジャパン | 6290704D1026 | 922.8円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
カンジダ属による口腔咽頭カンジダ症
6. 用法及び用量
通常、成人には1回1錠(ミコナゾールとして50mg)を1日1回、上顎歯肉(犬歯窩)に付着して用いる。
7. 用法及び用量に関連する注意
7.1 本剤の投与期間は原則として14日間とする。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 スルホニル尿素系血糖降下剤を投与中の患者
血糖値その他患者の状態を十分観察しながら慎重に投与すること。低血糖症状をきたした症例が報告されている。[10.2参照]
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
動物実験(ラット)において、乳汁中に移行することが報告されている2)。
動物実験(ラット)において、乳汁中に移行することが報告されている2)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
相互作用序文
本薬はCYP3A及びCYP2C9を阻害する。
薬物代謝酵素用語
CYP3A
薬物代謝酵素用語
CYP2C9
10.1 併用禁忌
| ワルファリンカリウム ワーファリン [2.2参照] | ワルファリンの作用が増強し、重篤な出血あるいは著しいINR上昇があらわれることがある。また、併用中止後も、ワルファリンの作用が遷延し重篤な出血を来したとの報告もある。患者がワルファリンの治療を必要とする場合は、ワルファリンの治療を優先し、本剤を投与しないこと。 | ミコナゾールがワルファリンの代謝酵素であるCYP2C9を阻害することによると考えられる。 |
| ピモジド オーラップ [2.2参照] | ピモジドによるQT延長、心室性不整脈(torsades de pointesを含む)等の重篤な心臓血管系の副作用があらわれるおそれがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| キニジン硫酸塩水和物 キニジン硫酸塩 [2.2参照] | キニジンによるQT延長等があらわれるおそれがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| トリアゾラム ハルシオン [2.2参照] | トリアゾラムの作用の増強及び作用時間の延長があらわれるおそれがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| シンバスタチン リポバス [2.2参照] | シンバスタチンによる横紋筋融解症があらわれるおそれがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| アゼルニジピン カルブロック オルメサルタン メドキソミル・アゼルニジピン レザルタス配合錠 ニソルジピン ブロナンセリン ロナセン [2.2参照] | これらの薬剤の血中濃度が上昇するおそれがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン クリアミン配合錠 ジヒドロエルゴタミンメシル酸塩 [2.2参照] | これらの薬剤の血中濃度が上昇し、血管攣縮等の重篤な副作用があらわれるおそれがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| リバーロキサバン イグザレルト [2.2参照] | リバーロキサバンの血中濃度が上昇し、抗凝固作用が増強されることにより、出血の危険性が増大するおそれがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| アスナプレビル スンベプラ [2.2参照] | アスナプレビルの血中濃度が上昇し、肝胆道系の副作用が発現又は重症化するおそれがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| ロミタピドメシル酸塩 ジャクスタピッド [2.2参照] | ロミタピドメシル酸塩の血中濃度が著しく上昇するおそれがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| ルラシドン塩酸塩 ラツーダ [2.2参照] | ルラシドン塩酸塩の血中濃度が上昇し、作用が増強するおそれがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
10.2 併用注意
| スルホニル尿素系血糖降下剤 グリベンクラミド、 グリクラジド、 アセトヘキサミド等 [9.1.1参照] | これらの薬剤の作用を増強することがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYPを阻害することによると考えられる。 |
| フェニトイン | これらの薬剤の作用を増強することがある。 | ミコナゾールがフェニトインの代謝酵素であるCYP2C9を阻害することによると考えられる。 |
| カルバマゼピン | これらの薬剤の作用を増強することがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| ドセタキセル パクリタキセル イリノテカン塩酸塩水和物 | これらの薬剤による骨髄抑制等の副作用が増強するおそれがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| シクロスポリン | シクロスポリンの血中濃度が上昇することがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| タクロリムス水和物 アトルバスタチンカルシウム水和物 ビンカアルカロイド系抗悪性腫瘍剤 ビンクリスチン硫酸塩、 ビンブラスチン硫酸塩、 ビノレルビン酒石酸塩等 ジヒドロピリジン系カルシウム拮抗剤 ニフェジピン、 アムロジピンベシル酸塩、 ニカルジピン塩酸塩等 ベラパミル塩酸塩 シルデナフィルクエン酸塩 アルプラゾラム ミダゾラム ブロチゾラム メチルプレドニゾロン セレギリン塩酸塩 エバスチン イマチニブメシル酸塩 ジソピラミド シロスタゾール | これらの薬剤の血中濃度が上昇するおそれがある。 | ミコナゾールがこれらの薬剤の代謝酵素であるCYP3Aを阻害することによると考えられる。 |
| HIVプロテアーゼ阻害剤 リトナビル、 ホスアンプレナビルカルシウム水和物、 アタザナビル硫酸塩等 | ミコナゾール又はこれらの薬剤の血中濃度が上昇するおそれがある。 | ミコナゾールとこれらの薬剤とのCYP3Aに対する競合的阻害作用によると考えられる。 |
11. 副作用
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 頻度不明 | |
| 胃腸障害 | 腹部不快感、悪心、腹痛、上腹部痛、口唇炎、下痢、胃腸障害、口腔内不快感 | 嘔吐、口内乾燥、歯肉痛、舌痛、歯肉そう痒症、口腔内潰瘍形成 | |
| 一般・全身障害および投与部位の状態 | 適用部位不快感、適用部位紅斑、適用部位刺激感、適用部位疼痛、適用部位潰瘍、適用部位炎症、適用部位皮膚剥脱、倦怠感 | 疲労、疼痛 | |
| 感染症および寄生虫症 | 歯冠周囲炎 | 上気道感染 | |
| 筋骨格系および結合組織障害 | 背部痛 | ||
| 神経系障害 | 味覚異常 | 頭痛 | 味覚消失 |
| 精神障害 | 不安 | ||
| 皮膚および皮下組織障害 | 発疹 | そう痒症 | |
| その他 | 食欲不振、ほてり | ||
| 臨床検査 | 心電図ST部分下降、血中アルカリホスファターゼ増加 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 本剤は湿度の影響を受けやすいのでボトル包装品のまま患者に交付すること。
14.1.2 本剤の使用にあたっては、患者等に対して、以下の使用方法、注意点及び保管方法を十分に説明すること。
(1)使用時
・本剤を乾いた手でボトルから取り出し、上顎歯肉(犬歯窩)に付着すること。飲み込んだり、なめたり、噛み砕いたりしないこと。
・本剤の付着方法は、刻印(L)のない面(曲面)を、上顎歯肉に置き、30秒間上唇の上から指で軽く押しながら本剤を保持し上顎歯肉に付着すること。その後、数分間は舌で本剤を触らないようにすること。
・本剤はいったん付着したら、徐々に溶解するので、そのままにしておくこと。
・次に本剤を使用する場合には、反対側の歯肉に付着すること。その際は、前回の製剤が残っていたら、取り除いてから使用すること。
・湿度の影響を受けやすいので、使用の都度キャップをしっかり締めること。
(2)使用後
・本剤が口腔内にあるとき、飲食は通常どおり行ってよいが、本剤が歯肉に付着するのを妨げるおそれがある行為(ガムを噛む等)は避けること。
・本剤が付着しないか、6時間以内にはがれたときは、はがれた製剤を速やかに元の位置に付着すること。はがれた製剤が付着しないときは、新たな本剤を使用すること。
・付着後6時間以内に本剤を飲み込んだときは、コップ一杯の水を飲んでから、一度だけ新たな本剤を使用すること。
・付着後6時間以上経ってから本剤がはがれたり、本剤を飲み込んだりしたときは、翌日まで新たな本剤を使用しないこと。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人12例を対象に、本剤1錠(ミコナゾールとして50mg)を1回、上顎歯肉(犬歯窩)に付着し、唾液中、舌背付着液中及び血漿中のミコナゾール濃度を経時的に測定した3)。
| 例数 | Cmax(μg/mL) | tmax(hour) | AUC0-24h(μg・h/mL) | |
| 唾液 | 12 | 345.98±201.84 | 14.08±6.27 | 2628.07±1106.24 |
| 舌背付着液 | 12 | 2506.35±3420.37 | 16.50±6.83 | 23339.95±21903.32 |
| 血漿 | 12 | 〔2.12±1.03〕×10−3 | 18.10±6.22 | 〔24.84±12.41〕×10−3 |
図 唾液中ミコナゾール濃度の推移
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
口腔咽頭カンジダ症患者を対象として、本剤1回1錠(ミコナゾールとして50mg)、1日1回を14日間投与時の有効性及び安全性を検討することを目的に、ミコナゾールゲル剤を対照とした無作為化非盲検並行群間比較試験を実施した。症例数は、本剤62例及びミコナゾールゲル剤61例であった4)5)。治験薬投与開始15日目における病変スコア及び症状スコアに基づく臨床効果について、治癒率[95%信頼区間]は、本剤群46.8[34.0〜59.9]%(29/62例)、ミコナゾールゲル剤群47.5[34.6〜60.7]%(29/61例)であった5)。また、副作用発現率(臨床検査値異常を含む)は、総症例62例中18例(29.0%)であり、主な副作用は、味覚異常(8.1%)、適用部位不快感(4.8%)、腹部不快感(3.2%)、悪心(3.2%)等であった4)5)。
18. 薬効薬理
18.1 作用機序
18.2 カンジダに対する作用
最小発育阻止濃度
口腔咽頭カンジダ症患者(成人男女)を対象とした無作為化非盲検並行群間比較試験において、患者から採取されたCandida属の臨床分離株に対するミコナゾールのin vitro抗真菌活性を測定し、最小発育阻止濃度(MIC50/MIC90)を比較したところ、下表のとおりであった4)。
| 菌種(供試菌株数) | MIC50/MIC90(μg/mL) |
| Candida albicans(110) | ≦0.03/0.06 |
| glabrata(18) | 0.5/1 |
| tropicalis(10) | 0.06/1 |
19. 有効成分に関する理化学的知見
19.1. ミコナゾール
22. 包装
14錠
[乾燥剤入りプラスチックボトル]
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
久光製薬株式会社
お客様相談室 受付時間/9:00−17:50(土日・祝日・会社休日を除く)
〒135-6008
東京都江東区豊洲三丁目3番3号
電話:0120-381332
FAX:03-5293-1723
製品情報問い合わせ先
久光製薬株式会社
お客様相談室 受付時間/9:00−17:50(土日・祝日・会社休日を除く)
〒135-6008
東京都江東区豊洲三丁目3番3号
電話:0120-381332
FAX:03-5293-1723
26. 製造販売業者等
26.1 製造販売元
ネクセラファーマジャパン株式会社
東京都港区赤坂九丁目7番2号
26.2 発売元
久光製薬株式会社
〒841-0017
鳥栖市田代大官町408番地