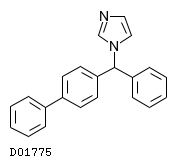
医薬品情報
| 総称名 | ビホナゾール |
|---|---|
| 一般名 | ビホナゾール |
| 欧文一般名 | Bifonazole |
| 製剤名 | ビホナゾール製剤 |
| 薬効分類名 | 外用抗真菌剤 |
| 薬効分類番号 | 2655 |
| ATCコード | D01AC10 |
| KEGG DRUG |
D01775
ビホナゾール
|
| KEGG DGROUP |
DG01883
イミダゾール系抗真菌薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年7月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ビホナゾールクリーム1%「イワキ」 (後発品) | Bifonazole Cream 1%"IWAKI" | 岩城製薬 | 2655708N1318 | 10.9円/g | |
| ビホナゾール外用液1%「イワキ」 (後発品) | Bifonazole Solution 1%"IWAKI" | 岩城製薬 | 2655708Q1195 | 10.9円/mL |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
1日1回患部に塗布する。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 他のイミダゾール系抗真菌剤に対し過敏症の既往歴のある患者
9.5 妊婦
妊婦(3ヵ月以内)又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ使用すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット静脈内投与)で乳汁中へ移行することが報告されている。
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 皮膚 | 皮膚炎、発赤 | 紅斑、そう痒、びらん、水疱 | 局所の刺激感、鱗屑、亀裂、皮膚軟化、乾燥、浮腫、じん麻疹 |
| 0.1〜5%未満 | 頻度不明 | |
| 皮膚 | 亀裂、皮膚炎、そう痒、発赤、びらん、乾燥 | 局所の刺激感、紅斑、鱗屑、水疱、皮膚軟化、浮腫、じん麻疹 |
14. 適用上の注意
14.1 薬剤交付時の注意
基剤として使用されている油脂性成分は、コンドーム、ペッサリー等の避妊用ラテックスゴム製品の品質を劣化・破損する可能性があるため、これらとの接触を避けさせること。
14.2 薬剤投与時の注意
<製剤共通>
14.2.1 眼科用として角膜、結膜には使用しないこと。
14.2.2 著しいびらん面には使用しないこと。
<外用液>
14.2.3 亀裂、びらん面には注意して使用すること。
16. 薬物動態
16.1 血中濃度
健康成人の無傷皮膚(臍上部)及び炎症皮膚(大腿部の慢性湿疹)表面200cm2に14C-ビホナゾールの1%含有クリーム1.52gを塗布、6時間密封包帯した後洗浄し、118時間にわたって血中濃度を測定した場合、無傷皮膚では約9.5時間後、炎症皮膚では約8時間後、それぞれ約1.0ng/mL、3.4ng/mLの最高血中濃度に達する1)(外国人データ)。
また、健康成人の無傷皮膚(臍上部)及び炎症皮膚(背部の急性湿疹)表面200cm2に14C-ビホナゾールの1%含有液1.56mLを塗布、6時間密封包帯した後洗浄し、118時間にわたって血中濃度を測定した場合、無傷皮膚では約10時間後、炎症皮膚では約5時間後、それぞれ約1.6ng/mL、約8.0ng/mLの最高血中濃度に達する1)(外国人データ)。
また、健康成人の無傷皮膚(臍上部)及び炎症皮膚(背部の急性湿疹)表面200cm2に14C-ビホナゾールの1%含有液1.56mLを塗布、6時間密封包帯した後洗浄し、118時間にわたって血中濃度を測定した場合、無傷皮膚では約10時間後、炎症皮膚では約5時間後、それぞれ約1.6ng/mL、約8.0ng/mLの最高血中濃度に達する1)(外国人データ)。
16.2 吸収
16.2.1 吸収率
16.2.2 皮膚浸透性
健康成人の背部無傷皮膚表面100cm2に14C-ビホナゾールの1%含有クリーム500mgを塗布、その後24〜168時間にわたり各時点でテープはく離法(15回はく離)を施行し、皮膚(角質層)を採取した(はく離1〜5回目:層1、6〜10回目:層2、11〜15回目:層3)。これら標本の経時的放射能推移曲線下の面積を指標とした場合、それぞれ7066(層1)、1237(層2)、626(層3)μCi・hと良好な浸透性を示している2)(外国人データ)。
また、健康成人の無傷皮膚表面20cm2に14C-ビホナゾールの1%含有液0.15mLを塗布、12時間密封包帯した後、皮膚の各層の濃度を測定した場合、次のとおりである1)(外国人データ)。
また、健康成人の無傷皮膚表面20cm2に14C-ビホナゾールの1%含有液0.15mLを塗布、12時間密封包帯した後、皮膚の各層の濃度を測定した場合、次のとおりである1)(外国人データ)。
| 角質層 | 有棘層 | 乳頭層 | 網状層 |
| 200-1000μg/cm3 | 約20μg/cm3 | 5-10μg/cm3 | 約2μg/cm3 |
16.5 排泄
健康成人の無傷皮膚(臍上部)及び炎症皮膚(大腿部の慢性湿疹)表面200cm2に14C-ビホナゾールの1%含有クリーム1.52gを塗布、6時間密封包帯した後洗浄したところ、5日目までの排泄は無傷皮膚では約0.3%が尿中、約0.25%が糞便中、炎症皮膚では約1%が尿中、約1.2%が糞便中に排泄される1)(外国人データ)。
また、健康成人の無傷皮膚(臍上部)及び炎症皮膚(背部の急性湿疹)表面200cm2に14C-ビホナゾールの1%含有液1.56mLを塗布、6時間密封包帯した後洗浄したところ、5日目までの排泄は無傷皮膚では約0.4%が尿中、約0.3%が糞便中、炎症皮膚では約1.7%が尿中に排泄される。炎症皮膚での糞便中への排泄についてのデータは得られていない1)(外国人データ)。
また、健康成人の無傷皮膚(臍上部)及び炎症皮膚(背部の急性湿疹)表面200cm2に14C-ビホナゾールの1%含有液1.56mLを塗布、6時間密封包帯した後洗浄したところ、5日目までの排泄は無傷皮膚では約0.4%が尿中、約0.3%が糞便中、炎症皮膚では約1.7%が尿中に排泄される。炎症皮膚での糞便中への排泄についてのデータは得られていない1)(外国人データ)。
18. 薬効薬理
18.1 作用機序
18.2 抗真菌作用
18.2.1 ビホナゾールは、Kimmig培地上で各種ヒト病原真菌の90%以上の菌株において4μg/mL以下の最小発育阻止濃度(MIC)を示す5)。
18.2.2 ビホナゾールは、発育期にある皮膚糸状菌に対して極めて低い濃度(ナノグラム単位)より菌糸の発育を抑制し、5μg/mL以上の濃度で殺真菌作用を示す。また、Candida albicansに対しては、0.125μg/mL以上の濃度で寄生形態である仮性菌糸の形成を抑制する5)6)。
18.2.3 Trichophyton mentagrophytesによるモルモット実験的白癬モデルにビホナゾール1%クリームまたはビホナゾール1%液を感染後3日目に1回局所適用した場合、無処置対照群では症状の増悪が認められるが、処置群では数日以内に治癒する5)。
18.3 感染防御効果
18.4 生物学的同等性試験
18.4.1 in vitro抗菌力
ビホナゾールクリーム1%「イワキ」とマイコスポールクリーム1%の各真菌に対するMIC値は(ビホナゾール濃度として)皮膚糸状菌に対し0.39〜6.25μg/mL、酵母類に対し31.25μg/mL、癜風菌に対し25μg/mLであり、優れた抗菌活性を示し、すべての真菌に対して同じMIC値を示したことから、両剤の生物学的同等性が確認された7)。
また、ビホナゾール外用液1%「イワキ」とマイコスポール外用液1%の各真菌に対するMIC値は(ビホナゾール濃度として)皮膚糸状菌に対し0.39〜6.25μg/mL、酵母類に対し31.25μg/mL、癜風菌に対し50μg/mLであり、優れた抗菌活性を示し、すべての真菌に対して同じMIC値を示したことから、両剤の生物学的同等性が確認された7)。
また、ビホナゾール外用液1%「イワキ」とマイコスポール外用液1%の各真菌に対するMIC値は(ビホナゾール濃度として)皮膚糸状菌に対し0.39〜6.25μg/mL、酵母類に対し31.25μg/mL、癜風菌に対し50μg/mLであり、優れた抗菌活性を示し、すべての真菌に対して同じMIC値を示したことから、両剤の生物学的同等性が確認された7)。
18.4.2 治療効果
18.4.3 感染防御効果
19. 有効成分に関する理化学的知見
19.1. ビホナゾール
20. 取扱い上の注意
<外用液>
20.1 火気を避けて保存すること。
20.2 低温(約3℃以下)で凝固するので注意すること。
20.3 合成樹脂を軟化したり、塗料を溶かすことがあるので注意すること。
22. 包装
<ビホナゾールクリーム1%「イワキ」>
10本[10g(チューブ)×10]
600g[ボトル]
<ビホナゾール外用液1%「イワキ」>
10本[10mL(ボトル)×10]
50本[10mL(ボトル)×50]
23. 主要文献
- Patzschke K,et al., Arzneim-Forsch., 33, 745-750, (1983) »PubMed
- Lucker PW,et al., Dermatologica., 169 (Suppl.1), 51-56, (1984)
- 山口英世他, Chemotherapy., 32, 829-841, (1984) »DOI
- Barug D,et al., Arzneim-Forsch., 33, 528-537, (1983) »PubMed
- Plempel M,et al., Arzneim-Forsch., 33, 517-525, (1983) »PubMed
- Osumi M,et al., Dermatologica., 169 (Suppl.1), 19-31, (1984)
- 岩城製薬株式会社 社内資料(生物学的同等性試験)
24. 文献請求先及び問い合わせ先
文献請求先
岩城製薬株式会社
マーケティング部 学術グループ
〒103-8434
東京都中央区日本橋本町4-8-2
電話:03-6626-6251
FAX:03-6626-6261
製品情報問い合わせ先
岩城製薬株式会社
マーケティング部 学術グループ
〒103-8434
東京都中央区日本橋本町4-8-2
電話:03-6626-6251
FAX:03-6626-6261
26. 製造販売業者等
26.1 製造販売元
岩城製薬株式会社
東京都中央区日本橋本町4-8-2