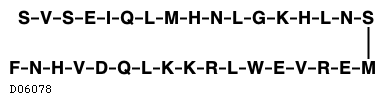医薬品情報
| 総称名 | テリパラチドBS |
|---|---|
| 一般名 | テリパラチド(遺伝子組換え)[テリパラチド後続1] |
| 欧文一般名 | Teriparatide(Genetical Recombination)[Teriparatide Biosimilar 1] |
| 製剤名 | テリパラチド(遺伝子組換え)[テリパラチド後続1] |
| 薬効分類名 | 骨粗鬆症治療剤 |
| 薬効分類番号 | 2439 |
| ATCコード | H05AA02 |
| KEGG DRUG |
D06078
テリパラチド
|
| KEGG DGROUP |
DG00512
テリパラチド
DG03232
骨粗鬆症治療薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年4月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| テリパラチドBS皮下注キット600μg「モチダ」 (後発品) | Teriparatide BS Subcutaneous Injection Kit 600μg MOCHIDA | 持田製薬 | 2439402G1029 | 578.8円/回分 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.2 次に掲げる骨肉腫発生のリスクが高いと考えられる患者[15.2参照]
2.3 原発性の悪性骨腫瘍もしくは転移性骨腫瘍のある患者[症状を悪化させるおそれがある。]
2.4 骨粗鬆症以外の代謝性骨疾患の患者(副甲状腺機能亢進症等)[症状を悪化させるおそれがある。]
2.6 本剤の成分又はテリパラチド酢酸塩に対し過敏症の既往歴のある患者
4. 効能または効果
骨折の危険性の高い骨粗鬆症
5. 効能または効果に関連する注意
本剤の適用にあたっては、低骨密度、既存骨折、加齢、大腿骨頸部骨折の家族歴等の骨折の危険因子を有する患者を対象とすること。
6. 用法及び用量
通常、成人には1日1回テリパラチド(遺伝子組換え)[テリパラチド後続1]として20μgを皮下に注射する。
なお、本剤の投与は24ヵ月間までとすること。
なお、本剤の投与は24ヵ月間までとすること。
7. 用法及び用量に関連する注意
7.2 本剤の投与をやむを得ず一時中断したのちに再投与する場合であっても、投与日数の合計が24ヵ月を超えないこと。また、24ヵ月の投与終了後、再度24ヵ月の投与を繰り返さないこと。
7.3 テリパラチド酢酸塩製剤から本剤に切り替えた臨床試験は実施しておらず、その安全性は確立していない。なお、テリパラチド酢酸塩製剤から本剤に切り替えたときにおける本剤の投与期間の上限は検討されていない。[15.2参照]
7.4 アバロパラチド製剤から本剤に切り替えた臨床試験は実施しておらず、その安全性は確立していない。
8. 重要な基本的注意
8.1 本剤投与直後から数時間後にかけて、ショック、一過性の急激な血圧低下に伴う意識消失、痙攣、転倒があらわれることがある。投与開始後数ヵ月以上を経て初めて発現することもあるので、本剤投与時には以下の点に留意するよう患者に指導すること。
・投与後30分程度はできる限り安静にすること。
・投与後に血圧低下、めまい、立ちくらみ、動悸、気分不良、悪心、顔面蒼白、冷汗等が生じた場合には、症状がおさまるまで座るか横になること。
[11.1.2参照]
8.2 本剤の薬理作用により、投与後約4から6時間を最大として一過性の血清カルシウム値上昇がみられる。また、血清カルシウム値は投与後16時間でほぼ基準値まで下降することが知られているため、本剤投与患者における血清カルシウム値を測定評価する場合は、本剤投与後16時間以降の測定値を評価基準とすること。本剤の投与にあたっては、患者に十分な説明を行い、特に、嘔気・嘔吐、便秘、嗜眠及び筋力低下等の持続性の血清カルシウム値上昇が疑われる症状が認められた場合は、速やかに診察を受けるように指導すること。持続性高カルシウム血症の診断は、血清カルシウム値と測定時点を考慮し、持続性高カルシウム血症と判断された場合は、本剤の投与を中止すること。[2.1、10.2参照]
8.3 起立性低血圧、めまいがあらわれることがあるので、高所での作業、自動車の運転等危険を伴う作業に従事する場合には注意させること。
8.4 本剤の自己注射にあたっては、患者に十分な教育訓練を実施したのち、患者自ら確実に投与できることを確認した上で、医師の管理指導のもとで実施すること。また、器具の安全な廃棄方法について指導を徹底すること。添付されている取扱説明書を必ず読むよう指導すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 尿路結石のある患者及びその既往歴のある患者
症状を悪化させるおそれがある。
9.1.2 心疾患のある患者
患者の状態を観察し、病態の悪化がないか注意しながら本剤を投与すること。副甲状腺ホルモンは血管平滑筋の拡張作用や心筋への陽性変時・陽性変力作用を示すことが報告されている。
9.1.3 閉経前の骨粗鬆症患者
ステロイド性骨粗鬆症以外の閉経前骨粗鬆症患者を対象とした有効性及び安全性を指標とした臨床試験は実施していない1)。
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 重度の肝機能障害患者
臨床試験では重度の肝機能障害患者は除外されている。
9.4 生殖能を有する者
妊娠する可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、本剤投与期間中は有効な避妊を行うよう指導すること。[9.5参照]
9.5 妊婦
9.6 授乳婦
投与しないこと。本剤がヒト乳汁中へ移行するかどうかは不明である。[2.5参照]
9.7 小児等
小児等及び若年者で骨端線が閉じていない患者には投与しないこと。小児等を対象とした臨床試験は実施していないが、これらの患者では、一般に骨肉腫発生のリスクが高いと考えられている。[2.2参照]
9.8 高齢者
一般に高齢者では生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 アナフィラキシー(頻度不明)
アナフィラキシー(呼吸困難、血圧低下、発疹等)があらわれることがある。
11.1.2 ショック(頻度不明)、意識消失(頻度不明)
ショック、一過性の急激な血圧低下に伴う意識消失があらわれることがあり、心停止、呼吸停止を来した症例も報告されている。異常が認められた場合には、適切な処置を行い、次回以降の投与中止を考慮すること。[8.1参照]
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 消化器 | 悪心、上腹部痛 | 腹部不快感、嘔吐、口渇 | 食欲不振、胃炎 |
| 精神神経系 | 頭痛 | 浮動性めまい、体位性めまい、傾眠 | 痙攣、神経過敏 |
| 筋・骨格系 | 筋痙縮 | 関節痛、関節炎、筋肉痛、四肢痛 | |
| 内分泌・代謝系 | 血中尿酸上昇、高尿酸血症、ALP上昇 | 血中カリウム上昇 | 高カルシウム血症 |
| 循環器 | 血圧低下、動悸 | 心電図ST部分下降、心電図T波振幅減少 | |
| 皮膚 | 発疹 | そう痒症、紅斑 | |
| 腎臓 | 血中クレアチニン上昇、血中尿素上昇 | 腎結石症 | 頻尿 |
| 呼吸器 | 呼吸困難 | ||
| 眼 | 結膜出血 | ||
| 肝臓 | 肝機能異常(AST上昇、ALT上昇、γ-GTP上昇) | ||
| 血液 | 白血球数増加 | ||
| 注射部位 | 注射部位反応(紅斑、血腫、疼痛、硬結、そう痒感、変色、腫脹等) | ||
| 過敏症 | 口腔粘膜浮腫、顔面浮腫、全身性蕁麻疹 | ||
| その他 | 脱力感 | 胸痛、背部痛、胸部不快感、ほてり、倦怠感、熱感 |
13. 過量投与
13.1 症状
遅延型の高カルシウム血症、起立性低血圧、悪心、嘔吐、めまい、頭痛、脱力/嗜眠及び低血圧が起こる可能性がある。
13.2 処置
特異的解毒剤はない。血清カルシウム値の測定、輸液等の適切な処置を行う。
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 本剤は皮下注射のみに使用し、注射部位を腹部及び大腿部とし、広範に順序よく移動して注射すること。
14.1.2 本剤はJIS T 3226-2に準拠したA型専用注射針を用いて使用すること。本剤はA型専用注射針との適合性の確認をBDマイクロファインプラス及びナノパスニードルIIで行っている。
14.1.3 本剤とA型専用注射針との装着時に液漏れ等の不具合が認められた場合には、新しい注射針に取り替えるなどの処置方法を患者に十分指導すること。
14.1.4 1本を複数の患者に使用しないこと。
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
<本剤>
16.1.1 単回投与(生物学的同等性試験)
閉経前健康成人女性51例に、本剤とFORSTEO(欧州で承認されたテリパラチド(遺伝子組換え)製剤)をクロスオーバー法により、それぞれ20μgを単回皮下投与したときの血漿中テリパラチド濃度を測定した。薬物動態パラメータ(Cmax、AUC0-t)の幾何平均比の両側94.12%信頼区間は、80.00〜125.00%の範囲内であり、両剤の同等性が確認された3)(外国人データ)。
閉経前健康成人女性に本剤及びFORSTEOをそれぞれ20μg単回皮下投与したときの血漿中テリパラチド濃度推移(外国人データ)
| Cmax(pg/mL)c) | AUC0-t(pg・hr/mL)c) | tmax(hr)d) | t1/2(hr)e) | |
| 本剤(n=51)a) | 82.4(40.1) | 91.8(40.9) | 0.334(0.166、0.585) | 0.701±0.287 |
| FORSTEO(n=51)b) | 89.2(37.1) | 99.0(35.0) | 0.417(0.167、0.667) | 0.757±0.285 |
<フォルテオ皮下注キット600μg>
16.1.2 単回投与
日本人閉経後健康女性18例にテリパラチド10、20、40、60μgを単回皮下投与注1)したときの血清中テリパラチド濃度は、投与0.25時間(tmaxの中央値)にピークに達した後、速やかに消失した。消失半減期は1時間未満であった4)。
| AUC0-t(pg・hr/mL)a) | Cmax(pg/mL)a) | tmax(hr)b) | t1/2(hr)c) |
| 222(53.0) | 227(35.7) | 0.25(0.25-0.75) | 0.708(0.479-1.21) |
外国人健康成人22例(男性11例、女性11例)にテリパラチド20μgを単回皮下投与したときのAUC0-∞及びCmaxは、男性被験者でそれぞれ229pg・hr/mL及び112.7pg/mLであり、女性被験者ではそれぞれ281pg・hr/mL及び125.7pg/mLであった5)。
16.1.3 反復投与
外国人閉経後健康女性24例にテリパラチド40μgを14日間1日1回反復皮下投与注1)したとき、投与1日目(18例)及び14日目(16例)のCmaxはそれぞれ479pg/mL、438pg/mL、投与後2.5時間までのAUCはそれぞれ802pg・hr/mL、767pg・hr/mLであり、蓄積性は認められなかった6)。
第II相臨床試験でテリパラチド10、20又は40μgを投与注1)された日本人閉経後骨粗鬆症患者94例から得た血清中テリパラチド濃度データを用いて、母集団薬物動態解析により薬物動態パラメータを推定した7)。テリパラチド20μgを皮下投与したときのAUC及びCmaxはそれぞれ373.7pg・hr/mL及び229.5pg/mLと推定された。体重はテリパラチドの薬物動態に有意な影響を及ぼすと推定され、体重が増加するに従いCmaxは低下すると予測された。
第II相臨床試験でテリパラチド10、20又は40μgを投与注1)された日本人閉経後骨粗鬆症患者94例から得た血清中テリパラチド濃度データを用いて、母集団薬物動態解析により薬物動態パラメータを推定した7)。テリパラチド20μgを皮下投与したときのAUC及びCmaxはそれぞれ373.7pg・hr/mL及び229.5pg/mLと推定された。体重はテリパラチドの薬物動態に有意な影響を及ぼすと推定され、体重が増加するに従いCmaxは低下すると予測された。
| パラメータ | 母集団パラメータ推定値 | 個体間変動 |
| 吸収速度定数 Ka(hr−1) | 17.5 | − |
| 見かけのクリアランスCL/F(L/hr) | 54.3 | 28.9% |
| 見かけの分布容積V/F(L) | 80.1 | 36.5% |
| V/Fに対する体重の影響a) | 1.62 | |
| CL/FとV/Fの相互作用の項 | 0.0606 | |
| 残差変動(比例誤差) | 25.9% | |
日本人閉経後骨粗鬆症患者にテリパラチド20μgを皮下投与したときの血清中テリパラチド濃度推移の予測
16.2 吸収
<フォルテオ皮下注キット600μg>
外国人健康成人22例(男性11例、女性11例)にテリパラチド20、40及び80μgを単回皮下投与注1)、並びに17.54μgを単回静脈内投与注1)したときの血清中テリパラチド濃度を用い、母集団薬物動態解析により推定したテリパラチドを皮下投与したときの絶対的バイオアベイラビリティは、約95%であった5)。また、外国人骨粗鬆症患者360例(女性)及び251例(男性)を対象とした母集団薬物動態解析により投与部位による違いを検討した結果、腹部に皮下注射するときに比べ、大腿部に皮下注射したときにCmaxが約15〜20%低下すると推定されたが、CL/Fに投与部位による有意な差は認められず、AUCに差はないと推測された8)9)。
16.6 特定の背景を有する患者
<フォルテオ皮下注キット600μg>
16.6.1 心不全の患者
軽度及び中等度の心不全注2)を有する外国人患者13例(男性5例、女性8例)にテリパラチド20μgを皮下投与したときのCmaxは118.9pg/mL、AUC0-tは135.9pg・hr/mLであった10)。
16.6.2 腎機能障害患者
外国人の軽度及び中等度の腎機能障害患者(クレアチニンクリアランス:31〜75mL/min)12例(男性7例、女性5例)にテリパラチド40μgを単回皮下投与注1)したときのCmaxは228.6pg/mL、AUC0-tは326.6pg・hr/mL及びt1/2は1.18hrであり、腎機能が正常な被験者(クレアチニンクリアランス:90mL/min以上)9例(男性5例、女性4例)のCmax(222.8pg/mL)、AUC0-t(321.7pg・hr/mL)及びt1/2(1.14hr)と同様であった。一方、重度の腎機能障害患者(クレアチニンクリアランス:30mL/min以下)5例(男性3例、女性2例)にテリパラチド40μgを単回皮下投与注1)したときのCmaxは227.7pg/mL、AUC0-tは555.8pg・hr/mL及びt1/2は2.02hrであり、腎機能が正常な被験者と比べてAUC0-t及びt1/2はそれぞれ73%、77%増加した11)。[9.2.1参照]
注1)本剤の承認された用法及び用量は「テリパラチド(遺伝子組換え)[テリパラチド後続1]として1日1回20μg皮下投与」である。
注2)ニューヨーク心臓協会(NYHA;New York Heart Association)心機能分類のクラス1〜3
17. 臨床成績
17.1 有効性及び安全性に関する試験
<本剤>
17.1.1 国内第III相試験
骨折の危険性の高い骨粗鬆症患者250例(うち男性9例)を対象とした、実薬対照評価者盲検比較試験において、本剤又はフォルテオ皮下注キット600μgそれぞれ20μg/日を52週間投与した結果、主要エンドポイントである投与期52週時の腰椎(L2〜L4)骨密度変化率(平均値±標準偏差)は、本剤及びフォルテオ皮下注キット600μg投与群で、8.94±6.19%及び9.65±6.22%であり、群間差(調整済み)[両側95%信頼区間]は−0.65%[−2.17〜0.87%]であった。この両側95%信頼区間は、同等性許容域±2.8%の範囲内に含まれており、両剤の有効性の同等性が確認された。
副作用発現頻度(臨床検査値異常を含む)は、本剤投与群で47.2%(59/125例)、フォルテオ皮下注キット600μg投与群で45.6%(57/125例)であった。本剤投与群の主な副作用は、注射部位紅斑10.4%(13/125例)、注射部位内出血8.8%(11/125例)、悪心7.2%(9/125例)、血中尿酸上昇6.4%(8/125例)、ALP上昇5.6%(7/125例)、頭痛5.6%(7/125例)、注射部位出血3.2%(4/125例)であった12)。[7.1参照]
副作用発現頻度(臨床検査値異常を含む)は、本剤投与群で47.2%(59/125例)、フォルテオ皮下注キット600μg投与群で45.6%(57/125例)であった。本剤投与群の主な副作用は、注射部位紅斑10.4%(13/125例)、注射部位内出血8.8%(11/125例)、悪心7.2%(9/125例)、血中尿酸上昇6.4%(8/125例)、ALP上昇5.6%(7/125例)、頭痛5.6%(7/125例)、注射部位出血3.2%(4/125例)であった12)。[7.1参照]
<フォルテオ皮下注キット600μg>
17.1.2 国内第III相試験(GHDB試験)
骨折の危険性の高い骨粗鬆症患者203例(うち男性9例)を対象とした、プラセボ対照二重盲検比較試験において、プラセボ又はテリパラチド20μg/日を12ヵ月間(52週間)投与した結果、最終観察時におけるプラセボ群及びテリパラチド20μg群の腰椎(L2-L4)骨密度平均変化率はそれぞれ0.04%及び9.82%であり、プラセボ群と比較して統計学的に有意であった(p<0.001、2標本t検定)13)。テリパラチド20μg群においては24ヵ月まで投与を継続し、腰椎(L2-L4)骨密度平均変化率は12ヵ月(52週)時点の10.04%から、18ヵ月(76週)時点では11.93%、24ヵ月(104週)時点では13.42%となった。
安全性評価対象であるテリパラチド20μg群136例中23例(16.9%)に副作用が認められた。主な副作用は血中ALP増加5例(3.7%)、血中尿酸増加3例(2.2%)、高尿酸血症3例(2.2%)であった。[7.1参照]
安全性評価対象であるテリパラチド20μg群136例中23例(16.9%)に副作用が認められた。主な副作用は血中ALP増加5例(3.7%)、血中尿酸増加3例(2.2%)、高尿酸血症3例(2.2%)であった。[7.1参照]
17.1.3 外国第III相試験(GHAC試験)
骨折の危険性の高い閉経後骨粗鬆症女性1,637例を対象としたプラセボ対照二重盲検比較試験において、プラセボ、テリパラチド20μg/日又はテリパラチド40μg/日を19ヵ月間(中央値)投与した。その結果、主要評価項目である新規椎体骨折の最終観察時における骨折発生割合はプラセボ群14.3%及びテリパラチド20μg群5.0%で、テリパラチド20μg群はプラセボ群と比較して統計学的に有意であった。更に、他の骨折に関して、2個以上の新規椎体骨折、新規非椎体骨折及び新規非外傷性非椎体骨折の最終観察時における骨折の発生状況を下表に示す。
最終観察時におけるプラセボ群及びテリパラチド20μg群の腰椎(L1-L4)骨密度平均変化率はそれぞれ1.13%及び9.70%であり、プラセボ群と比較して統計学的に有意であった(p<0.001、分散分析モデルにおける2群比較)14)。12ヵ月時点のテリパラチド20μg群の腰椎(L1-L4)骨密度平均変化率は8.26%、18ヵ月時点では10.31%であった。
最終観察時におけるプラセボ群及びテリパラチド20μg群の腰椎(L1-L4)骨密度平均変化率はそれぞれ1.13%及び9.70%であり、プラセボ群と比較して統計学的に有意であった(p<0.001、分散分析モデルにおける2群比較)14)。12ヵ月時点のテリパラチド20μg群の腰椎(L1-L4)骨密度平均変化率は8.26%、18ヵ月時点では10.31%であった。
| プラセボ群 | テリパラチド20μg群 | 相対リスク(95%信頼区間) | 相対リスク減少率 | |
| 新規椎体骨折 | 14.3%(64/448a)) | 5.0%(22/444a)) p<0.001b) | 0.347(0.218,0.553) | 65% |
| 2個以上の新規椎体骨折 | 4.9%(22/448a)) | 1.1%(5/444a)) p=0.001b) | 0.229(0.088,0.600) | 77% |
| 新規非椎体骨折 | 9.7%(53/544) | 6.3%(34/541) p=0.036b) | 0.645(0.426,0.976) | 35% |
| 新規非外傷性非椎体骨折c) | 5.5%(30/544) | 2.6%(14/541) p=0.015b) | 0.469(0.252,0.875) | 53% |
安全性評価対象であるテリパラチド20μg群541例中、主な副作用は悪心26例(4.8%)、浮動性めまい18例(3.3%)、関節痛17例(3.1%)、四肢痛15例(2.8%)、頭痛12例(2.2%)であった。[7.1参照]
18. 薬効薬理
18.1 作用機序
テリパラチドは内因性のヒト副甲状腺ホルモンのN末端フラグメントであり、34個のアミノ酸で構成されている。1日1回の投与頻度で間欠的に投与すると、主として以下の作用により、骨梁並びに皮質骨の内膜及び外膜面において骨芽細胞機能が活性化され、破骨細胞機能を上回るため、骨新生が誘発される15)16)。
・前駆細胞から骨芽細胞への分化を促進する。
・骨芽細胞のアポトーシスを抑制する。
一方、テリパラチドを持続的に皮下投与すると、骨吸収が骨形成を上回るため、結果として骨量減少が生じる。
18.2 副甲状腺ホルモン受容体に対する結合活性
<本剤>
本剤のヒト副甲状腺ホルモン受容体に対する結合活性はFORSTEO(欧州で承認されたテリパラチド(遺伝子組換え)製剤)と同程度であった17)(in vitro)。
18.3 細胞内環状アデノシン一リン酸(cAMP)産生促進活性
<本剤>
本剤はラット骨肉腫細胞株UMR-106及びヒト骨肉腫細胞株Saos-2において細胞内のcAMP産生を促進し、その促進活性はFORSTEO(欧州で承認されたテリパラチド(遺伝子組換え)製剤)と同程度であった17)(in vitro)。
18.4 骨密度低下改善作用
<本剤>
本剤は反復投与(皮下)することにより、卵巣摘出雌ラットにおいて大腿骨遠位部骨幹端(全骨及び海綿骨)の骨密度の低下を改善し、その程度はフォルテオ皮下注キット600μgと同様であった18)。
18.5 骨密度及び骨強度に対する作用
<フォルテオ皮下注キット600μg>
18.6 骨質に対する作用
<フォルテオ皮下注キット600μg>
卵巣切除雌ラットにテリパラチド8又は40μg/kg/日を6ヵ月間反復皮下投与した結果、海綿骨の結合性あるいは骨質に関連するパラメータに改善が認められた19)。
19. 有効成分に関する理化学的知見
19.1. テリパラチド(遺伝子組換え)[テリパラチド後続1]
20. 取扱い上の注意
20.1 保存時
本剤は使用開始後も冷蔵庫に入れ、凍結を避け、2〜8℃で遮光保存すること。
20.2 使用日数
本剤は28日用である。使用開始日より28日を超えて使用しないこと。
22. 包装
キット
2.4mL×1本
23. 主要文献
- Saag,K.G.et al., Arthritis.Rheum., 60 (11), 3346-3355, (2009) »PubMed »DOI
- Nakano,M.et al., 臨床薬理, 44 (5), 395-403, (2013) »DOI
- 持田製薬社内資料:海外第I相試験
- フォルテオ皮下注キット600μg申請資料概要:日本人及び外国人における単回投与試験(2010年7月23日承認、CTD 2.7.2.2.2.1)
- フォルテオ皮下注キット600μg申請資料概要:絶対的バイオアベイラビリティ及び薬物動態に対する性別の影響(2010年7月23日承認、CTD 2.7.2.2.4.1)
- フォルテオ皮下注キット600μg申請資料概要:外国人における反復投与試験(2010年7月23日承認、CTD 2.7.2.2.2.3)
- フォルテオ皮下注キット600μg申請資料概要:日本人女性患者における母集団薬物動態解析(2010年7月23日承認、CTD 2.7.2.2.3.1)
- フォルテオ皮下注キット600μg申請資料概要:外国人女性患者における母集団薬物動態及び薬力学解析(2010年7月23日承認、CTD 2.7.2.2.3.2)
- フォルテオ皮下注キット600μg申請資料概要:外国人男性患者における母集団薬物動態解析(2010年7月23日承認、CTD 2.7.2.2.3.3)
- フォルテオ皮下注キット600μg申請資料概要:外国人心疾患患者を対象とした第I相試験(2010年7月23日承認、CTD 2.7.2.2.4.3)
- フォルテオ皮下注キット600μg申請資料概要:薬物動態に対する腎障害の影響及びフロセミドとの薬物相互作用(2010年7月23日承認、CTD 2.7.2.2.4.2)
- 持田製薬社内資料:国内第III相試験
- Miyauchi,A.et al., Bone., 47 (3), 493-502, (2010) »PubMed »DOI
- Neer,R.M.et al., N.Engl.J.Med., 344 (19), 1434-1441, (2001) »PubMed »DOI
- Hock,J.M., J.Musculoskel.Neuron.Interact., 2 (1), 33-47, (2001)
- Jilka,R.L., Bone., 40 (6), 1434-1446, (2007) »PubMed »DOI
- 持田製薬社内資料:薬理試験−in vitro薬理試験−
- 持田製薬社内資料:薬理試験−ラット卵巣摘出モデルにおける有効性の検討−
- Sato,M.et al., Endocrinology., 138 (10), 4330-4337, (1997) »PubMed »DOI
- フォルテオ皮下注キット600μg申請資料概要:卵巣切除した成熟雌性カニクイザルを用いた18ヵ月反復投与試験(2010年7月23日承認、CTD 2.6.2.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
持田製薬株式会社
くすり相談窓口
〒160-8515
東京都新宿区四谷1丁目7番地
電話:03-5229-3906
0120-189-522
0120-189-522
FAX:03-5229-3955
製品情報問い合わせ先
持田製薬株式会社
くすり相談窓口
〒160-8515
東京都新宿区四谷1丁目7番地
電話:03-5229-3906
0120-189-522
0120-189-522
FAX:03-5229-3955
26. 製造販売業者等
26.1 製造販売元
持田製薬株式会社
東京都新宿区四谷1丁目7番地