医薬品情報
| 総称名 | ノクサフィル |
|---|---|
| 一般名 | ポサコナゾール |
| 欧文一般名 | Posaconazole |
| 製剤名 | ポサコナゾール注射液 |
| 薬効分類名 | 深在性真菌症治療剤 |
| 薬効分類番号 | 6179 |
| ATCコード | J02AC04 |
| KEGG DRUG |
D02555
ポサコナゾール
|
| KEGG DGROUP |
DG01523
トリアゾール系抗真菌薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第11版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ノクサフィル点滴静注300mg | NOXAFIL for Intravenous Infusion 300mg | MSD | 6179403A1028 | 26520円/瓶 | 劇薬, 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
2.1 エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、メチルエルゴメトリン、エルゴメトリン、シンバスタチン、アトルバスタチン、ピモジド、キニジン、ベネトクラクス[再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)、再発又は難治性のマントル細胞リンパ腫の用量漸増期]、スボレキサント、ダリドレキサント塩酸塩、フィネレノン、エプレレノン、アゼルニジピン、オルメサルタン メドキソミル・アゼルニジピン、マバカムテン、ロナファルニブ、ルラシドン塩酸塩、ブロナンセリン、ボクロスポリン、トリアゾラム、リバーロキサバンを投与中の患者[10.1参照]
2.2 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
○造血幹細胞移植患者又は好中球減少が予測される血液悪性腫瘍患者における深在性真菌症の予防
○下記の真菌症の治療
5. 効能または効果に関連する注意
<真菌症(侵襲性アスペルギルス症、フサリウム症、ムーコル症、コクシジオイデス症、クロモブラストミコーシス、菌腫)の治療>
5.1 本剤を投与する前に、原因真菌を分離及び同定するための真菌培養、病理組織学的検査等の他の検査のための試料を採取すること。培養等の検査の結果が得られる前に薬物療法を開始する場合でも、検査の結果が明らかになった時点でそれに応じた抗真菌剤による治療を再検討すること。
<真菌症(フサリウム症、ムーコル症、コクシジオイデス症、クロモブラストミコーシス、菌腫)の治療>
5.2 他の抗真菌剤が無効あるいは忍容性に問題があると考えられる場合に本剤の使用を考慮すること。
6. 用法及び用量
通常、成人にはポサコナゾールとして初日は1回300mgを1日2回、2日目以降は300mgを1日1回、中心静脈ラインから約90分間かけて緩徐に点滴静注する。
7. 用法及び用量に関連する注意
<効能共通>
7.1 錠剤と静注液は医師の判断で切り替えて使用することができる。ただし、臨床試験において静注液の長期投与の経験は限られており、静注液の添加剤スルホブチルエーテルβ-シクロデキストリンナトリウムは腎機能障害のある患者で蓄積し、腎機能の悪化等を引き起こすおそれがあることから、静注液の投与は最小限の期間とし、経口投与可能な患者には、錠剤を選択すること。[9.2.1参照]
<造血幹細胞移植患者又は好中球減少が予測される血液悪性腫瘍患者における深在性真菌症の予防>
7.2 投与期間は好中球減少症又は免疫抑制からの回復に基づき設定すること。急性骨髄性白血病又は骨髄異形成症候群の患者では、好中球減少症の発症が予測される数日前に本剤による予防を開始し、好中球数が500cells/mm3以上に増加後、7日間程度投与を継続すること。
<真菌症(侵襲性アスペルギルス症、フサリウム症、ムーコル症、コクシジオイデス症、クロモブラストミコーシス、菌腫)の治療>
7.3 投与期間は基礎疾患の状態、免疫抑制からの回復及び臨床効果に基づき設定すること。
8. 重要な基本的注意
8.2 QT延長、心室頻拍(Torsade de pointesを含む)があらわれることがあるので、本剤の投与前及び投与中は定期的に心電図検査及び電解質検査(カリウム、マグネシウム、カルシウム等)を行い、必要に応じて電解質を補正すること。[11.1.3参照]
8.3 本剤投与開始にあたっては、あらかじめワルファリン服用の有無を確認し、ワルファリンと併用する場合は、プロトロンビン時間測定及びトロンボテストの回数を増やすなど慎重に投与すること。[10.2参照]
8.4 本剤の投与に際しては、アレルギー歴、薬物過敏症等について十分な問診を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 他のアゾール系抗真菌剤に対し薬物過敏症の既往歴のある患者
類似の化学構造を有しており、交差過敏反応を起こすおそれがある。
9.1.2 重篤な基礎疾患(血液悪性腫瘍等)のある患者
9.1.3 体重120kgを超える患者
本剤の投与中は、真菌症の発症の有無を注意深くモニタリングするなど患者の状態を慎重に観察すること。[16.6.1参照]
9.2 腎機能障害患者
9.2.1 中等度以上(eGFR<50mL/min/1.73m2)の腎機能障害のある患者
治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。投与する場合には血清クレアチニン値を観察し、上昇が認められた場合には錠剤への切り替えを考慮すること。添加剤スルホブチルエーテルβ-シクロデキストリンナトリウムが蓄積し、腎機能障害を悪化させるおそれがある。[7.1参照]
9.2.2 重度(eGFR<20mL/min/1.73m2)の腎機能障害のある患者
本剤の投与中は、真菌症の発症の有無を注意深くモニタリングするなど患者の状態を慎重に観察すること。本剤の曝露量が大きくばらつくおそれがある。[16.6.2参照]
9.4 生殖能を有する者
妊娠可能な女性に対しては、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ラットにおいて、臨床曝露量(AUC)と同程度の曝露量で、分娩障害、出生児数の減少、生存率低下、催奇形性が認められた。ウサギでは、臨床曝露量(AUC)を上回る曝露量で、吸収胚の増加及び胎児数の減少が認められた。[9.4参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ラットで乳汁中への移行が報告されている。
9.7 小児等
小児等を対象とした国内臨床試験は実施していない。
10. 相互作用
相互作用序文
薬物代謝酵素用語
UDP-グルクロノシルトランスフェラーゼ(UGT)1A4
薬物代謝酵素用語
P-糖蛋白(P-gp)
薬物代謝酵素用語
CYP3A4
10.1 併用禁忌
| エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン(クリアミン配合錠) ジヒドロエルゴタミン メチルエルゴメトリン(パルタンM) エルゴメトリン [2.1参照] | 麦角中毒を引き起こすおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| シンバスタチン(リポバス) アトルバスタチン(リピトール) [2.1、16.7.2参照] | 横紋筋融解症を引き起こすおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| ピモジド(オーラップ) キニジン(硫酸キニジン) [2.1参照] | QT延長、心室頻拍(Torsade de pointesを含む)等の心血管系の重篤な副作用を引き起こすおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| ベネトクラクス[再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)、再発又は難治性のマントル細胞リンパ腫の用量漸増期](ベネクレクスタ) [2.1参照] | 腫瘍崩壊症候群の発現を増強させるおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| スボレキサント(ベルソムラ) [2.1参照] | スボレキサントの作用を著しく増強させるおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| ダリドレキサント塩酸塩(クービビック) [2.1参照] | ダリドレキサント塩酸塩の作用を増強させるおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| フィネレノン(ケレンディア) エプレレノン(セララ) [2.1参照] | これらの薬剤の作用を増強させるおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| アゼルニジピン(カルブロック) オルメサルタン メドキソミル・アゼルニジピン(レザルタス配合錠) [2.1参照] | アゼルニジピンの作用を増強させるおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| マバカムテン(カムザイオス) [2.1参照] | マバカムテンの副作用を増強させ、収縮機能障害による心不全の危険性を増大させるおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| ロナファルニブ(ゾキンヴィ) [2.1参照] | ロナファルニブの作用を増強させるおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| ルラシドン塩酸塩(ラツーダ) ブロナンセリン(ロナセン) [2.1参照] | これらの薬剤の作用を増強させるおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血中濃度が上昇すると予測される。 |
| ボクロスポリン(ルプキネス) [2.1参照] | これらの薬剤の作用を増強させるおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血中濃度が上昇すると予測される。 |
| トリアゾラム(ハルシオン) [2.1参照] | トリアゾラムの作用の増強及び作用時間の延長を起こすおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血中濃度が上昇すると予測される。 |
| リバーロキサバン(イグザレルト) [2.1参照] | リバーロキサバンの抗凝固作用を増強させ、出血の危険性を増大させるおそれがある。 | ポサコナゾールの併用により、CYP3A4が阻害され、またP-gpも阻害される可能性があるため、リバーロキサバンの血漿中濃度が上昇すると予測される。 |
10.2 併用注意
| リファブチン [16.7.2参照] | 治療上の有益性が危険性を上回る場合を除き、リファブチンとの併用は避けること。やむを得ず併用する場合は、真菌症の発症の有無、全血球数の推移及びリファブチンの血漿中濃度上昇に伴う副作用(ぶどう膜炎等)を注意深くモニタリングするなど患者の状態を慎重に観察すること。 | リファブチンの併用により、ポサコナゾールのクリアランスが亢進し、ポサコナゾールの血漿中濃度が低下する。ポサコナゾールが基質となるUGT1A4及び/又はP-gpに対するリファブチンの誘導作用が関与している可能性がある。 ポサコナゾールの併用により、CYP3A4が阻害され、リファブチンの血漿中濃度が上昇する。 |
| フェニトイン [16.7.2参照] | 治療上の有益性が危険性を上回る場合を除き、フェニトインとの併用は避けること。やむを得ず併用する場合は、真菌症の発症の有無を注意深くモニタリングするなど患者の状態を慎重に観察すること。 | フェニトインの併用により、ポサコナゾールのクリアランスが亢進し、ポサコナゾールの血漿中濃度が低下する。ポサコナゾールが基質となるUGT1A4及び/又はP-gpに対するフェニトインの誘導作用が関与している可能性がある。 |
| ビンカアルカロイド系抗悪性腫瘍剤 ビンクリスチン ビンブラスチン等 | 神経毒性、痙攣発作、末梢性ニューロパチー、抗利尿ホルモン不適合分泌症候群、麻痺性イレウス等の重篤な副作用を引き起こすおそれがある。ビンカアルカロイド系抗悪性腫瘍剤の投与を受けている患者は、他の抗真菌剤を使用できない場合を除き、ポサコナゾールを含むアゾール系抗真菌剤の併用を避けること。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| ベネトクラクス[再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の維持投与期、再発又は難治性のマントル細胞リンパ腫の維持投与期、急性骨髄性白血病] | 併用する場合は、ベネトクラクスを減量するとともに、患者の状態を慎重に観察し、ベネトクラクスに関連した副作用発現に十分に注意すること。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| 免疫抑制剤 シクロスポリン タクロリムス シロリムス [16.7.2参照] | 併用する場合は、これらの薬剤を減量することを考慮するとともに、患者の状態を慎重に観察し、副作用発現に十分に注意すること。併用中及び中止時には、これらの薬剤の血中濃度をモニタリングし、これらの薬剤の用量を調節すること。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血中濃度が上昇する。 |
| CYP3A4によって代謝されるベンゾジアゼピン系薬剤 ミダゾラム アルプラゾラム等 [16.7.2参照] | 鎮静の延長や呼吸抑制のおそれがあるため、CYP3A4によって代謝されるベンゾジアゼピン系薬剤(ミダゾラム、アルプラゾラム等)とポサコナゾールとの併用は、治療上の有益性が危険性を上回る場合を除き避けること。併用する場合には、これらの薬剤の用量を調節すること。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| CYP3A4によって代謝されるカルシウム拮抗剤 ベラパミル ジルチアゼム ニフェジピン等 | 併用する場合は、これらの薬剤に関連した副作用発現に十分に注意すること。また、必要に応じてこれらの薬剤の用量を調節すること。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| CYP3A4によって代謝される抗HIV剤 アタザナビル等 [16.7.2参照] | 併用する場合は、これらの薬剤に関連した副作用発現に十分に注意すること。 | ポサコナゾールの併用により、CYP3A4が阻害され、これらの薬剤の血漿中濃度が上昇すると予測される。 |
| 抗HIV剤 エファビレンツ ホスアンプレナビル [16.7.2参照] | 治療上の有益性が危険性を上回る場合を除き、これらの薬剤との併用は避けること。やむを得ず併用する場合は、真菌症の発症の有無を注意深くモニタリングするなど患者の状態を慎重に観察すること。 | これらの薬剤の併用により、ポサコナゾールのクリアランスが亢進し、ポサコナゾールの血漿中濃度が低下する。ポサコナゾールが基質となるUGT1A4及び/又はP-gpに対するこれらの薬剤の誘導作用が関与している可能性がある。 |
| ジゴキシン | 併用する場合は、併用開始時及び中止時にジゴキシンの血漿中濃度をモニタリングすること。 | ポサコナゾールの併用により、ジゴキシンの血漿中濃度が上昇するおそれがある。ポサコナゾールによるP-gpの阻害作用が関与している可能性がある。 |
| ワルファリン [8.3参照] | ワルファリンの作用が増強し、著しいINR上昇があらわれることがある。 | アゾール系抗真菌剤でINR上昇が報告されている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害
11.1.2 溶血性尿毒症症候群(HUS)、血栓性血小板減少性紫斑病(TTP)(いずれも頻度不明)
11.1.3 QT延長(1.4%)、心室頻拍(Torsade de pointesを含む)(頻度不明)[8.2参照]
11.1.4 副腎機能不全(0.1%)
11.1.5 低カリウム血症(4.7%)
11.1.6 皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)
11.1.7 脳卒中(頻度不明)
11.1.8 急性腎障害(0.4%)、腎不全(0.2%)
11.1.9 汎血球減少症(0.1%)、白血球減少症(頻度不明)
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 血液及びリンパ系障害 | 貧血、発熱性好中球減少症、好中球減少症、脾臓梗塞、血小板減少症、骨髄機能不全 | 好酸球増加症、リンパ節症、凝血異常、出血 | |
| 心臓障害 | 心房粗動、徐脈、洞性徐脈、上室性期外収縮、頻脈 | 心電図異常、動悸 | |
| 耳及び迷路障害 | 聴力障害 | ||
| 内分泌障害 | 血中ヒト絨毛性ゴナドトロピン減少、偽アルドステロン症 | ||
| 眼障害 | 複視、羞明、霧視、視力低下、脈絡膜硬化症、光視症 | 暗点 | |
| 胃腸障害 | 悪心、下痢 | 腹部不快感、腹部膨満、腹痛、肛門直腸不快感、便秘、口内乾燥、消化不良、小腸炎、心窩部不快感、おくび、軟便、鼓腸、胃炎、胃食道逆流性疾患、口唇乾燥、口腔腫脹、口腔内潰瘍形成、口腔障害、口腔知覚不全、レッチング、口内炎、嘔吐、腹部圧痛、腹水、胃腸障害 | 膵炎、口腔浮腫、胃腸出血、イレウス |
| 一般・全身障害及び投与部位の状態 | 無力症、胸部不快感、胸痛、悪寒、疲労、びくびく感、注入部位疼痛、注入部位静脈炎、注入部位血栓、倦怠感、粘膜の炎症、浮腫、末梢性浮腫、末梢腫脹、発熱、口渇、歩行障害 | 疼痛、舌浮腫、顔面浮腫 | |
| 肝胆道系障害 | 肝機能異常、高ビリルビン血症、黄疸眼 | 肝圧痛、固定姿勢保持困難 | |
| 免疫系障害 | 移植片対宿主病 | 過敏症 | |
| 感染症及び寄生虫症 | アスペルギルス感染、細菌感染、蜂巣炎、毛包炎、歯肉膿瘍、喉頭炎、咽頭炎、肺炎、肺真菌症、コリネバクテリウム感染、単純ヘルペス | ||
| 傷害、中毒及び処置合併症 | 皮膚擦過傷 | ||
| 臨床検査 | ALT増加 | AST増加、血中Al-P増加、血中ビリルビン増加、血中クレアチニン増加、血中LDH増加、血中マグネシウム減少、血中リン減少、血中カリウム減少、CRP増加、胸部X線異常、心電図QT間隔異常、心電図ST部分上昇、心電図異常T波、心電図T波逆転、γ-GTP増加、肝酵素上昇、肝機能検査異常、肝機能検査値上昇、血小板数減少、QRS軸異常、トランスアミナーゼ上昇、体重減少、白血球数減少、血圧上昇、ヘモグロビン減少、後骨髄球数増加、血小板数増加 | |
| 代謝及び栄養障害 | 食欲減退、水分過負荷、低カルシウム血症、低血糖、低マグネシウム血症、低ナトリウム血症、低リン酸血症、マグネシウム欠乏、高カリウム血症、食欲亢進 | 電解質失調、食欲不振、高血糖 | |
| 筋骨格系及び結合組織障害 | 関節痛、関節炎、四肢腫瘤、筋骨格痛、頚部痛、四肢痛、背部痛 | ||
| 良性、悪性及び詳細不明の新生物 (嚢胞及びポリープを含む) | 骨髄異形成症候群 | ||
| 神経系障害 | 失語症、浮動性めまい、味覚不全、頭痛、灼熱感、認知障害、意識レベルの低下、脳症、痙攣発作、傾眠、味覚障害 | 錯感覚、ニューロパチー、感覚鈍麻、振戦、末梢性ニューロパチー、失神 | |
| 精神障害 | 異常な夢、錯乱状態、不眠症、睡眠障害、幻覚、幻視、悪夢 | 精神病性障害、うつ病 | |
| 腎及び尿路障害 | 慢性腎臓病、緊張性膀胱、腎機能障害 | 腎尿細管性アシドーシス、間質性腎炎 | |
| 生殖系及び乳房障害 | 骨盤液貯留 | 月経障害、乳房痛 | |
| 呼吸器、胸郭及び縦隔障害 | 咳嗽、鼻出血、しゃっくり、鼻閉、口腔咽頭痛、胸水、胸膜痛、湿性咳嗽、呼吸不全、頻呼吸、鼻粘膜障害 | 肺高血圧症 | |
| 皮膚及び皮下組織障害 | 皮膚炎、ざ瘡様皮膚炎、全身性剥脱性皮膚炎、皮膚乾燥、紅斑、点状出血、そう痒症、発疹、斑状皮疹、斑状丘疹状皮疹、麻疹様発疹、そう痒性皮疹、皮膚病変、中毒性皮疹、じん麻疹、寝汗 | 脱毛症、小水疱性皮疹 | |
| 血管障害 | 高血圧、低血圧、起立性低血圧、血栓性静脈炎、血管炎 |
13. 過量投与
ポサコナゾールは血液透析で除去されない。[16.6.2参照]
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は静脈内投与の前に希釈すること。
14.1.2 バイアルを室温に戻した後、バイアルから16.7mL抜き取り、150〜283mLの生理食塩液又は5%ブドウ糖注射液が入った点滴バッグ又はボトルに添加し、最終濃度を1〜2mg/mLとする。
14.1.3 以下の希釈液とは配合変化を起こすので使用しないこと。
乳酸リンゲル液、5%ブドウ糖加乳酸リンゲル液、4.2%炭酸水素ナトリウム注射液
14.1.4 本剤は保存剤を含まないため、希釈後は速やかに使用すること。速やかに使用しない場合は、冷蔵保存(2〜8℃)し、24時間以内に使用すること。1回使い切りであり、残液は廃棄すること。
14.1.5 本剤を希釈後、投与する前に目視で異物がないか確認すること。希釈後の溶液は無色〜微黄色である。溶液に異物や変色があった場合は使用しないこと。
14.2 薬剤投与時の注意
14.2.1 本剤の急速静注は行わないこと。
14.2.2 治療上やむを得ないと判断される場合を除き、他の薬剤を同一の輸液ラインを通して同時に注入しないこと。やむを得ず他の薬剤を同一の輸液ラインから同時注入する場合には、配合変化を起こさない薬剤を用いること。
15. その他の注意
15.1 臨床使用に基づく情報
ポサコナゾールを末梢静脈内に単回又は反復投与したときの安全性について、以下の臨床試験成績が報告されている。
・外国人健康成人9例にポサコナゾール静注液200mgを90分間かけて単回末梢静脈内投与したとき、注入部位反応が67%(6/9例)で認められた(P04985試験)。
・外国人健康成人にポサコナゾール静注液(50、100、200、250及び300mg用量:各9例)を30分間かけて単回末梢静脈内投与したとき、血栓性静脈炎が4%(2/45例)、注入部位反応が16%(7/45例)で認められた(P06356試験パート1)。
・外国人健康成人13例にポサコナゾール静注液300mgを30分間かけて単回末梢静脈内投与したとき、血栓性静脈炎が7%(1/13例)で認められた(P07783試験パート1)。
・外国人健康成人5例にポサコナゾール静注液100mgを30分間かけて1日1回(初日のみ1日2回)、10日間反復末梢静脈内投与したとき、血栓性静脈炎が60%(3/5例)、注入部位反応が80%(4/5例)で認められた(P06356試験パート2)。
15.2 非臨床試験に基づく情報
15.2.1 幼若イヌの生後2〜8週に静脈内投与した試験において、側脳室拡張の発現頻度の増加がみられたが、5ヵ月の休薬後には本所見の発現頻度の増加は認められなかった。本所見がみられたイヌでは、神経系、行動又は発達に異常は認められなかった。また、幼若イヌの生後4日〜9ヵ月に経口投与した試験では、脳に同様の所見は観察されなかった。
15.2.2 ラットに臨床曝露量(AUC)の2.4倍以上の曝露量で投与したところ、副腎の皮質腺腫及び癌並びに褐色細胞腫が増加した。ラットの副腎皮質腫瘍は、副腎皮質ステロイドの慢性的な産生抑制に続く内分泌系のかく乱と整合するものである。また、褐色細胞腫の増加は、カルシウムホメオスタシスの変化に続発するラット特有の現象であると考えられている。ポサコナゾールを投与したヒトでは、カルシウムホメオスタシスの変化や副腎腫瘍は報告されていない。
16. 薬物動態
16.1 血中濃度
16.1.1 点滴静注後の薬物動態パラメータ
健康成人にポサコナゾール300mgを30分間かけて単回点滴静注した際のポサコナゾールの血漿中薬物動態パラメータの平均値(変動係数)は、AUC0-∞が48400ng・hr/mL(15%)、Cmaxが3300ng/mL(41%)、消失半減期が21.8時間(13%)、クリアランスが6.32L/hr(16%)であった。
ポサコナゾールの母集団薬物動態モデルに基づき推定された日本人深在性真菌症治療患者に1回300mgで初日は1日2回、2日目以降は1日1回でポサコナゾール静注液を点滴静注した際の定常状態におけるポサコナゾールの血漿中薬物動態パラメータは表1のとおりであった。
| 例数 | AUClast(ng・hr/mL) | Cmax(ng/mL) | Cavg(ng/mL) | Cmin(ng/mL) |
| 16 | 82653(41) | 5453(46) | 3719(42) | 3019(46) |
16.3 分布
健康成人にポサコナゾール300mgを30分間かけて点滴静注した際の平均分布容積は197Lであり、血管外への分布が示された。
ポサコナゾールはヒト血漿蛋白との結合率が高く(>98%)、大部分はアルブミンに結合する(in vitro)(外国人データ)。
ポサコナゾールはヒト血漿蛋白との結合率が高く(>98%)、大部分はアルブミンに結合する(in vitro)(外国人データ)。
16.4 代謝
健康成人に[14C]ポサコナゾールの経口懸濁液注)投与後、血漿中でポサコナゾールは主に未変化体として存在していた。血漿中代謝物の大部分はグルクロン酸抱合体で、チトクロムP450(CYP)により生成される酸化代謝物は、少量しか認められなかった(外国人データ)。[10.参照]
16.5 排泄
健康成人に[14C]ポサコナゾールを経口懸濁液注)として投与した際、放射能は主として糞中に排泄され(投与放射能の77%)、その主成分は未変化体であった(投与放射能の66%)。消失における腎排泄の寄与は小さく、投与放射能の14%が尿中に排泄された(未変化体は投与放射能の0.2%未満)。尿及び糞中に排泄される代謝物は、投与放射能の約17%であった(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 体重
ポサコナゾールの母集団薬物動態解析において、体重はポサコナゾールのクリアランスに関連しており、低体重の患者ではポサコナゾールの曝露量は概して増加することが示唆された(日本人及び外国人データ)。体重が120kgを超える患者ではポサコナゾールの曝露量が低くなるおそれがある。[9.1.3参照]
16.6.2 腎機能障害
ポサコナゾール経口懸濁液注)の単回投与後、軽度及び中等度の腎機能障害(12例、クレアチニンクリアランス≧20mL/min/1.73m2)がポサコナゾールの薬物動態に及ぼす影響はみられなかったため、用量調節の必要はない。重度腎機能障害(6例、クレアチニンクリアランス<20mL/min/1.73m2)を有する被験者では、ポサコナゾールのAUCのばらつき(変動係数:96%)がその他の腎機能障害群(変動係数:≦32%)と比較して大きかった(表2)。ポサコナゾールは血液透析で除去されない(外国人データ)。[9.2.2、13.参照]
| 被験者 | 例数 | AUClast(ng・hr/mL) | Cmax(ng/mL) | Tmaxa(hr) | t1/2(hr) |
| 腎機能正常 | 6 | 17554(40) | 555(40) | 5.50(5.00-8.00) | 24.1(22) |
| 軽度腎機能障害 | 6 | 15425(28) | 631(47) | 5.00(5.00-6.00) | 28.1(22) |
| 中等度腎機能障害 | 6 | 17316(32) | 486(37) | 8.00(5.00-12.00) | 29.6(17) |
| 重度腎機能障害 | 6 | 20826(96) | 809(93) | 5.00(5.00-7.00) | 23.4b(23) |
16.6.3 肝機能障害
軽度、中等度及び重度肝機能障害(それぞれChild-PughクラスA、B及びC)を有する被験者並びに肝機能正常被験者にポサコナゾール経口懸濁液400mg注)を単回投与した際の血漿中薬物動態パラメータは表3のとおりであった(外国人データ)。
| 被験者 | 例数 | AUC0-∞(ng・hr/mL) | Cmax(ng/mL) | Tmaxa(hr) | t1/2(hr) |
| 軽度肝機能障害 | 6 | 31700c(39) | 694(41) | 6.50(5.00-12.00) | 38.5c(28) |
| 肝機能正常b | 6 | 23400c(20) | 689(30) | 5.00(5.00-6.00) | 26.9c(19) |
| 中等度肝機能障害 | 6 | 25700c(24) | 724(15) | 5.00(4.00-6.00) | 27.3c(24) |
| 肝機能正常b | 6 | 22300c(59) | 517(80) | 5.50(4.00-8.00) | 26.5c(22) |
| 重度肝機能障害 | 6 | 24400(37) | 403(31) | 9.00(6.00-24.00) | 43.1(43) |
| 肝機能正常b | 6 | 18700c(40) | 608(35) | 5.00(5.00-6.00) | 27.6c(20) |
16.6.4 高齢者
ポサコナゾールの母集団薬物動態解析において、加齢はポサコナゾールのクリアランスに関連しており、高年齢の患者ではポサコナゾールの曝露量は概して増加することが示唆された(日本人及び外国人データ)。
16.7 薬物相互作用
16.7.1 In vitro試験
ポサコナゾールの主要な代謝経路はUGT1A4を介したUDPグルクロン酸抱合である。また、ポサコナゾールはP-gpの基質である。ポサコナゾールはCYP3A4の強力な阻害剤であるため、ポサコナゾールとの併用によりCYP3A4で代謝される薬物の血中濃度は増加する可能性がある。また、ポサコナゾールは腸管でP-gpを阻害する可能性がある。[10.参照]
16.7.2 臨床薬物相互作用試験
表4に注意喚起のある併用薬に関して、臨床薬物相互作用試験で認められた薬物動態への影響をまとめた(外国人データ)。[10.1、10.2参照]
| 併用薬 | 例数a | 平均比(90%信頼区間) [併用時/非併用時] | |
| ポサコナゾールへの影響 | 併用薬への影響 | ||
| リファブチン 300mg QD | 8/12 | AUC:0.51(0.37,0.71) Cmax:0.57(0.43,0.75) | − |
| フェニトイン 200mg QD | 12/12 | AUC:0.50(0.36,0.71) Cmax:0.59(0.44,0.79) | − |
| エファビレンツ 400mg QD | 11/13 | AUC:0.50(0.43,0.60) Cmax:0.55(0.47,0.66) | − |
| ホスアンプレナビル 700mg BID | 20/20 | AUC:0.77(0.68,0.87) Cmax:0.79(0.71,0.89) | − |
| リファブチン 300mg QD | 8/8 | − | AUC:1.72(1.51,1.95) Cmax:1.31(1.10,1.57) |
| シクロスポリン | 4/4 | − | 血中トラフ濃度上昇 (シクロスポリンの用量は最大で29%減量が必要であった。) |
| タクロリムス 0.05mg/kg 単回投与 | 34/34 | − | AUC:4.58(4.03,5.19) Cmax:2.21(2.01,2.42) |
| シロリムス 2mg 単回投与 | 12/12 | − | AUC:8.88(7.26,10.9) Cmax:6.72(5.62,8.03) |
| ミダゾラム(静注) 0.4mg 単回投与 | 12/12 | − | AUC:6.24(5.43,7.16) Cmax:1.62(1.41,1.86) |
| ミダゾラム(経口) 2mg 単回投与 | 12/12 | − | AUC:4.97(4.46,5.54) Cmax:2.38(2.13,2.66) |
| シンバスタチン 40mg 単回投与 | 12/12 | − | AUC:10.60(8.63,13.02) Cmax:11.41(7.99,16.29) |
| アタザナビル 300mg QD | 12/12 | − | AUC:3.68(2.89,4.70) Cmax:2.55(1.89,3.45) |
| アタザナビル/リトナビル 300mg/100mg QD | 12/12 | − | <アタザナビル> AUC:2.46(1.93,3.13) Cmax:1.53(1.13,2.07) <リトナビル> AUC:1.80(1.39,2.31) Cmax:1.49(1.04,2.15) |
注)本剤と剤形が異なる。本剤の用法及び用量は、通常、成人にはポサコナゾールとして初日は1回300mgを1日2回、2日目以降は300mgを1日1回、中心静脈ラインから約90分間かけて緩徐に点滴静注である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<造血幹細胞移植患者又は好中球減少が予測される血液悪性腫瘍患者における深在性真菌症の予防>
17.1.1 海外第III相試験(P01899試験)
侵襲性真菌症の発症リスクが高い患者を対象にポサコナゾールの侵襲性真菌症の予防効果を評価するため、第III相、無作為化、実薬対照試験を実施した。主要有効性評価項目は、外部の判定委員会評価者が盲検下で判定した侵襲性真菌症(確定診断例又は臨床診断例)の発症率であった。
P01899試験は、急性骨髄性白血病又は骨髄異形成症候群に対する寛解導入化学療法により持続性の好中球減少症を有する又は予測される患者を対象に、ポサコナゾール経口懸濁液群(1回200mg1日3回、食事とともに投与)注)と対照群(フルコナゾール1回400mg1日1回又はイトラコナゾール1回200mg1日2回)を評価した評価者盲検試験であった。投与期間の中央値は、両投与群で類似していた(ポサコナゾール群:25日間、フルコナゾール/イトラコナゾール群:21日間)。無作為割付けから治験薬の最終投与7日後までの期間の侵襲性真菌症(確定診断例又は臨床診断例)の発症率において、フルコナゾール/イトラコナゾール群に対するポサコナゾール経口懸濁液群の優越性が示された1)。
P01899試験は、急性骨髄性白血病又は骨髄異形成症候群に対する寛解導入化学療法により持続性の好中球減少症を有する又は予測される患者を対象に、ポサコナゾール経口懸濁液群(1回200mg1日3回、食事とともに投与)注)と対照群(フルコナゾール1回400mg1日1回又はイトラコナゾール1回200mg1日2回)を評価した評価者盲検試験であった。投与期間の中央値は、両投与群で類似していた(ポサコナゾール群:25日間、フルコナゾール/イトラコナゾール群:21日間)。無作為割付けから治験薬の最終投与7日後までの期間の侵襲性真菌症(確定診断例又は臨床診断例)の発症率において、フルコナゾール/イトラコナゾール群に対するポサコナゾール経口懸濁液群の優越性が示された1)。
| 侵襲性真菌症(確定診断例又は臨床診断例)†の発症率n/N(%) | P値 | |
| ポサコナゾール経口懸濁液群 | フルコナゾール/イトラコナゾール群 | |
| 7/304(2) | 25/298(8) | 0.0009 |
副作用発現割合は、ポサコナゾール経口懸濁液群で34%(102/304例)であった。主な副作用は、悪心7%(22/304例)、下痢7%(20/304例)、嘔吐5%(14/304例)、QT/QTc延長4%(12/304例)、低カリウム血症3%(9/304例)、発疹3%(9/304例)、腹痛3%(9/304例)、粘膜炎NOS2%(7/304例)、ビリルビン血症2%(7/304例)、肝酵素上昇2%(7/304例)、ALT増加2%(7/304例)、AST増加2%(6/304例)、消化不良2%(5/304例)、γ-GTP増加2%(5/304例)、頭痛2%(5/304例)であった。
17.1.2 海外第III相試験(C/I98-316試験)
侵襲性真菌症の発症リスクが高い患者を対象にポサコナゾールの侵襲性真菌症の予防効果を評価するため、第III相、無作為化、実薬対照試験を実施した。主要有効性評価項目は、外部の判定委員会評価者が盲検下で判定した侵襲性真菌症(確定診断例又は臨床診断例)の発症率であった。
C/I98-316試験は、移植片対宿主病を有する同種造血幹細胞移植患者を対象に、ポサコナゾール経口懸濁液群(1回200mg1日3回、食事とともに投与)注)と対照群(フルコナゾール1回400mg1日1回)を評価した二重盲検試験であった。投与期間の中央値は、両投与群で類似していた(ポサコナゾール群:111日間、フルコナゾール群:108日間)。無作為割付けから治験薬投与112日後までの期間の侵襲性真菌症(確定診断例又は臨床診断例)の発症率において、フルコナゾール群に対するポサコナゾール経口懸濁液群の非劣性が示された2)。
C/I98-316試験は、移植片対宿主病を有する同種造血幹細胞移植患者を対象に、ポサコナゾール経口懸濁液群(1回200mg1日3回、食事とともに投与)注)と対照群(フルコナゾール1回400mg1日1回)を評価した二重盲検試験であった。投与期間の中央値は、両投与群で類似していた(ポサコナゾール群:111日間、フルコナゾール群:108日間)。無作為割付けから治験薬投与112日後までの期間の侵襲性真菌症(確定診断例又は臨床診断例)の発症率において、フルコナゾール群に対するポサコナゾール経口懸濁液群の非劣性が示された2)。
| 侵襲性真菌症(確定診断例又は臨床診断例)†の発症率n/N(%) | オッズ比 | P値 | 95.01%信頼区間 | 最大値†† | |
| ポサコナゾール経口懸濁液群 | フルコナゾール群 | ||||
| 16/301(5) | 27/299(9) | 0.5614 | 0.0740 | 0.2959-1.0651 | 1.1625 |
副作用発現割合は、ポサコナゾール経口懸濁液群で36%(107/301例)であった。主な副作用は、悪心7%(22/301例)、嘔吐4%(13/301例)、ALT増加3%(9/301例)、γ-GTP増加3%(9/301例)、AST増加3%(8/301例)、下痢3%(8/301例)、ビリルビン血症3%(8/301例)、肝酵素上昇3%(8/301例)、血中クレアチニン増加2%(6/301例)、Al-P増加2%(5/301例)、薬物濃度変化2%(5/301例)であった。
17.1.3 海外後期第I相/第III相試験(P05615試験)
造血幹細胞移植後の移植片対宿主病の予防又は治療患者並びに血液悪性腫瘍に対する化学療法に伴う好中球減少症を有する又は予測される患者に対して、真菌感染の予防薬としてポサコナゾールの錠剤を投与した際の薬物動態及び安全性を評価する後期第I相/第III相、非対照試験を実施した。
P05615試験では、210例にポサコナゾール錠剤を初日に1回300mgを1日2回、2日目以降は300mgを1日1回経口投与した(投与期間の中央値28日間)3)。
P05615試験では、210例にポサコナゾール錠剤を初日に1回300mgを1日2回、2日目以降は300mgを1日1回経口投与した(投与期間の中央値28日間)3)。
副作用発現割合は、40%(84/210例)であった。主な副作用は、悪心11%(23/210例)、下痢8%(16/210例)、腹痛4%(9/210例)、嘔吐4%(9/210例)、ALT増加4%(9/210例)、AST増加4%(8/210例)、低カリウム血症3%(6/210例)、上腹部痛2%(5/210例)、消化不良2%(5/210例)、肝機能検査異常2%(5/210例)、低リン酸血症2%(5/210例)、発疹2%(5/210例)、鼓腸2%(4/210例)であった。
17.1.4 海外後期第I相/第III相試験(P05520試験)
造血幹細胞移植後の移植片対宿主病の予防又は治療患者並びに血液悪性腫瘍に対する化学療法に伴う好中球減少症を有する又は予測される患者に対して、真菌感染の予防薬としてポサコナゾールの静注液を投与した際の薬物動態及び安全性を評価する後期第I相/第III相、非対照試験を実施した。
P05520試験では、237例にポサコナゾール静注液を初日に1回300mgを1日2回、2日目以降は300mgを1日1回中心静脈ラインから点滴静注した(投与期間の中央値9日間)4)。
P05520試験では、237例にポサコナゾール静注液を初日に1回300mgを1日2回、2日目以降は300mgを1日1回中心静脈ラインから点滴静注した(投与期間の中央値9日間)4)。
副作用発現割合は、静注液投与期で30%(72/237例)であった。主な副作用は、下痢8%(19/237例)、悪心5%(12/237例)、発疹5%(11/237例)、嘔吐4%(9/237例)、低カリウム血症4%(9/237例)、頭痛3%(7/237例)、腹痛3%(6/237例)、ALT増加2%(5/237例)、血中ビリルビン増加2%(5/237例)、味覚異常2%(5/237例)、食欲減退2%(4/237例)、低マグネシウム血症2%(4/237例)、そう痒症2%(4/237例)であった。
<真菌症(侵襲性アスペルギルス症、フサリウム症、ムーコル症、コクシジオイデス症、クロモブラストミコーシス、菌腫)の治療>
17.1.5 国内第III相試験(P101試験)
深在性真菌症患者を対象にポサコナゾールの有効性及び安全性を評価するため、第III相、無作為化、非盲検、実薬対照試験を実施した。慢性肺アスペルギルス症又は侵襲性アスペルギルス症と治験担当医師により診断された患者は2:1の比でポサコナゾール群又はボリコナゾール群に無作為に割り付けられた。また、ムーコル症と治験担当医師により診断された3例は、すべてポサコナゾールを投与した。投与開始時の製剤(経口剤又は注射剤)は、患者の状態に応じて選択し、ポサコナゾール群については初日に1回300mgを1日2回、2日目以降は300mgを1日1回、錠剤では経口投与、静注液では中心静脈ラインから点滴静注した。ボリコナゾール群については注射剤では初日に1回6mg/kgを1日2回、2日目以降は1回4mg/kgを1日2回点滴静注、経口剤では初日に1回300mgを1日2回、2日目以降は1回200mgを1日2回経口投与した。ムーコル症患者へのポサコナゾール(錠剤又は静注液)の投与期間は3例とも84日間であった。
(1)侵襲性アスペルギルス症
侵襲性アスペルギルス症についての外部の判定委員会評価者が判定した治験薬初回投与から42日時点の総合効果†は、ポサコナゾール群の5例のうち2例で、ボリコナゾール群の3例全例で有効であった。
(2)ムーコル症
ムーコル症についての外部の判定委員会評価者が判定した治験薬初回投与から84日時点の総合効果†は、ポサコナゾールを投与された3例全例で有効であった5)。
†臨床症状効果、画像診断効果及び真菌学的効果に基づき総合効果を完全奏効、一部奏効、不変、悪化、判定不能の5段階で評価し、このうち、完全奏効及び一部奏効を有効とした。
副作用発現割合は、ポサコナゾール(錠剤又は静注液)群で73%(56/77例)であった(投与期間の中央値78日間)。主な副作用は、発熱22%(17/77例)、高血圧14%(11/77例)、肝機能異常13%(10/77例)、低カリウム血症13%(10/77例)、食欲減退12%(9/77例)、ALT増加9%(7/77例)、AST増加9%(7/77例)、心電図QT延長8%(6/77例)、悪心5%(4/77例)、発疹5%(4/77例)であった。
17.1.6 海外第III相試験(P00041試験)
標準的抗真菌治療が無効又は不耐容の侵襲性真菌症患者(確定診断又は臨床診断例)を対象にポサコナゾール経口懸濁液(800mg/日を分割して、食事とともに投与)注)の有効性及び安全性を評価するため、第III相、非盲検試験を実施した。侵襲性真菌症診断を含む患者の試験組入れの適格性及び有効性を外部の判定委員会評価者が盲検下で判定した。
発症頻度が低い以下の疾患における治療終了時の総合効果についても、外部の判定委員会評価者が盲検下で判定した6)。
発症頻度が低い以下の疾患における治療終了時の総合効果についても、外部の判定委員会評価者が盲検下で判定した6)。
(1)フサリウム症
ポサコナゾール経口懸濁液の経口投与を受けたフサリウム症患者18例のうち、7例で治療終了時の総合効果が有効(完全奏効又は一部奏効)であった。
(2)ムーコル症
ポサコナゾール経口懸濁液の経口投与を受けたムーコル症患者11例のうち、6例で治療終了時の総合効果が有効(完全奏効又は一部奏効)であった。
(3)コクシジオイデス症
ポサコナゾール経口懸濁液の経口投与を受けたコクシジオイデス症患者16例のうち、11例で治療終了時の総合効果が有効(完全奏効又は一部奏効)であった。
(4)クロモブラストミコーシス及び菌腫
ポサコナゾール経口懸濁液の経口投与を受けたクロモブラストミコーシス及び菌腫患者11例のうち、9例で治療終了時の総合効果が有効(完全奏効又は一部奏効)であった。
副作用発現割合は、42%(140/330例)であった(投与期間の中央値102.5日間)。主な副作用は、悪心9%(31/330例)、嘔吐6%(19/330例)、腹痛5%(16/330例)、頭痛5%(15/330例)、下痢3%(11/330例)、ALT増加3%(11/330例)、AST増加3%(9/330例)、発疹3%(9/330例)であった。
17.1.7 海外第III相試験(P069試験)
侵襲性アスペルギルス症患者を対象にポサコナゾールの一次治療における有効性及び安全性を評価するため、第III相、無作為化、二重盲検、実薬対照試験を実施した。患者は、死亡及び予後不良のリスク(高リスク、低リスク)により層別され、1:1の比でポサコナゾール群又はボリコナゾール群に無作為に割り付けられた。投与開始時の製剤(経口剤又は注射剤)は、患者の状態に応じて選択し、ポサコナゾール群については初日に1回300mgを1日2回、2日目以降は300mgを1日1回、錠剤では経口投与、静注液では中心静脈ラインから点滴静注した。ボリコナゾール群については注射剤では初日に1回6mg/kgを1日2回、2日目以降は1回4mg/kgを1日2回中心静脈ラインから点滴静注、経口剤では初日に1回300mgを1日2回、2日目以降は1回200mgを1日2回経口投与した。すべての患者の侵襲性アスペルギルス症の診断、侵襲性アスペルギルス症関連の死亡及び有効性データを外部の判定委員会評価者が盲検下で判定した。主要有効性評価項目は、ITT集団(無作為化され、治験薬を1回以上投与されたすべての被験者集団)における治験薬投与42日後までの全死亡率であった。
ITT集団における治験薬投与42日後までの全死亡率において、ボリコナゾール群に対するポサコナゾール群の非劣性が示された7)。
ITT集団における治験薬投与42日後までの全死亡率において、ボリコナゾール群に対するポサコナゾール群の非劣性が示された7)。
| 全原因による死亡 | 投与群別、未調整データの要約n/N(%) | 群間差 (ポサコナゾール群−ボリコナゾール群)† | |||
| ポサコナゾール群 | ボリコナゾール群 | 群間差の推定値(%) | 95%信頼区間 | P値 | |
| 死亡 | 44/288(15.3) | 59/287(20.6) | −5.3 | −11.6,1.0 | <0.0001 |
| 生存 | 244/288(84.7) | 228/287(79.4) | |||
副作用発現割合は、ポサコナゾール(錠剤又は静注液)群で30%(86/288例)であった(投与期間の中央値67日間)。主な副作用は、ALT増加8%(22/288例)、AST増加6%(18/288例)、悪心4%(12/288例)、低カリウム血症4%(11/288例)、嘔吐3%(9/288例)、血中ビリルビン増加3%(8/288例)、血中Al-P増加2%(7/288例)、肝機能異常2%(5/288例)、γ-GTP増加2%(5/288例)であった。
注)本剤と剤形が異なる。本剤の用法及び用量は、通常、成人にはポサコナゾールとして初日は1回300mgを1日2回、2日目以降は300mgを1日1回、中心静脈ラインから約90分間かけて緩徐に点滴静注である。
18. 薬効薬理
18.1 作用機序
ポサコナゾールは、真菌細胞の細胞膜を構成するエルゴステロールの生合成を阻害することにより抗真菌作用を示す。
18.2 抗真菌作用
ポサコナゾールは次の真菌に対してin vitroで抗真菌作用を示した。
Aspergillus属(A.fumigatus、A.flavus、A.niger、A.terreus等)、Candida属(C.albicans、C.glabrata、C.parapsilosis、C.tropicalis、C.krusei、C.lusitaniae、C.guilliermondii、C.dubliniensis等)、Cryptococcus neoformans、Fusarium属、ムーコル目[Mucor属、Rhizopus属、Cunninghamella属、Rhizomucor属、Lichtheimia属(Absidia属)、Apophysomyces属、Saksenaea属、Cokeromyces属]、クロモブラストミコーシス及び菌腫の原因真菌[Fonsecaea属、Scedosporium属、Pseudallescheria属、Exophiala属(Wangiella属)、Phialophora属、Cladosporium属、Cladophialophora属、Alternaria属、Bipolaris属、Aspergillus nidulans等]、二形性真菌(Histoplasma属、Blastomyces属、Coccidioides属、Paracoccidioides属、Penicillium marneffei、Sporothrix属)、皮膚糸状菌(Trichophyton属、Microsporum属等)
ポサコナゾールは他のアゾール系抗真菌薬に低感受性又は耐性を示す次の酵母様真菌及び糸状菌に対して幅広い抗真菌スペクトルを示した。
・Candida属(ボリコナゾール、イトラコナゾール又はフルコナゾールに対して耐性を示すC.albicansの分離株を含む)
・フルコナゾールに対して自然耐性を示すC.glabrata及びC.krusei
・アムホテリシンBに対して自然耐性を示すC.lusitaniae
・Aspergillus属(ボリコナゾール、イトラコナゾール、フルコナゾール又はアムホテリシンBに対して耐性を示す分離株を含む)
・以前はアゾール系抗真菌薬が感受性を示さないとされていたムーコル目等の分離株[Mucor属、Rhizopus属、Rhizomucor属、Lichtheimia属(Absidia属)等]
ポサコナゾールは一部の真菌に対してin vitroで殺菌的に作用した。
ポサコナゾールは酵母様真菌及び糸状菌による感染動物(マウス、モルモット及びウサギ)モデルで抗真菌作用を示したが、最小発育阻止濃度と効果に一貫した相関性は認められなかった。
18.3 薬剤耐性
C.albicansではポサコナゾールに対する耐性株は実験的に誘導出来なかったが、A.fumigatusではポサコナゾールに低感受性を示す変異株が実験的に1×10−8〜1×10−9の頻度で出現した。ポサコナゾールに低感受性を示すC.albicans及びA.fumigatusの臨床分離株がまれに認められる。このような低感受性を示すまれな例では、低感受性と臨床での有効性に明らかな相関性は認められていない。他のアゾール系抗真菌薬に耐性の真菌による感染症患者で有効性が認められており、このことは他のアゾール系抗真菌薬又はアムホテリシンBに耐性が誘導されたCandida属及びAspergillus属の株に対してin vitroで抗真菌作用を示すことと一致している。ポサコナゾールのブレイクポイントはいずれの菌種に対しても決定されていない。
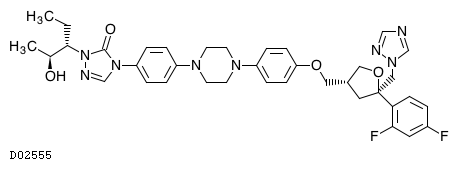
19. 有効成分に関する理化学的知見
19.1. ポサコナゾール
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
1バイアル(16.7mL)×10
23. 主要文献
- 社内資料:海外第III相試験(P01899試験)(2020年1月23日承認、CTD2.7.6.3)
- 社内資料:海外第III相試験(C/I98-316試験)(2020年1月23日承認、CTD2.7.6.3)
- 社内資料:海外後期第I相/第III相試験(P05615試験)(2020年1月23日承認、CTD2.7.6.2)
- 社内資料:海外後期第I相/第III相試験(P05520試験)(2020年1月23日承認、CTD2.7.6.2)
- 社内資料:国内第III相試験(P101試験)(2020年1月23日承認、CTD2.7.6.3)
- 社内資料:海外第III相試験(P00041試験)(2020年1月23日承認、CTD2.7.6.4)
- Maertens JA,et al., Lancet., 397, 499-509, (2021) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
MSD株式会社
MSDカスタマーサポートセンター
東京都千代田区九段北1-13-12
電話:医療関係者の方:フリーダイヤル 0120-024-961
製品情報問い合わせ先
MSD株式会社
MSDカスタマーサポートセンター
東京都千代田区九段北1-13-12
電話:医療関係者の方:フリーダイヤル 0120-024-961
26. 製造販売業者等
26.1 製造販売元
MSD株式会社
東京都千代田区九段北1-13-12