医薬品情報
| 総称名 | エゼチミブ |
|---|---|
| 一般名 | エゼチミブ |
| 欧文一般名 | Ezetimibe |
| 製剤名 | エゼチミブ錠 |
| 薬効分類名 | 小腸コレステロールトランスポーター阻害剤 高脂血症治療剤 |
| 薬効分類番号 | 2189 |
| ATCコード | C10AX09 |
| KEGG DRUG |
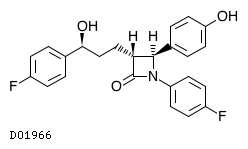
D01966
エゼチミブ
|
| KEGG DGROUP |
DG01946
脂質低下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年1月 改訂(効能変更)(第1版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エゼチミブ錠10mg「ケミファ」 (後発品) | Ezetimibe Tablets 10mg"Chemiphar" | ダイト | 2189018F1124 | 19.3円/錠 | 処方箋医薬品注) |
2. 禁忌
4. 効能または効果
5. 効能または効果に関連する注意
5.1 適用の前に十分な検査を実施し、高コレステロール血症、家族性高コレステロール血症、ホモ接合体性シトステロール血症であることを確認した上で本剤の適用を考慮すること。
5.2 ホモ接合体性家族性高コレステロール血症については、HMG-CoA還元酵素阻害剤及びLDLアフェレーシス等の非薬物療法の補助として、あるいはそれらの治療法が実施不能な場合に本剤の適用を考慮すること。
6. 用法及び用量
通常、成人にはエゼチミブとして1回10mgを1日1回食後経口投与する。なお、年齢、症状により適宜減量する。
8. 重要な基本的注意
8.1 あらかじめ高コレステロール血症治療の基本である食事療法を行い、更に運動療法や、高血圧・喫煙等の虚血性心疾患のリスクファクターの軽減等も十分考慮すること。
8.2 甲状腺機能低下症、閉塞性胆のう胆道疾患、慢性腎不全、膵炎等の疾患の合併、血清脂質に悪影響を与える薬剤の服用等の二次的要因により高脂血症を呈している場合は、原疾患の治療、薬剤の切り替え等を可能な限り実施した上で本剤での治療を考慮すること。
8.3 本剤とHMG-CoA還元酵素阻害剤を併用する場合、併用するHMG-CoA還元酵素阻害剤の添付文書を必ず参照し、禁忌、重要な基本的注意、特定の背景を有する患者に関する注意、重大な副作用等の記載を確認すること。また、肝機能検査を、併用開始時及び併用するHMG-CoA還元酵素阻害剤の添付文書で推奨されている時期に実施すること。[2.2、9.3.1、11.1.2参照]
8.4 フィブラート系薬剤との併用に関しては、使用経験が限られている。併用する場合は、胆石症などの副作用の発現に注意すること。フィブラート系薬剤では胆汁へのコレステロール排泄を増加させ、胆石形成がみられることがある。本剤はイヌで胆のう胆汁中のコレステロール濃度の上昇が報告されている。[15.1、15.2参照]
8.5 投与中は血中脂質値を定期的に検査し、治療に対する反応が認められない場合には投与を中止すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 糖尿病患者
空腹時血糖の上昇が報告されている。[17.1.5参照]
9.3 肝機能障害患者
9.3.1 本剤とHMG-CoA還元酵素阻害剤を併用する場合、重篤な肝機能障害のある患者
9.3.2 中等度又は重度の肝機能障害のある患者
投与しないことが望ましい。本剤の血漿中濃度が上昇するおそれがある。[16.6.2参照]
9.3.3 軽度の肝機能障害のある患者[16.6.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。なお、HMG-CoA還元酵素阻害剤は、妊婦又は妊娠している可能性のある女性に対して禁忌であるため、本剤との併用投与は行わないこと。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
ヒト母乳中への移行の有無は不明であるが、妊娠後から授乳期まで投与したラットで乳児への移行が認められている。なお、HMG-CoA還元酵素阻害剤は、授乳婦に対して禁忌であるため、本剤との併用投与は行わないこと。
ヒト母乳中への移行の有無は不明であるが、妊娠後から授乳期まで投与したラットで乳児への移行が認められている。なお、HMG-CoA還元酵素阻害剤は、授乳婦に対して禁忌であるため、本剤との併用投与は行わないこと。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 過敏症(頻度不明)
アナフィラキシー、血管神経性浮腫、発疹を含む過敏症状があらわれたとの報告がある。
11.1.2 横紋筋融解症(頻度不明)
本剤との因果関係は確立していないが、まれに横紋筋融解症、ミオパチーの報告があるので、観察を十分に行い、筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等が認められた場合には投与を中止し、適切な処置を行うこと。[8.3参照]
11.1.3 肝機能障害(頻度不明)
AST上昇、ALT上昇等を伴う肝機能障害があらわれることがある。
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 精神神経系 | 頭痛、しびれ、めまい、坐骨神経痛 | 抑うつ、錯感覚 | |
| 消化器 | 便秘、下痢、腹痛、腹部膨満、悪心・嘔吐 | アミラーゼ上昇、食欲不振、消化不良、逆流性食道炎、鼓腸放屁、口内炎、胃炎 | 膵炎、胆石症、胆のう炎、口内乾燥 |
| 肝臓 | ALT上昇注1)、γ-GTP上昇 | AST上昇、ビリルビン上昇 | 肝炎 |
| 腎臓 | 蛋白尿 | BUN上昇 | |
| 循環器 | 期外収縮、動悸、血圧上昇、胸痛 | ほてり | |
| 筋肉 | CK上昇注2) | 関節痛、背部痛、四肢痛 | 筋肉痛、筋力低下、筋痙縮 |
| 血液 | 白血球減少 | 血小板減少 | |
| 皮膚 | 発疹 | そう痒 | 蕁麻疹、多形紅斑 |
| その他 | コルチゾール上昇 | テストステロン低下、TSH上昇、尿酸上昇、リン値上昇、疲労、浮腫(顔面・四肢)、帯状疱疹、単純疱疹、結膜炎、咳嗽 | 無力症、疼痛 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
複合型高脂血症患者を対象にした海外の多施設二重盲検プラセボ対照試験(625例が12週間以内、576例が1年以内の投与)において、血清トランスアミナーゼの上昇(基準値上限の3倍を超える連続した上昇)の発現率(曝露期間で調整)は、フェノフィブラート単独群で4.5%、本剤とフェノフィブラート併用群で2.7%であった。同様に、胆のう摘出術の発現率は、フェノフィブラート単独群で0.6%、本剤とフェノフィブラート併用群で1.7%であった。CK上昇(基準値上限の10倍を超える)については、本試験のいずれの群でも認められなかった。また、本剤とフェノフィブラート併用における一般的な有害事象は腹痛であった。なお、本試験は、頻繁に発現しない有害事象を群間で比較するようにはデザインされていない1)2)。[8.4参照]
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性(20例)にエゼチミブ10mgを食後に単回経口投与したとき、血漿中エゼチミブ(非抱合体)及びエゼチミブ抱合体濃度の薬物動態パラメータは表1に示したとおりであった6)。
| エゼチミブ(非抱合体) | エゼチミブ抱合体† | ||||
| Tmax(hr) | Cmax(ng/mL) | AUC0-t(ng・hr/mL) | Tmax(hr) | Cmax(ng Eq/mL) | AUC0-t(ng Eq・hr/mL) |
| 2.10(92) | 6.03(56) | 55.6(30) | 1.48(28) | 72.3(38) | 333(40) |
16.1.2 反復投与
健康成人男性(9例)にエゼチミブ20mg注1)を1日1回14日間経口投与したとき、血漿中エゼチミブ(非抱合体)及びエゼチミブ抱合体濃度はいずれも連投開始後3日までに定常状態に到達し、AUCについて算出した累積係数はエゼチミブ(非抱合体)及びエゼチミブ抱合体についてそれぞれ1.54及び1.37であった7)。
16.1.3 生物学的同等性試験
健康成人男子にエゼチミブ錠10mg「ケミファ」とゼチーア錠10mgのそれぞれ1錠(エゼチミブとして10mg)を、絶食時単回経口投与して血漿中エゼチミブ抱合体及びエゼチミブ非抱合体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された(クロスオーバー法)8)。
(1)エゼチミブ抱合体
| 判定パラメータ | 参考パラメータ | |||
| AUC0-72(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) | |
| エゼチミブ錠10mg「ケミファ」 | 761.7±335.4 | 94.6±38.2 | 1.2±0.8 | 26.7±24.4 |
| ゼチーア錠10mg | 750.1±348.4 | 98.1±33.6 | 1.3±0.9 | 23.8±11.7 |
(2)エゼチミブ非抱合体
| 判定パラメータ | 参考パラメータ | |||
| AUC0-72(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) | |
| エゼチミブ錠10mg「ケミファ」 | 90.74±30.90 | 4.75±1.64 | 3.0±3.2 | 22.4±17.4 |
| ゼチーア錠10mg | 85.92±35.28 | 4.91±2.24 | 5.0±4.5 | 22.1±11.6 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
健康成人男性(20例)にエゼチミブ10mgを食後又は空腹時に単回経口投与したとき、血漿中エゼチミブ(非抱合体)及びエゼチミブ抱合体濃度のいずれにおいても、食事によるAUCへの明らかな影響は認められなかった6)。
健康成人男性(各6例)にエゼチミブ10、20注1)、40mg注1)を食後に単回経口投与したとき、エゼチミブ(非抱合体)及びエゼチミブ抱合体のいずれについても投与量に応じたCmax及びAUCの上昇が認められた9)。
16.3 分布
16.3.1 血漿蛋白結合
16.4 代謝
エゼチミブは、主に小腸における初回通過効果によって主要活性代謝物であるエゼチミブ抱合体(フェノール性水酸基におけるグルクロン酸抱合体)に代謝される。
16.5 排泄
16.5.1 尿・糞中排泄
健康成人男性(外国人8例)に14C-エゼチミブカプセル20mg注1)を単回経口投与したとき、投与後240時間までの放射能排泄率は糞中に78%、尿中に11%であった12)。
健康成人男性(各6例)にエゼチミブ10、20注1)、40mg注1)を単回経口投与したとき、投与後72時間までのエゼチミブ(非抱合体)としての尿中排泄率は0.05%未満であり、尿中総エゼチミブ(非抱合体+抱合体)排泄率は8.7%〜11%であった9)。
16.5.2 胆汁中排泄(腸肝循環)
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
重度の慢性腎機能障害患者(外国人8例、クレアチニンクリアランス10〜29mL/min)にエゼチミブ10mgを単回経口投与したとき、健康成人(外国人9例、クレアチニンクリアランス>80mL/min)と比較して血漿中エゼチミブ(非抱合体)及びエゼチミブ抱合体濃度のAUCにそれぞれ約1.6倍及び1.5倍の上昇が認められた15)。
16.6.2 肝機能障害患者
軽度、中等度又は重度の慢性肝機能障害患者(外国人、各4例)若しくは健康成人(外国人8例)にエゼチミブ10mgを単回経口投与したとき、血漿中エゼチミブ(非抱合体)及びエゼチミブ抱合体濃度の薬物動態パラメータは表2に示したとおりであった。肝機能障害患者では肝機能障害の程度に応じた血漿中薬物濃度の上昇が認められた16)17)。[9.3.2、9.3.3参照]
| 肝機能障害 | エゼチミブ(非抱合体) | エゼチミブ抱合体† | ||||
| Tmax(hr) | Cmax(ng/mL) | AUC0-t(ng・hr/mL) | Tmax(hr) | Cmax(ng Eq/mL) | AUC0-t(ng Eq・hr/mL) | |
| 正常(n=8) | 7.00(59) | 3.86(118) | 54.6(36) | 1.81(95) | 95.3(50) | 864(45) |
| 軽度(n=4) | 6.25(72) | 4.10(37) | 75.8(54) | 1.25(23) | 138(32) | 1468(14) |
| 中等度(n=4) | 9.50(26) | 13.1(41) | 316(51) | 2.75(79) | 171(24) | 2685(16) |
| 重度(n=4) | 7.00(49) | 16.2(43) | 265(57) | 2.88(46) | 178(31) | 3418(41) |
16.6.3 高齢者
高齢者(12例、年齢65〜75歳)にエゼチミブ10mgを1日1回10日間経口投与したとき、非高齢対照群(11例、年齢20〜24歳)と比較して血漿中エゼチミブ抱合体濃度のAUCに約2.4倍の上昇が認められたが、血漿中エゼチミブ(非抱合体)濃度のAUCに明らかな変化は認められなかった18)。
16.7 薬物相互作用
16.7.1 チトクロムP450酵素系への影響
健康成人(外国人12例)を対象として、エゼチミブ20mg注1)と各種チトクロムP450酵素系の基質となる代表的な指標薬を併用したとき、CYP1A2、CYP2C8/9、CYP2D6及びCYP3A4活性、並びにN-アセチルトランスフェラーゼ活性への影響は認められなかった10)。
16.7.2 HMG-CoA還元酵素阻害剤との相互作用
成人を対象として、各種HMG-CoA還元酵素阻害剤(シンバスタチン、プラバスタチン、フルバスタチン、アトルバスタチン、ロスバスタチン、ピタバスタチン)とエゼチミブ10mgを併用で1日1回、7又は14日間経口投与した結果注2)、エゼチミブはいずれのHMG-CoA還元酵素阻害剤の薬物動態に対しても明らかな影響を及ぼさず、また、いずれのHMG-CoA還元酵素阻害剤もエゼチミブの薬物動態に明らかな影響を与えなかった10)。
16.7.3 コレスチラミンによる影響
16.7.4 フェノフィブラートとの相互作用
成人(外国人8例、LDLコレステロール値≧130mg/dL)を対象として、フェノフィブラート200mg(1日1回)とエゼチミブ10mg(1日1回)を併用したとき、血漿中エゼチミブ抱合体濃度のCmax及びAUCはそれぞれ約1.7倍及び1.5倍上昇したが、臨床上意味のあるものではなかった。フェノフィブラートの薬物動態に及ぼすエゼチミブの影響は認められなかった20)。
16.7.5 シクロスポリン製剤との相互作用
クレアチニンクリアランスが50mL/minを超え、かつ、一定用量(75〜150mg1日2回)のシクロスポリン製剤を服用中の腎移植患者(外国人8例)にエゼチミブ10mgを単回投与したとき、総エゼチミブ(非抱合体+抱合体)のAUCは健康成人と比較して約3.4倍高値を示した21)。別の試験で、重度の腎機能障害のため腎移植を行い、シクロスポリン製剤を含む複数の薬剤による治療を受けていた患者(外国人1例)にエゼチミブ10mgを単回投与したとき、総エゼチミブ(非抱合体+抱合体)のAUCは健康成人と比較して約12倍高値を示した22)。健康成人(外国人12例)を対象として、エゼチミブ20mg注1)(1日1回8日間)の連投7日目にシクロスポリン製剤100mgを単回経口投与したとき、血液中シクロスポリン濃度のCmax及びAUCはシクロスポリン単独投与と比較してそれぞれ10%及び15%上昇した23)。[10.2参照]
16.7.6 その他の薬物動態学的相互作用
注1)エゼチミブの承認用量は1日1回10mgである。
注2)ピタバスタチン以外は外国人(LDLコレステロール値≧130mg/dL)を対象とした試験
17. 臨床成績
17.1 有効性及び安全性に関する試験
<高コレステロール血症及び家族性高コレステロール血症>
17.1.1 国内第III相二重盲検比較試験
高コレステロール血症患者100例にエゼチミブ10mgを1日1回食後に12週間投与した結果、LDLコレステロールは18.1%、総コレステロールは12.8%、トリグリセリドは2.2%低下し、HDLコレステロールは5.9%上昇した。
副作用の発現頻度は18.6%(22/118例)で、主な副作用は便秘3.4%(4/118例)、ALT上昇2.5%(3/118例)であった25)。
副作用の発現頻度は18.6%(22/118例)で、主な副作用は便秘3.4%(4/118例)、ALT上昇2.5%(3/118例)であった25)。
17.1.2 国内第III相長期投与試験
高コレステロール血症患者178例にエゼチミブ10mgを1日1回食後に52週間投与した。効果が不十分な場合は、16週目以降にHMG-CoA還元酵素阻害剤の併用を可とし、エゼチミブ単独投与終了時の値を投与終了時の値とした。その結果、投与終了時でLDLコレステロールは16.8%、総コレステロールは13.0%、トリグリセリドは0.6%低下し、HDLコレステロールは4.9%上昇した。また、エゼチミブとHMG-CoA還元酵素阻害剤を併用投与した65例では、LDLコレステロールは33.5%低下した。
副作用の発現頻度は、エゼチミブ単独投与期間中で36.0%(64/178例)及びHMG-CoA還元酵素阻害剤併用中で22%(15/67例)であった。主な副作用は、エゼチミブ単独投与期間中ではγ-GTP上昇3.4%(6/178例)、CK上昇2.8%(5/178例)で、HMG-CoA還元酵素阻害剤併用中ではγ-GTP上昇4%(3/67例)、ALT上昇及びテストステロン低下3%(2/67例)であった26)。
副作用の発現頻度は、エゼチミブ単独投与期間中で36.0%(64/178例)及びHMG-CoA還元酵素阻害剤併用中で22%(15/67例)であった。主な副作用は、エゼチミブ単独投与期間中ではγ-GTP上昇3.4%(6/178例)、CK上昇2.8%(5/178例)で、HMG-CoA還元酵素阻害剤併用中ではγ-GTP上昇4%(3/67例)、ALT上昇及びテストステロン低下3%(2/67例)であった26)。
17.1.3 HMG-CoA還元酵素阻害剤でコントロール不良の高コレステロール血症患者に対する国内第III相試験
HMG-CoA還元酵素阻害剤により治療中でLDLコレステロールが治療目標値まで低下していない高コレステロール血症患者39例(ヘテロ接合体性家族性高コレステロール血症患者29例を含む)にエゼチミブ10mgを12週間投与した。エゼチミブ服用前のLDLコレステロール(平均値)は185mg/dL、総コレステロール(平均値)は267mg/dLであったが、エゼチミブの併用投与により、LDLコレステロールは23.0%、総コレステロールは17.0%低下した。
副作用の発現頻度は25%(10/40例)で、主な副作用は尿中蛋白陽性8%(3/40例)、CK上昇5%(2/40例)であった27)。
副作用の発現頻度は25%(10/40例)で、主な副作用は尿中蛋白陽性8%(3/40例)、CK上昇5%(2/40例)であった27)。
17.1.4 ホモ接合体性家族性高コレステロール血症患者に対する国内第III相試験
LDLアフェレーシスを施行中であり、かつHMG-CoA還元酵素阻害剤を服用しているホモ接合体性家族性高コレステロール血症患者6例にエゼチミブ10mgを12週間投与した結果、LDLアフェレーシス施行前のLDLコレステロールは9.6%、総コレステロールは9.1%低下した。
副作用の発現頻度は50%(3/6例)で、主な副作用は疲労33%(2/6例)であった28)。
副作用の発現頻度は50%(3/6例)で、主な副作用は疲労33%(2/6例)であった28)。
17.1.5 糖代謝に及ぼす影響を検討した国内第III相試験
17.1.6 ホモ接合体性家族性高コレステロール血症患者に対する海外第III相試験
<ホモ接合体性シトステロール血症>
17.1.7 海外第III相試験
なお、上述の臨床試験等によって、エゼチミブ製剤は動脈硬化性疾患に関連する種々の脂質因子の改善(総コレステロール低下、LDLコレステロール低下、HDLコレステロール上昇)を認めたが、エゼチミブ製剤の単独投与、又はHMG-CoA還元酵素阻害剤の併用による心血管系の罹患率及び死亡率に対する効果は確立されていない(先発品国内承認時)。
18. 薬効薬理
18.1 作用機序
エゼチミブは食事性及び胆汁性コレステロールの吸収を阻害する。エゼチミブの作用部位は小腸であり、ハムスター等を用いた動物試験において、小腸でのコレステロールの吸収を選択的に阻害し、その結果、肝臓のコレステロール含量を低下させ、血中コレステロールを低下させた34)35)36)37)。エゼチミブは小腸壁細胞に存在する蛋白質(Niemann-Pick C1 Like 1)を介してコレステロール及び植物ステロールの吸収を阻害する38)39)40)。このことから、エゼチミブの作用機序は他の高脂血症治療剤(HMG-CoA還元酵素阻害剤、陰イオン交換樹脂、フィブラート系薬剤、植物ステロール)とは異なる。18例の高コレステロール血症患者を対象とした海外の臨床薬理試験において、エゼチミブは2週間の投与により小腸でのコレステロール吸収をプラセボ群に比し54%阻害した41)。
エゼチミブは小腸でのコレステロール吸収阻害により肝臓のコレステロール含量を低下させるが、肝臓でのコレステロールの生合成が代償的に亢進する。コレステロールの生合成を抑制するHMG-CoA還元酵素阻害剤との併用により、血中コレステロールが相補的に低下することが、イヌを用いた試験36)及び海外の高コレステロール血症患者を対象とした試験42)43)44)において示された。
また、ラット等において、エゼチミブはコレステロール及び植物ステロールの吸収を選択的に阻害するが、脂肪酸、胆汁酸、プロゲステロン、エチニルエストラジオール並びに脂溶性ビタミンA及びDの吸収には影響しなかった34)。
18.2 血中コレステロール低下作用
18.3 粥状動脈硬化病変進展抑制作用
19. 有効成分に関する理化学的知見
19.1. エゼチミブ
22. 包装
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
23. 主要文献
- Farnier M,et al., Eur Heart J., 26, 897-905, (2005) »PubMed
- McKenney JM,et al., J Am Coll Cardiol., 47, 1584-1587, (2006) »PubMed
- 肝臓・胆汁への影響(ゼチーア錠:2007年4月18日承認、申請資料概要2.6.6.8)
- 毒性試験(ゼチーア錠:2007年4月18日承認、申請資料概要2.6.6.3)
- 胆汁コレステロールへの影響(ゼチーア錠:2007年4月18日承認、申請資料概要2.6.6.8)
- 三上洋、他, 臨床医薬, 23, 417-425, (2007)
- 深瀬広幸、他, 臨床医薬, 23, 407-415, (2007)
- ダイト株式会社:生物学的同等性に関する資料(社内資料)
- 深瀬広幸、他, 臨床医薬, 23, 397-406, (2007)
- Kosoglou T,et al., Clin Pharmacokinet., 44, 467-494, (2005) »PubMed
- 血漿蛋白結合(ゼチーア錠:2007年4月18日承認、申請資料概要2.6.4.4)
- Patrick JE,et al., Drug Metab Dispos., 30, 430-437, (2002) »PubMed
- 14C-エゼチミブ投与による臨床薬物動態試験(ゼチーア錠:2007年4月18日承認、申請資料概要2.7.2.2)
- 胆汁中排泄(ゼチーア錠:2007年4月18日承認、申請資料概要2.6.4.6)
- 腎機能障害患者における薬物動態(ゼチーア錠:2007年4月18日承認、申請資料概要2.7.2.2)
- 肝機能障害患者における薬物動態(ゼチーア錠:2007年4月18日承認、申請資料概要2.7.2.2)
- エゼチミブの臨床薬物動態試験における血漿中エゼチミブ及びSCH60663濃度の薬物動態パラメータ(ゼチーア錠:2007年4月18日承認、申請資料概要2.7.2.5)
- 三上洋、他, 臨床医薬, 23, 427-435, (2007)
- コレスチラミンとの相互作用(ゼチーア錠:2007年4月18日承認、申請資料概要2.7.2.2)
- フェノフィブラートとの相互作用(ゼチーア錠:2007年4月18日承認、申請資料概要2.7.2.2)
- Bergman AJ,et al., J Clin Pharmacol., 46, 328-336, (2006) »PubMed
- シクロスポリン投与症例における薬物動態(ゼチーア錠:2007年4月18日承認、申請資料概要2.7.2.2)
- Bergman AJ,et al., J Clin Pharmacol., 46, 321-327, (2006) »PubMed
- 制酸剤との相互作用(ゼチーア錠:2007年4月18日承認、申請資料概要2.7.2.2)
- 齋藤康、他, 臨床医薬, 23, 493-522, (2007)
- 山田信博、他, 臨床医薬, 23, 523-554, (2007)
- 朔啓二郎、他, 臨床医薬, 23, 555-570, (2007)
- Yamamoto A,et al., Atherosclerosis., 186, 126-131, (2006) »PubMed
- 清野弘明、他, 臨床医薬, 23, 571-588, (2007)
- Gagne C,et al., Circulation., 105, 2469-2475, (2002) »PubMed
- ホモ接合体性家族性高コレステロール血症患者を対象とした試験(ゼチーア錠:2007年4月18日承認、申請資料概要2.7.6.4)
- Salen G,et al., Circulation., 109, 966-971, (2004) »PubMed
- ホモ接合性シトステロール血症患者を対象とした試験(ゼチーア錠:2007年4月18日承認、申請資料概要2.7.6.4)
- 薬理試験(ゼチーア錠:2007年4月18日承認、申請資料概要2.6.2.1)
- Davis HR Jr,et al., Arterioscler Thromb Vasc Biol., 21, 2032-2038, (2001) »PubMed
- Davis HR Jr,et al., Metabolism., 50, 1234-1241, (2001) »PubMed
- van Heek M,et al., Eur J Pharmacol., 415, 79-84, (2001) »PubMed
- Altmann SW,et al., Science., 303, 1201-1204, (2004) »PubMed
- Davis HR Jr,et al., J Biol Chem., 279, 33586-33592, (2004) »PubMed
- Garcia-Calvo M,et al., Proc Natl Acad Sci USA., 102, 8132-8137, (2005) »PubMed
- Sudhop T,et al., Circulation., 106, 1943-1948, (2002) »PubMed
- Davidson MH,et al., J Am Coll Cardiol., 40, 2125-2134, (2002) »PubMed
- Melani L,et al., Eur Heart J., 24, 717-728, (2003) »PubMed
- Ballantyne CM,et al., Circulation., 107, 2409-2415, (2003) »PubMed
- 効力を裏付ける試験(ゼチーア錠:2007年4月18日承認、申請資料概要2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
日本薬品工業株式会社
安全管理課
〒101-0032
東京都千代田区岩本町2丁目2番3号
電話:03-5833-5011
FAX:03-5833-5100
製品情報問い合わせ先
日本薬品工業株式会社
安全管理課
〒101-0032
東京都千代田区岩本町2丁目2番3号
電話:03-5833-5011
FAX:03-5833-5100
26. 製造販売業者等
26.1 製造販売元
ダイト株式会社
富山県富山市八日町326番地
26.2 販売元
日本薬品工業株式会社
東京都千代田区岩本町2丁目2-3