医薬品情報
| 総称名 | カルバゾクロムスルホン酸Na |
|---|---|
| 一般名 | カルバゾクロムスルホン酸ナトリウム水和物 |
| 欧文一般名 | Carbazochrome Sodium Sulfonate Hydrate |
| 製剤名 | カルバゾクロムスルホン酸ナトリウム製剤 |
| 薬効分類名 | 対血管薬剤 |
| 薬効分類番号 | 3321 |
| ATCコード | B02BX02 |
| KEGG DRUG |
D01525
カルバゾクロムスルホン酸ナトリウム水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第1版)

|
4.効能または効果 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 12.臨床検査結果に及ぼす影響 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| カルバゾクロムスルホン酸Na錠30mg「あすか」 (後発品) | CARBAZOCHROME SULFONATE Na TABLETS | あすか製薬 | 3321002F2455 | 6.1円/錠 |
4. 効能または効果
○毛細血管抵抗性の減弱及び透過性の亢進によると考えられる出血傾向(例えば紫斑病など)
○毛細血管抵抗性の減弱による皮膚あるいは粘膜及び内膜からの出血、眼底出血・腎出血・子宮出血
○毛細血管抵抗性の減弱による手術中・術後の異常出血
6. 用法及び用量
カルバゾクロムスルホン酸ナトリウム水和物として、通常成人1日30〜90mgを3回に分割経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 本剤の成分に対し過敏症の既往歴のある患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 消化器 | 食欲不振、胃部不快感 | 悪心、嘔吐 | |
| 過敏症 | 発疹、そう痒 |
12. 臨床検査結果に及ぼす影響
本剤の代謝物により、尿ウロビリノーゲン試験が陽性になることがある。
また、だいだい黄色がかった着色尿があらわれることがある。
また、だいだい黄色がかった着色尿があらわれることがある。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
健康成人男子に150mg(5錠)経口投与した場合速やかに血中に移行し、血中濃度は0.5〜1時間後に最高(25ng/mL plasma)に達する。
血中濃度の半減期は約1.5時間である。
血中濃度の半減期は約1.5時間である。
注)本剤の承認された用法及び用量は、1日30〜90mgを3回に分割経口投与である。
16.5 排泄
尿中排泄動態は血中濃度の推移とよく対応し、投与後0.5〜1.5時間で最大となり、24時間までに排泄される。
16.8 その他
雄性シロウサギにカルバゾクロムスルホン酸Na錠30mg「あすか」とアドナ錠30mgそれぞれカルバゾクロムスルホン酸ナトリウム水和物として60mgをクロスオーバー法により単回経口投与してカルバゾクロムスルホン酸ナトリウム水和物の尿中排泄量を測定した結果、両剤間の尿中排泄量に有意差は認められなかった1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
細血管に作用して、血管透過性亢進を抑制し、血管抵抗値を増強する。血液凝固・線溶系に影響を与えることなく出血時間を短縮し、止血作用を示す。
18.2 血管透過性抑制作用
18.2.1 ウサギ 5、10mg/kg筋肉内投与により、カリクレインによる血管透過性亢進を投与後60分で各々20%、30%抑制する4)。
18.2.2 ウサギ 0.5、2.5、5.0mg/kg静脈内投与により、ヒアルロニダーゼ拡散率を抑制し、特に2.5〜5mg/kg投与群で著しい5)。
18.2.3 馬杉腎炎ラットの尿中蛋白及び尿中アルカリフォスファターゼの増加を抑制する(Exton変法、Kind-king法:皮下)。
腎炎の尿中蛋白は主に糸球体毛細血管の透過性亢進によるものとされている6)。
腎炎の尿中蛋白は主に糸球体毛細血管の透過性亢進によるものとされている6)。
18.3 細血管抵抗値増強作用
18.3.1 馬杉腎炎ラットの低下した血管抵抗値を、投与用量に応じ、対照群に比べ有意に増大させる(皮下)。
また、正常ラットにおいても血管抵抗値を増大させる(von Borbely式改良法:経口)6)。
また、正常ラットにおいても血管抵抗値を増大させる(von Borbely式改良法:経口)6)。
18.3.2 ウサギ 10mg/kg筋肉内投与により、瞬膜血管抵抗値を投与後60分で1.3倍増強する4)。
18.4 出血時間短縮作用
18.4.1 ウサギ 2.5、5.0mg/kg静脈内投与により、出血時間を投与後60分で各々18%、42%短縮し、その作用は3時間以上持続する5)。
18.5 血小板、血液凝固系に対する作用
18.6 呼吸系、循環系に対する作用
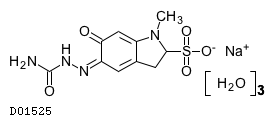
19. 有効成分に関する理化学的知見
19.1. カルバゾクロムスルホン酸ナトリウム水和物
22. 包装
600錠[10錠(PTP)×60]
1,200錠[10錠(PTP)×120]
23. 主要文献
- 社内資料:生物学的同等性試験
- 堀 慶久他, 臨牀と研究, 51 (7), 1953-1965, (1974)
- 加藤作郎他, 臨牀と研究, 52 (5), 1567-1585, (1975)
- 小寺 稔他, 臨牀と研究, 43 (2), 357-362, (1966)
- 志水 浩他, 診療と新薬, 2, 421-426, (1965)
- 府川和永他, 応用薬理, 15 (7), 1121-1131, (1978)
- 蛭間政和他, 大阪市立大学医学雑誌, 6, 793-799, (1957)
- 小澤 光他, 薬学雑誌, 76 (12), 1408-1414, (1956) »DOI
24. 文献請求先及び問い合わせ先
文献請求先
千寿製薬株式会社
カスタマーサポート室 受付時間 9:00〜17:30(土、日、祝日を除く)
〒541-0048
大阪市中央区瓦町三丁目1番9号
電話:0120-069-618
FAX:06-6201-0577
製品情報問い合わせ先
千寿製薬株式会社
カスタマーサポート室 受付時間 9:00〜17:30(土、日、祝日を除く)
〒541-0048
大阪市中央区瓦町三丁目1番9号
電話:0120-069-618
FAX:06-6201-0577
26. 製造販売業者等
26.1 製造販売元
あすか製薬株式会社
東京都港区芝浦二丁目5番1号
26.2 発売元
千寿製薬株式会社
大阪市中央区瓦町三丁目1番9号
26.3 販売元
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号