医薬品情報
| 総称名 | エンレスト |
|---|---|
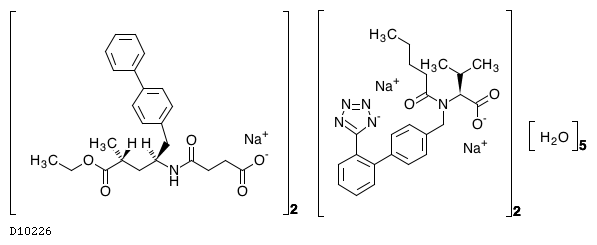
| 一般名 | サクビトリルバルサルタンナトリウム水和物 |
| 欧文一般名 | Sacubitril Valsartan Sodium Hydrate |
| 製剤名 | サクビトリルバルサルタンナトリウム水和物製剤 |
| 薬効分類名 | アンジオテンシン受容体ネプリライシン阻害薬(ARNI) |
| 薬効分類番号 | 2149 2190 |
| ATCコード | C09DX04 |
| KEGG DRUG |
D10226
サクビトリルバルサルタンナトリウム水和物
|
| KEGG DGROUP |
DG03231
血圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(第9版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エンレスト錠50mg | Entresto Tablets | ノバルティスファーマ | 2190041F1027 | 60.9円/錠 | 処方箋医薬品注) |
| エンレスト錠100mg | Entresto Tablets | ノバルティスファーマ | 2190041F2023 | 106.9円/錠 | 処方箋医薬品注) |
| エンレスト錠200mg | Entresto Tablets | ノバルティスファーマ | 2190041F3020 | 188.2円/錠 | 処方箋医薬品注) |
| エンレスト粒状錠小児用12.5mg | Entresto Granules | ノバルティスファーマ | 2190041F4026 | 21.4円/個 | 処方箋医薬品注) |
| エンレスト粒状錠小児用31.25mg | Entresto Granules | ノバルティスファーマ | 2190041F5022 | 43.2円/個 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 アンジオテンシン変換酵素阻害薬(アラセプリル、イミダプリル塩酸塩、エナラプリルマレイン酸塩、カプトプリル、キナプリル塩酸塩、シラザプリル水和物、テモカプリル塩酸塩、デラプリル塩酸塩、トランドラプリル、ベナゼプリル塩酸塩、ペリンドプリルエルブミン、リシノプリル水和物)を投与中の患者、あるいは投与中止から36時間以内の患者[5.1、5.3、8.1、10.1参照]
2.3 血管性浮腫の既往歴のある患者(アンジオテンシンII受容体拮抗薬又はアンジオテンシン変換酵素阻害薬による血管性浮腫、遺伝性血管性浮腫、後天性血管性浮腫、特発性血管性浮腫等)[11.1.1参照]
2.4 アリスキレンフマル酸塩を投与中の糖尿病患者(ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く)[10.1参照]
2.5 重度の肝機能障害(Child-Pugh分類C)のある患者[9.3.1参照]
2.6 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
エンレスト錠50mg
<錠50mg>
成人
慢性心不全
ただし、慢性心不全の標準的な治療を受けている患者に限る。
ただし、慢性心不全の標準的な治療を受けている患者に限る。
小児
慢性心不全
エンレスト錠100mg
<錠100mg>
エンレスト錠200mg
<錠200mg>
エンレスト粒状錠小児用12.5mg
<粒状錠小児用12.5mg>
慢性心不全
エンレスト粒状錠小児用31.25mg
<粒状錠小児用31.25mg>
慢性心不全
5. 効能または効果に関連する注意
エンレスト錠50mg
<成人の慢性心不全>
<小児の慢性心不全>
エンレスト錠100mg
<成人の慢性心不全>
<小児の慢性心不全>
5.3 本剤投与開始前にアンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬を投与されている場合はそれらの薬剤から切り替え、投与されていない場合は患者の状態を観察しながら本剤を慎重に投与すること。[2.2、8.1、17.1.3参照]
5.4 小児の慢性心不全の治療に十分な知識及び経験を有し、「臨床成績」の項の内容及び臨床試験に組み入れられた患者の背景(基礎疾患や心不全の病態、前治療、収縮期血圧等)を十分に理解した医師のもとで、本剤の投与が適切と判断される患者に対して適用を考慮すること。[17.1.3参照]
<高血圧症>
5.5 過度な血圧低下のおそれ等があり、原則として本剤を高血圧治療の第一選択薬としないこと。
エンレスト錠200mg
<成人の慢性心不全>
<小児の慢性心不全>
5.3 本剤投与開始前にアンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬を投与されている場合はそれらの薬剤から切り替え、投与されていない場合は患者の状態を観察しながら本剤を慎重に投与すること。[2.2、8.1、17.1.3参照]
5.4 小児の慢性心不全の治療に十分な知識及び経験を有し、「臨床成績」の項の内容及び臨床試験に組み入れられた患者の背景(基礎疾患や心不全の病態、前治療、収縮期血圧等)を十分に理解した医師のもとで、本剤の投与が適切と判断される患者に対して適用を考慮すること。[17.1.3参照]
<高血圧症>
5.5 過度な血圧低下のおそれ等があり、原則として本剤を高血圧治療の第一選択薬としないこと。
エンレスト粒状錠小児用12.5mg
<小児の慢性心不全>
エンレスト粒状錠小児用31.25mg
6. 用法及び用量
エンレスト錠50mg
<慢性心不全>
通常、成人にはサクビトリルバルサルタンとして1回50mgを開始用量として1日2回経口投与する。忍容性が認められる場合は、2〜4週間の間隔で段階的に1回200mgまで増量する。1回投与量は50mg、100mg又は200mgとし、いずれの投与量においても1日2回経口投与する。なお、忍容性に応じて適宜減量する。
通常、1歳以上の小児には、サクビトリルバルサルタンとして下表のとおり体重に応じた開始用量を1日2回経口投与する。忍容性が認められる場合は、2〜4週間の間隔で段階的に目標用量まで増量する。なお、忍容性に応じて適宜減量する。
| 体重 | 開始用量 | 第1漸増用量 | 第2漸増用量 | 目標用量 |
| 40kg未満 | 0.8mg/kg | 1.6mg/kg | 2.3mg/kg | 3.1mg/kg |
| 40kg以上50kg未満 | 0.8mg/kg | 50mg | 100mg | 150mg |
| 50kg以上 | 50mg | 100mg | 150mg | 200mg |
(参考)
| 錠50mg | 錠100mg | 錠200mg | 粒状錠小児用12.5mg | 粒状錠小児用31.25mg | |
| 慢性心不全(成人) | ○ | ○ | ○ | − | − |
| 慢性心不全(小児) | ○ | ○ | ○ | ○ | ○ |
| 高血圧症 | − | ○ | ○ | − | − |
エンレスト錠100mg
<慢性心不全>
通常、成人にはサクビトリルバルサルタンとして1回50mgを開始用量として1日2回経口投与する。忍容性が認められる場合は、2〜4週間の間隔で段階的に1回200mgまで増量する。1回投与量は50mg、100mg又は200mgとし、いずれの投与量においても1日2回経口投与する。なお、忍容性に応じて適宜減量する。
通常、1歳以上の小児には、サクビトリルバルサルタンとして下表のとおり体重に応じた開始用量を1日2回経口投与する。忍容性が認められる場合は、2〜4週間の間隔で段階的に目標用量まで増量する。なお、忍容性に応じて適宜減量する。
| 体重 | 開始用量 | 第1漸増用量 | 第2漸増用量 | 目標用量 |
| 40kg未満 | 0.8mg/kg | 1.6mg/kg | 2.3mg/kg | 3.1mg/kg |
| 40kg以上50kg未満 | 0.8mg/kg | 50mg | 100mg | 150mg |
| 50kg以上 | 50mg | 100mg | 150mg | 200mg |
<高血圧症>
通常、成人にはサクビトリルバルサルタンとして1回200mgを1日1回経口投与する。なお、年齢、症状により適宜増減するが、最大投与量は1回400mgを1日1回とする。
(参考)
| 錠50mg | 錠100mg | 錠200mg | 粒状錠小児用12.5mg | 粒状錠小児用31.25mg | |
| 慢性心不全(成人) | ○ | ○ | ○ | − | − |
| 慢性心不全(小児) | ○ | ○ | ○ | ○ | ○ |
| 高血圧症 | − | ○ | ○ | − | − |
エンレスト錠200mg
<慢性心不全>
通常、成人にはサクビトリルバルサルタンとして1回50mgを開始用量として1日2回経口投与する。忍容性が認められる場合は、2〜4週間の間隔で段階的に1回200mgまで増量する。1回投与量は50mg、100mg又は200mgとし、いずれの投与量においても1日2回経口投与する。なお、忍容性に応じて適宜減量する。
通常、1歳以上の小児には、サクビトリルバルサルタンとして下表のとおり体重に応じた開始用量を1日2回経口投与する。忍容性が認められる場合は、2〜4週間の間隔で段階的に目標用量まで増量する。なお、忍容性に応じて適宜減量する。
| 体重 | 開始用量 | 第1漸増用量 | 第2漸増用量 | 目標用量 |
| 40kg未満 | 0.8mg/kg | 1.6mg/kg | 2.3mg/kg | 3.1mg/kg |
| 40kg以上50kg未満 | 0.8mg/kg | 50mg | 100mg | 150mg |
| 50kg以上 | 50mg | 100mg | 150mg | 200mg |
<高血圧症>
通常、成人にはサクビトリルバルサルタンとして1回200mgを1日1回経口投与する。なお、年齢、症状により適宜増減するが、最大投与量は1回400mgを1日1回とする。
(参考)
| 錠50mg | 錠100mg | 錠200mg | 粒状錠小児用12.5mg | 粒状錠小児用31.25mg | |
| 慢性心不全(成人) | ○ | ○ | ○ | − | − |
| 慢性心不全(小児) | ○ | ○ | ○ | ○ | ○ |
| 高血圧症 | − | ○ | ○ | − | − |
エンレスト粒状錠小児用12.5mg
<慢性心不全>
通常、1歳以上の小児には、サクビトリルバルサルタンとして下表のとおり体重に応じた開始用量を1日2回経口投与する。忍容性が認められる場合は、2〜4週間の間隔で段階的に目標用量まで増量する。なお、忍容性に応じて適宜減量する。
| 体重 | 開始用量 | 第1漸増用量 | 第2漸増用量 | 目標用量 |
| 40kg未満 | 0.8mg/kg | 1.6mg/kg | 2.3mg/kg | 3.1mg/kg |
| 40kg以上50kg未満 | 0.8mg/kg | 50mg | 100mg | 150mg |
| 50kg以上 | 50mg | 100mg | 150mg | 200mg |
(参考)
| 錠50mg | 錠100mg | 錠200mg | 粒状錠小児用12.5mg | 粒状錠小児用31.25mg | |
| 慢性心不全(成人) | ○ | ○ | ○ | − | − |
| 慢性心不全(小児) | ○ | ○ | ○ | ○ | ○ |
| 高血圧症 | − | ○ | ○ | − | − |
エンレスト粒状錠小児用31.25mg
<慢性心不全>
通常、1歳以上の小児には、サクビトリルバルサルタンとして下表のとおり体重に応じた開始用量を1日2回経口投与する。忍容性が認められる場合は、2〜4週間の間隔で段階的に目標用量まで増量する。なお、忍容性に応じて適宜減量する。
| 体重 | 開始用量 | 第1漸増用量 | 第2漸増用量 | 目標用量 |
| 40kg未満 | 0.8mg/kg | 1.6mg/kg | 2.3mg/kg | 3.1mg/kg |
| 40kg以上50kg未満 | 0.8mg/kg | 50mg | 100mg | 150mg |
| 50kg以上 | 50mg | 100mg | 150mg | 200mg |
(参考)
| 錠50mg | 錠100mg | 錠200mg | 粒状錠小児用12.5mg | 粒状錠小児用31.25mg | |
| 慢性心不全(成人) | ○ | ○ | ○ | − | − |
| 慢性心不全(小児) | ○ | ○ | ○ | ○ | ○ |
| 高血圧症 | − | ○ | ○ | − | − |
7. 用法及び用量に関連する注意
エンレスト錠50mg
<慢性心不全>
7.1 次の患者では、患者の状態を注意深く観察し、増量の可否を慎重に判断すること。
7.2 本剤の増量は、臨床試験で用いられた血圧、血清カリウム値及び腎機能に関する以下の基準も目安に検討すること。[7.1、8.2、17.1.2、17.1.3参照]
| 血圧 | 症候性低血圧がみられず、収縮期血圧が95mmHg以上 |
| 血清カリウム値 | 5.4mEq/L以下 |
| 腎機能 | eGFR 30mL/min/1.73m2以上かつeGFRの低下率が35%以下 |
| 血圧 | 収縮期血圧が以下の値超 ・1歳以上10歳未満:70mmHg+2×年齢 ・10歳以上:90mmHg |
| 血清カリウム値 | 5.4mEq/L以下 |
| 腎機能 | eGFRが以下の値以上かつeGFRの低下率が35%未満 ・12ヵ月以上19ヵ月未満:31mL/min/1.73m2 ・19ヵ月以上18歳未満:38mL/min/1.73m2 |
エンレスト錠100mg
<慢性心不全>
7.1 次の患者では、患者の状態を注意深く観察し、増量の可否を慎重に判断すること。
7.2 本剤の増量は、臨床試験で用いられた血圧、血清カリウム値及び腎機能に関する以下の基準も目安に検討すること。[7.1、8.2、17.1.2、17.1.3参照]
| 血圧 | 症候性低血圧がみられず、収縮期血圧が95mmHg以上 |
| 血清カリウム値 | 5.4mEq/L以下 |
| 腎機能 | eGFR 30mL/min/1.73m2以上かつeGFRの低下率が35%以下 |
| 血圧 | 収縮期血圧が以下の値超 ・1歳以上10歳未満:70mmHg+2×年齢 ・10歳以上:90mmHg |
| 血清カリウム値 | 5.4mEq/L以下 |
| 腎機能 | eGFRが以下の値以上かつeGFRの低下率が35%未満 ・12ヵ月以上19ヵ月未満:31mL/min/1.73m2 ・19ヵ月以上18歳未満:38mL/min/1.73m2 |
<高血圧症>
7.5 本剤はサクビトリル及びバルサルタンに解離して作用する薬剤であるため、本邦のバルサルタンの承認用法及び用量での降圧効果、本剤の降圧効果を理解した上で、患者の状態、他の降圧薬による治療状況等を考慮し、本剤適用の可否を慎重に判断するとともに、既存治療の有無によらず1回100mgを1日1回からの開始も考慮すること。[17.1.4参照]
7.6 慢性心不全を合併する高血圧症患者では、原則として慢性心不全の用法及び用量に従うこととするが、慢性心不全の発症に先んじて高血圧症の治療目的で本剤を使用している場合等は、患者の状態に応じて適切に用法及び用量を選択すること。
エンレスト錠200mg
<慢性心不全>
7.1 次の患者では、患者の状態を注意深く観察し、増量の可否を慎重に判断すること。
7.2 本剤の増量は、臨床試験で用いられた血圧、血清カリウム値及び腎機能に関する以下の基準も目安に検討すること。[7.1、8.2、17.1.2、17.1.3参照]
| 血圧 | 症候性低血圧がみられず、収縮期血圧が95mmHg以上 |
| 血清カリウム値 | 5.4mEq/L以下 |
| 腎機能 | eGFR 30mL/min/1.73m2以上かつeGFRの低下率が35%以下 |
| 血圧 | 収縮期血圧が以下の値超 ・1歳以上10歳未満:70mmHg+2×年齢 ・10歳以上:90mmHg |
| 血清カリウム値 | 5.4mEq/L以下 |
| 腎機能 | eGFRが以下の値以上かつeGFRの低下率が35%未満 ・12ヵ月以上19ヵ月未満:31mL/min/1.73m2 ・19ヵ月以上18歳未満:38mL/min/1.73m2 |
<高血圧症>
7.5 本剤はサクビトリル及びバルサルタンに解離して作用する薬剤であるため、本邦のバルサルタンの承認用法及び用量での降圧効果、本剤の降圧効果を理解した上で、患者の状態、他の降圧薬による治療状況等を考慮し、本剤適用の可否を慎重に判断するとともに、既存治療の有無によらず1回100mgを1日1回からの開始も考慮すること。[17.1.4参照]
7.6 慢性心不全を合併する高血圧症患者では、原則として慢性心不全の用法及び用量に従うこととするが、慢性心不全の発症に先んじて高血圧症の治療目的で本剤を使用している場合等は、患者の状態に応じて適切に用法及び用量を選択すること。
エンレスト粒状錠小児用12.5mg
<慢性心不全>
7.1 次の患者では、患者の状態を注意深く観察し、増量の可否を慎重に判断すること。
7.2 本剤の増量は、臨床試験で用いられた血圧、血清カリウム値及び腎機能に関する以下の基準も目安に検討すること。[7.1、8.2、17.1.2、17.1.3参照]
| 血圧 | 症候性低血圧がみられず、収縮期血圧が95mmHg以上 |
| 血清カリウム値 | 5.4mEq/L以下 |
| 腎機能 | eGFR 30mL/min/1.73m2以上かつeGFRの低下率が35%以下 |
| 血圧 | 収縮期血圧が以下の値超 ・1歳以上10歳未満:70mmHg+2×年齢 ・10歳以上:90mmHg |
| 血清カリウム値 | 5.4mEq/L以下 |
| 腎機能 | eGFRが以下の値以上かつeGFRの低下率が35%未満 ・12ヵ月以上19ヵ月未満:31mL/min/1.73m2 ・19ヵ月以上18歳未満:38mL/min/1.73m2 |
7.3 小児のうち、アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬が投与されている患者では、これらの用量や忍容性、及び患者の状態を踏まえ、医師が適切と判断した場合には、第1漸増用量から投与を開始することもできる。[7.1、8.2参照]
7.4 粒状錠小児用を用いて投与する場合は、以下の点に注意すること。
・最低用量は12.5mgとし、用法及び用量で規定した投与量に最も近い用量となるよう、粒状錠小児用12.5mgと31.25mgを組み合わせて投与すること。
・カプセルは容器であることから、カプセルごと投与せず、容器内の粒状錠のみを全量投与すること。[14.2.2参照]
エンレスト粒状錠小児用31.25mg
<慢性心不全>
7.1 次の患者では、患者の状態を注意深く観察し、増量の可否を慎重に判断すること。
7.2 本剤の増量は、臨床試験で用いられた血圧、血清カリウム値及び腎機能に関する以下の基準も目安に検討すること。[7.1、8.2、17.1.2、17.1.3参照]
| 血圧 | 症候性低血圧がみられず、収縮期血圧が95mmHg以上 |
| 血清カリウム値 | 5.4mEq/L以下 |
| 腎機能 | eGFR 30mL/min/1.73m2以上かつeGFRの低下率が35%以下 |
| 血圧 | 収縮期血圧が以下の値超 ・1歳以上10歳未満:70mmHg+2×年齢 ・10歳以上:90mmHg |
| 血清カリウム値 | 5.4mEq/L以下 |
| 腎機能 | eGFRが以下の値以上かつeGFRの低下率が35%未満 ・12ヵ月以上19ヵ月未満:31mL/min/1.73m2 ・19ヵ月以上18歳未満:38mL/min/1.73m2 |
7.3 小児のうち、アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬が投与されている患者では、これらの用量や忍容性、及び患者の状態を踏まえ、医師が適切と判断した場合には、第1漸増用量から投与を開始することもできる。[7.1、8.2参照]
7.4 粒状錠小児用を用いて投与する場合は、以下の点に注意すること。
・最低用量は12.5mgとし、用法及び用量で規定した投与量に最も近い用量となるよう、粒状錠小児用12.5mgと31.25mgを組み合わせて投与すること。
・カプセルは容器であることから、カプセルごと投与せず、容器内の粒状錠のみを全量投与すること。[14.2.2参照]
8. 重要な基本的注意
8.1 血管性浮腫があらわれるおそれがあるため、本剤投与前にアンジオテンシン変換酵素阻害薬が投与されている場合は、少なくとも本剤投与開始36時間前に中止すること。また、本剤投与終了後にアンジオテンシン変換酵素阻害薬を投与する場合は、本剤の最終投与から36時間後までは投与しないこと。[2.2、5.1、5.3、10.1参照]
8.3 アンジオテンシンII受容体拮抗薬投与中に肝炎等の重篤な肝障害があらわれたとの報告があるので、肝機能検査を実施するなど観察を十分に行うこと。[11.1.12参照]
8.4 脱水があらわれるおそれがあるため、観察を十分に行い、異常が認められた場合には、本剤の減量、投与中止や補液等の適切な処置を行うこと。
8.5 手術前24時間は投与しないことが望ましい。麻酔及び手術中にレニン−アンジオテンシン系の抑制作用による低血圧を起こす可能性がある。
8.6 降圧作用に基づくめまい、ふらつきがあらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
<効能共通>
9.1.1 両側性腎動脈狭窄のある患者又は片腎で腎動脈狭窄のある患者
治療上やむを得ないと判断される場合を除き、投与は避けること。腎血流量の減少や糸球体濾過圧の低下により急速に腎機能を悪化させるおそれがある。
9.1.2 高カリウム血症の患者
9.1.3 脳血管障害のある患者
本剤の降圧作用により、脳血流不全を引き起こし、病態を悪化させるおそれがある。
<慢性心不全>
<高血圧症>
9.1.5 厳重な減塩療法中の患者
低用量から投与を開始し、増量する場合は徐々に行うこと。急激な血圧低下(失神及び意識消失等を伴う)を起こすおそれがある。[11.1.5参照]
9.2 腎機能障害患者
<慢性心不全>
9.2.1 軽度又は中等度の腎機能障害(eGFR 30mL/min/1.73m2以上90mL/min/1.73m2未満)のある患者
9.2.2 重度の腎機能障害(eGFR 30mL/min/1.73m2未満)のある患者
<高血圧症>
9.2.3 軽度又は中等度の腎機能障害(eGFR 30mL/min/1.73m2以上90mL/min/1.73m2未満)のある患者
9.2.4 重度の腎機能障害(eGFR 30mL/min/1.73m2未満)のある患者
9.2.5 血液透析中の患者
9.3 肝機能障害患者
<効能共通>
9.3.1 重度の肝機能障害(Child-Pugh分類C)のある患者
投与しないこと。重度の肝機能障害のある患者では本剤の血中濃度が上昇するおそれがあり、臨床試験では除外されている。[2.5参照]
<慢性心不全>
9.3.2 中等度の肝機能障害(Child-Pugh分類B)のある患者
<高血圧症>
9.3.3 中等度の肝機能障害(Child-Pugh分類B)のある患者
本剤投与の可否を慎重に判断し、投与する場合には血清カリウム値及び腎機能等の患者の状態を十分に観察しながら投与すること。低用量から開始することを考慮すること。本剤の血中濃度が上昇するおそれがある。[16.6.2参照]
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性
妊娠していることが把握されずアンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬を使用し、胎児・新生児への影響(腎不全、頭蓋・肺・腎の形成不全、死亡等)が認められた例が報告されている1)2)。
本剤の投与に先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、投与が必要な場合には次の注意事項に留意すること。[9.5参照]
本剤の投与に先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、投与が必要な場合には次の注意事項に留意すること。[9.5参照]
(1)本剤投与開始前に妊娠していないことを確認すること。本剤投与中も、妊娠していないことを定期的に確認すること。投与中に妊娠が判明した場合には、直ちに投与を中止すること。
(2)次の事項について、本剤投与開始時に患者に説明すること。また、投与中も必要に応じ説明すること。
・妊娠中に本剤を使用した場合、胎児・新生児に影響を及ぼすリスクがあること。
・本剤投与中及び最終投与後1週間は避妊する必要があること及び適切な避妊法。
・妊娠が判明した又は疑われる場合は、速やかに担当医に相談すること。
・妊娠を計画する場合は、担当医に相談すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。投与中に妊娠が判明した場合には、直ちに投与を中止すること。本剤を投与した動物実験(ラット、ウサギ)において、サクビトリルの活性代謝物(sacubitrilat)及びバルサルタンの曝露量が、臨床用量投与時の曝露量の0.06倍及び0.72倍(ラット)並びに0.03倍及び2.04倍(ウサギ)に相当する用量から、胚・胎児致死(着床後死亡率の高値)及び催奇形性(水頭症)が認められたとの報告がある。また、バルサルタンを含むアンジオテンシII受容体拮抗薬並びにアンジオテンシン変換酵素阻害薬で、妊娠中期〜末期に投与を受けた妊婦において、母体及び胎児への影響(自然流産、胎児・新生児死亡、羊水過少症、胎児・新生児の低血圧、腎機能障害、腎不全、高カリウム血症、頭蓋の形成不全、羊水過少症によると推測される四肢の拘縮、脳、頭蓋顔面の奇形、肺の発育形成不全等)が報告されている3)4)。[2.6、9.4.1参照]
9.6 授乳婦
授乳しないことが望ましい。本剤のヒトにおける乳汁中への移行は不明であるが、動物実験(ラットの授乳期経口投与)で、乳汁中にsacubitrilat及びバルサルタンの移行が認められた。本剤の投与期間中の授乳により、新生児又は乳児に影響を及ぼすおそれがある。また、バルサルタンの動物実験(ラットの周産期及び授乳期経口投与)において、600mg/kg/日で出生児の低体重及び生存率の低下が認められており、200mg/kg/日以上で外表分化の遅延が認められている。
9.7 小児等
9.8 高齢者
10. 相互作用
相互作用序文
Sacubitrilat及びバルサルタンはOATP1B1及びOATP1B3の基質である。なお、サクビトリル及びsacubitrilatはOATP1B1及びOATP1B3を阻害する。
薬物代謝酵素用語
OATP1B1
薬物代謝酵素用語
OATP1B3
10.1 併用禁忌
| アンジオテンシン変換酵素阻害薬 アラセプリル (セタプリル) イミダプリル塩酸塩 (タナトリル) エナラプリルマレイン酸塩 (レニベース) カプトプリル (カプトリル) キナプリル塩酸塩 (コナン) シラザプリル水和物 (インヒベース) テモカプリル塩酸塩 (エースコール) デラプリル塩酸塩 (アデカット) トランドラプリル (オドリック) ベナゼプリル塩酸塩 (チバセン) ペリンドプリルエルブミン (コバシル) リシノプリル水和物 (ゼストリル、ロンゲス) [2.2、8.1参照] | 血管性浮腫があらわれるおそれがある。これらの薬剤が投与されている場合は、少なくとも本剤投与開始36時間前に中止すること。また、本剤投与終了後にこれらの薬剤を投与する場合は、本剤の最終投与から36時間後までは投与しないこと。 | 併用により相加的にブラジキニンの分解を抑制し、血管性浮腫のリスクを増加させる可能性がある。 |
| アリスキレンフマル酸塩 (ラジレス) (糖尿病患者に投与する場合。ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く。) [2.4参照] | 非致死性脳卒中、腎機能障害、高カリウム血症及び低血圧のリスク増加がバルサルタンで報告されている。 | 併用によりレニン−アンジオテンシン−アルドステロン系阻害作用が増強される可能性がある。 |
10.2 併用注意
| アンジオテンシンII受容体拮抗薬 | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがあるため、これらの薬剤と併用すべきでない。 | 併用によりレニン−アンジオテンシン−アルドステロン系阻害作用が増強される可能性がある。 |
| アリスキレンフマル酸塩 | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。 なお、eGFRが60mL/min/1.73m2未満の腎機能障害のある患者へのアリスキレンフマル酸塩との併用については、治療上やむを得ないと判断される場合を除き避けること。 | 併用によりレニン−アンジオテンシン−アルドステロン系阻害作用が増強される可能性がある。 |
| アトルバスタチン [16.7.1参照] | 併用によりアトルバスタチンの血中濃度が上昇するおそれがある。 | 本剤は、OATP1B1及びOATP1B3を介する薬剤の肝臓への取り込みを阻害する可能性がある。 |
| PDE5阻害剤 シルデナフィル等 | 高血圧症患者において、本剤とシルデナフィルとの併用により、本剤単独投与よりも血圧低下が認められたとの報告がある。本剤の投与を受けている患者においてシルデナフィル又は他のPDE5阻害剤の投与を開始する際には注意すること。 | PDE5阻害剤は本剤の投与により増加するcGMPの分解を阻害する。 |
| カリウム保持性利尿薬 トリアムテレン スピロノラクトン エプレレノン等 カリウム補給製剤 塩化カリウム [9.1.2参照] | 血清カリウム値及び血清クレアチニン値が上昇するおそれがある。 | 本剤のアルドステロン分泌抑制によりカリウム貯留作用が増強する可能性がある。 危険因子:腎機能障害 |
| ドロスピレノン・エチニルエストラジオール | 血清カリウム値が上昇することがある。 | バルサルタンによる血清カリウム値の上昇とドロスピレノンの抗ミネラルコルチコイド作用によると考えられる。 危険因子:腎障害患者、血清カリウム値の高い患者 |
| トリメトプリム含有製剤 スルファメトキサゾール・トリメトプリム | 血清カリウム値が上昇することがある。 | 血清カリウム値の上昇が増強されるおそれがある。 |
| シクロスポリン | 血清カリウム値が上昇することがある。 | 高カリウム血症の副作用が相互に増強されると考えられる。 |
| 利尿降圧剤 フロセミド トリクロルメチアジド等 [11.1.5参照] | 急激な血圧低下(失神及び意識消失等を伴う)を起こすおそれがある。また、利尿作用が増強されるおそれがある。 高血圧症患者においては、低用量から本剤の投与を開始し、増量する場合は徐々に行うこと。 | 利尿降圧剤投与中は血漿レニン活性が上昇しており、これらの薬剤との併用によりレニン−アンジオテンシン−アルドステロン系阻害作用が増強される可能性がある。 重度のナトリウムないし体液量の減少した患者では、まれに症候性の低血圧が生じることがある。 |
| 非ステロイド性消炎鎮痛剤(NSAIDs) インドメタシン等 | 本剤の降圧作用が減弱することがある。 | NSAIDsの腎プロスタグランジン合成阻害作用により、本剤の降圧作用が減弱することがある。 |
| 非ステロイド性消炎鎮痛剤(NSAIDs) インドメタシン等 | 腎機能を悪化させるおそれがある。 | NSAIDsの腎プロスタグランジン合成阻害作用により、腎血流量が低下するためと考えられる。 危険因子:高齢者、体液量が減少している患者(利尿薬使用患者を含む)、腎機能障害患者 |
| リチウム | リチウム中毒を起こすことがレニン−アンジオテンシン−アルドステロン系阻害剤で報告されている。 利尿薬を使用する場合には、リチウム毒性のリスクがさらに増加するおそれがある。 | 本剤のナトリウム排泄作用により、リチウムの蓄積が起こると考えられている。 |
| シクロスポリン クラリスロマイシン エリスロマイシン | Sacubitrilat又はバルサルタンの曝露量が増加し、副作用が増強されるおそれがある。 | OATP1B1又はOATP1B3を阻害することにより、sacubitrilat及びバルサルタンの血中濃度を上昇させる可能性がある。 |
| ビキサロマー | バルサルタンの血中濃度が約30〜40%に低下したとの報告がある。本剤の作用が減弱するおそれがある。 | リン酸結合性ポリマーにより、同時に服用した場合、バルサルタンの吸収を遅延あるいは減少させる可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 血管性浮腫(0.2%)
舌、声門、喉頭の腫脹等を症状として、気道閉塞につながる血管性浮腫があらわれることがある。このような場合には直ちに投与を中止し、アドレナリン注射、気道確保等適切な処置を行うこと。血管性浮腫が消失しても再投与しないこと。また、腹痛、嘔気、嘔吐、下痢等を伴う腸管血管性浮腫があらわれることがある。[2.3参照]
11.1.4 高カリウム血症(3.9%)
11.1.5 ショック(0.1%未満)、失神(0.2%)、意識消失(0.1%未満)
11.1.6 無顆粒球症注)(頻度不明)、白血球減少注)(0.1%未満)、血小板減少注)(頻度不明)
11.1.7 間質性肺炎注)(0.1%未満)
発熱、咳嗽、呼吸困難、胸部X線異常等を伴う間質性肺炎があらわれることがあるので、このような場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.8 低血糖注)(頻度不明)
脱力感、空腹感、冷汗、手の震え、集中力低下、痙攣、意識障害等があらわれた場合には投与を中止し、適切な処置を行うこと。糖尿病治療中の患者であらわれやすい。
11.1.9 横紋筋融解症注)(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがあるので、このような場合には直ちに投与を中止し、適切な処置を行うこと。
11.1.10 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)注)、皮膚粘膜眼症候群(Stevens-Johnson症候群)注)、多形紅斑注)(いずれも頻度不明)
11.1.11 天疱瘡注)、類天疱瘡注)(いずれも頻度不明)
水疱、びらん等があらわれた場合には、皮膚科医と相談すること。
11.1.12 肝炎注)(頻度不明)[8.3参照]
注)バルサルタンの使用上の注意を踏まえて設定した。
11.2 その他の副作用
| 0.3%以上 | 0.3%未満 | 頻度不明 | |
| 感染症および寄生虫症 | − | − | 咽頭炎注) |
| 血液およびリンパ系障害 | − | 貧血注)、好酸球増多注) | − |
| 代謝および栄養障害 | − | 低カリウム血症、食欲減退注)、低ナトリウム血症注) | − |
| 神経系障害 | 浮動性めまい | 体位性めまい、回転性めまい、頭痛、不眠注)、味覚異常注)、眠気注)、しびれ注) | − |
| 耳および迷路障害 | − | − | 耳鳴注) |
| 心臓障害 | − | 動悸注)、心房細動注) | 頻脈注) |
| 血管障害 | 起立性低血圧 | − | ほてり注) |
| 呼吸器、胸郭および縦隔障害 | 咳嗽 | − | − |
| 胃腸障害 | − | 下痢、悪心、腹痛注)、便秘注)、嘔吐注) | − |
| 皮膚および皮下組織障害 | − | 蕁麻疹注) | 紅斑注)、光線過敏症注) |
| 筋骨格系および結合組織障害 | − | 関節痛注)、腰背部痛注) | 筋肉痛注) |
| 一般・全身障害および投与部位の状態 | 疲労 | 無力症、けん怠感注)、口渇注)、胸痛注) | 浮腫注)、発熱注) |
| 免疫系障害 | − | 過敏症(発疹、そう痒症、アナフィラキシー反応を含む) | − |
| 臨床検査 | − | AST上昇注)、ALT上昇注)、血中尿酸値上昇注)、BUN上昇注)、血清クレアチニン上昇注)、血清カリウム値上昇注)、血糖値上昇注)、CK上昇注) | ビリルビン値の上昇注)、LDH上昇注)、血清コレステロール上昇注)、血清総蛋白減少注)、ALP上昇注) |
12. 臨床検査結果に及ぼす影響
本剤の薬力学的作用により本剤投与後にネプリライシンの基質であるBNPの上昇がみられることから、本剤投与後にBNPを測定する際は値の解釈に注意すること。
13. 過量投与
13.1 症状
本剤の過量投与により、著しい血圧低下が生じ、意識レベルの低下、循環虚脱に至るおそれがある。
13.2 処置
著しい低血圧の場合には、患者を仰臥位にし、速やかに生理食塩液等の静脈注射など適切な処置を行うこと。
なお、sacubitrilat及びバルサルタンは血漿蛋白との結合率が高く、血液透析によって除去できない。[16.3参照]
なお、sacubitrilat及びバルサルタンは血漿蛋白との結合率が高く、血液透析によって除去できない。[16.3参照]
14. 適用上の注意
14.1 薬剤調製時の注意
<粒状錠小児用>
PTPシートから取り出して調剤しないこと。
14.2 薬剤交付時の注意
<製剤共通>
14.2.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
<粒状錠小児用>
14.2.2 以下の使用方法を十分指導すること。
・粒状錠の投与直前に指示された種類及び数のカプセル型容器をPTPシートから取り出すこと。
・絶対にカプセル型容器ごと飲ませないこと。
・粒状錠をカプセル型容器から取り出す際は、白色(粒状錠小児用12.5mg)又は黄色(粒状錠小児用31.25mg)のキャップを上にして慎重に開封すること。
・粒状錠小児用は、1錠単位ではなく1カプセル単位(粒状錠小児用12.5mgは4錠、粒状錠小児用31.25mgは10錠)で含量を管理していることから、1回の投与時にカプセル型容器内の粒状錠はすべて投与することとし、1つのカプセル型容器内の粒状錠を分割して投与しないこと。[7.4参照]
15. その他の注意
15.2 非臨床試験に基づく情報
サクビトリルの幼若ラットを用いた毒性試験において、骨量及び骨長の減少、並びに体重増加抑制が認められた。これらの所見に関して、小児の臨床用量での安全域は確保されていない。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
サクビトリルバルサルタンを経口投与したとき、速やかに溶解し、サクビトリル(体内でエステラーゼにより加水分解され活性代謝物sacubitrilatに変換される)及びバルサルタンに解離する。
(1)健康成人男子にサクビトリルバルサルタン(200mg又は400mg)注1)を空腹時に単回経口投与したとき、sacubitrilatとバルサルタンのCmax及びAUCは投与量に応じて増加し、Tmax及びT1/2は投与量に依存しなかった5)。
| 薬物動態パラメータ | 200mg | 400mg | ||
| 成分 | sacubitrilat | バルサルタン | sacubitrilat | バルサルタン |
| Cmax(ng/mL) | 8,480±1,540 | 3,980±1,390 | 16,200±3,160 | 7,400±1,490 |
| Tmax※(h) | 2.0(1.5〜3.0) | 1.5(1.0〜3.0) | 3.0(1.5〜6.0) | 2.0(1.5〜4.0) |
| AUCinf(ng・h/mL) | 71,800±13,100 | 22,200±6,670 | 138,000±26,800 | 42,900±11,200 |
| T1/2(h) | 13.4±0.975 | 18.9±7.36 | 12.1±0.608 | 12.6±2.61 |
健康成人男子にサクビトリルバルサルタン200mg又は400mgを単回経口投与したときのsacubitrilat及びバルサルタンの血漿中濃度推移(空腹時)(平均値±標準偏差、n=8)
○:本剤200mg投与時、■:本剤400mg投与時
(2)小児慢性心不全患者にサクビトリルバルサルタン(0.8mg/kg又は3.1mg/kg)を単回経口投与したとき、sacubitrilatとバルサルタンのCmax及びAUCは投与量に応じて増加し、年齢区分による曝露量の大きな差は認められなかった6)(外国人のデータ)。
| 年齢区分 | 薬物動態パラメータ | 0.8mg/kg | 3.1mg/kg | ||||
| 成分 | n | sacubitrilat | バルサルタン | n | sacubitrilat | バルサルタン | |
| 6歳以上18歳未満 | Cmax(ng/mL) | 7 | 1,951±839 | 1,271±1,011 | 7 | 6,707±1,887 | 4,035±1,678 |
| Tmax※(h) | 7 | 4.0(2.0〜8.0) | 1.0(0.9〜4.0) | 7 | 2.0(2.0〜4.0) | 2.0(2.0〜4.0) | |
| AUCinf(ng・h/mL) | 7 | 48,264±22,939 | 13,540±12,962 | 7 | 150,440±49,515 | 40,733±21,003 | |
| 1歳以上6歳未満 | Cmax(ng/mL) | 8 | 1,359±711 | 1,112±583 | 6 | 5,453±1,032 | 4,935±1,268 |
| Tmax※(h) | 8 | 2.3(2.0〜4.3) | 1.5(0.9〜4.3) | 6 | 2.3(2.0〜10.0) | 2.0(1.1〜2.4) | |
| AUCinf(ng・h/mL) | 8 | 31,042±17,259 | 11,036±7,031 | 6 | 127,625±35,634 | 48,561±21,163 | |
16.1.2 反復投与
16.2 吸収
健康成人にサクビトリルバルサルタン400mg注1)を低脂肪食又は高脂肪食の摂取後に単回経口投与したとき、sacubitrilatのCmaxは空腹時投与に比べそれぞれ19%及び28%減少したが、AUCは、食事の種類及び食事の時期に関わらず、影響は認められなかった。Tmaxは空腹時投与では2時間、食後投与では4〜6時間であり、食事の種類にかかわらずいずれも延長する傾向がみられた。サクビトリルバルサルタン400mgを低脂肪食の摂取後に単回経口投与したとき、バルサルタンのCmax及びAUCは、空腹時投与に比べそれぞれ39%及び34%低下した。サクビトリルバルサルタン400mgを高脂肪食の摂取後に単回経口投与したとき、バルサルタンのCmax及びAUCは、空腹時投与に比べそれぞれ40%及び9%低下した。Tmaxの中央値は空腹時投与の1.75時間、食後投与では4時間であり、高脂肪食又は低脂肪食摂取後にいずれでも延長する傾向がみられた8)(外国人のデータ)。
16.3 分布
16.4 代謝
健康成人男子にサクビトリル部位に14C標識したサクビトリルバルサルタン200mgを空腹時単回経口投与したとき、エステラーゼにより加水分解を受け、活性代謝物であるsacubitrilatが主に生成した。
なお、健康成人男子に14C標識したバルサルタン80mgを空腹時単回経口投与したとき、投与8時間後の血漿中には、主として未変化体が存在し、その他に代謝物として4-ヒドロキシ体が認められた。In vitroの試験において主にCYP2C9の関与が示唆されている8)(外国人のデータ)。
なお、健康成人男子に14C標識したバルサルタン80mgを空腹時単回経口投与したとき、投与8時間後の血漿中には、主として未変化体が存在し、その他に代謝物として4-ヒドロキシ体が認められた。In vitroの試験において主にCYP2C9の関与が示唆されている8)(外国人のデータ)。
16.5 排泄
健康成人男子にサクビトリルバルサルタン200mg又は400mg注1)を空腹時単回経口投与したとき、投与後96時間までに投与量の約55%がsacubitrilatとして、約11%がバルサルタンとして尿中に排泄された9)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
軽度又は中等度の腎機能障害患者(軽度:クレアチニンクリアランスが50mL/min以上80mL/min以下、中等度:クレアチニンクリアランスが30mL/min以上50mL/min未満)にサクビトリルバルサルタン400mg注1)を反復経口投与したとき、定常状態においてsacubitrilatのCmax及びAUCは健康成人のそれぞれ約1.5〜1.6倍及び約2.1〜2.2倍であった。バルサルタンのCmaxは健康成人とほぼ同程度であったが、AUCは健康成人の約1.0〜1.4倍であった。重度の腎機能障害患者(クレアチニンクリアランスが30mL/min未満)にサクビトリルバルサルタン400mg注1)を反復経口投与したとき、定常状態においてsacubitrilatのCmax及びAUCは健康成人のそれぞれ約1.6倍及び約2.7倍であった。バルサルタンのCmax及びAUCは健康成人のそれぞれ約0.9倍及び約1.3倍であった8)(外国人のデータ)。[9.2.1-9.2.4参照]
16.6.2 肝機能障害患者
16.6.3 高齢者
16.7 薬物相互作用
16.7.1 アトルバスタチン
16.7.2 In vitro試験
SacubitrilatはOAT3の基質であり、バルサルタンはOAT3及びMRP2の基質であることが示された。
16.8 その他
健康成人に本剤又はバルサルタン製剤注2)を単回経口投与したとき、バルサルタンの薬物動態パラメータは下表のとおりであった5)11)12)。
| バルサルタン含量 | 例数 | Cmax(ng/mL) | AUCinf(ng・h/mL) | |
| 本剤200mg | 103mg | 8 | 3,980±1,390 | 22,200±6,670 |
| バルサルタン製剤80mg | 80mg | 30 | 2,780±1,070 | 19,800±8,240 |
| バルサルタン製剤160mg | 160mg | 40 | 5,770±1,730 | 38,900±11,100 |
注1)慢性心不全における本剤の承認された用法及び用量はサクビトリルバルサルタンとして1回最大200mgを1日2回である。
注2)国内で承認されたバルサルタン製剤の用法及び用量は1日1回40〜80mg、1回最大160mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<慢性心不全>
17.1.1 海外第III相試験(PARADIGM-HF試験)(成人)
アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬注1)を含む慢性心不全に関する既存治療下の左室駆出率(LVEF)が低下した外国人慢性心不全(HFrEF)患者注2)[NYHA心機能分類II〜IV度、LVEF35%以下(試験開始後、40%以下より変更)]8442例を対象に、アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬から本剤又はエナラプリルに切り替えて投与し、生命予後改善効果を検証する多施設共同、ランダム化二重盲検並行群間比較試験を実施した。実薬投与観察期では、エナラプリル10mg(忍容性に懸念がある場合は5mgから)1日2回注3)、本剤100mg 1日2回、200mg 1日2回を順に最長10週間投与し、ランダム化後、二重盲検治療期では目標用量(本剤200mg 1日2回又はエナラプリル10mg 1日2回)を投与した。目標用量に対して忍容でない場合は用量調節(本剤は50又は100mg 1日2回、エナラプリルは2.5又は5mg 1日2回)又は一時中断を可とし、忍容性が良好な最大用量を継続投与した。二重盲検治療期における治験薬の投与期間(中央値)は本剤群24.4ヵ月、エナラプリル群23.5ヵ月であった。
主要評価項目とした複合エンドポイント(心血管死又は心不全による初回入院)は、下表のとおりであった。
主要評価項目とした複合エンドポイント(心血管死又は心不全による初回入院)は、下表のとおりであった。
| 本剤群 (4187例) | エナラプリル群 (4212例) | ハザード比*(95%信頼区間) | |
| n(発現割合%) | |||
| 心血管死又は心不全による初回入院 | 914(21.83) | 1117(26.52) | 0.80**(0.73,0.87) |
二重盲検治療期の副作用発現頻度は、本剤群で21.65%(910/4203例)、エナラプリル群で23.08%(976/4229例)であった。主な副作用は低血圧(本剤群10.23%、エナラプリル群6.93%、以下同順)、高カリウム血症(4.59%、5.60%)、腎機能障害(2.78%、4.23%)であった13)。[5.1、5.2、7.1参照]
注1)アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬を4週間以上投与されている患者が組入れ可能とされた。
注2)[1]症候性低血圧を有する、又は収縮期血圧が100mmHg未満の患者、[2]eGFRが30mL/min/1.73m2未満の患者、[3]血清カリウム値が5.2mmol/L(mEq/L)を超える患者は除外された。
注3)国内で承認されたエナラプリルの用法及び用量は5〜10mgを1日1回である。
17.1.2 国内第III相試験(PARALLEL-HF試験)(成人)
アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬注4)を含む慢性心不全に関する既存治療下のLVEFが低下した日本人慢性心不全(HFrEF)患者注5)(NYHA心機能分類II〜IV度、LVEF35%以下)225例を対象に、アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬から本剤又はエナラプリルに切り替えて投与し、生命予後改善効果を検討する多施設共同、ランダム化二重盲検並行群間比較試験を実施した。実薬投与観察期では本剤50mg 1日2回を2週間投与し、ランダム化後、二重盲検治療期では本剤100mg 1日2回又はエナラプリル5mg 1日2回を4週間投与後、忍容性が良好な場合に目標用量(本剤200mg 1日2回又はエナラプリル10mg 1日2回注6))に増量した。目標用量に対して忍容でない場合は用量調節(本剤は50又は100mg 1日2回、エナラプリルは2.5又は5mg 1日2回)又は一時中断を可とし、忍容性が良好な最大用量を継続投与した。二重盲検治療期における治験薬の投与期間(中央値)は本剤群32.0ヵ月、エナラプリル群31.2ヵ月であった。
主要評価項目とした複合エンドポイント(心血管死又は心不全による初回入院)は、本剤群(111例)の30例(27.03%)、エナラプリル群(112例)の28例(25.00%)に認められた。複合エンドポイント発現のエナラプリル群に対する本剤群のハザード比(95%信頼区間)*は1.0881(0.6501、1.8212)であった。なお、本試験はハザード比の点推定値が1未満となることの確認を主たる目的とし、有意差検定を主たる目的とはしていない。
主要評価項目とした複合エンドポイント(心血管死又は心不全による初回入院)は、本剤群(111例)の30例(27.03%)、エナラプリル群(112例)の28例(25.00%)に認められた。複合エンドポイント発現のエナラプリル群に対する本剤群のハザード比(95%信頼区間)*は1.0881(0.6501、1.8212)であった。なお、本試験はハザード比の点推定値が1未満となることの確認を主たる目的とし、有意差検定を主たる目的とはしていない。
*:ハザード比及びその95%信頼区間は、投与群及び層別因子であるスクリーニング時のヒト脳性ナトリウム利尿ペプチド前駆体N端フラグメント(NT-proBNP)(<1600pg/mL、≧1600pg/mL)を固定効果とするCox比例ハザードモデルで推定した。
二重盲検治療期の副作用発現頻度は、本剤群で51.35%(57/111例)、エナラプリル群で31.25%(35/112例)であった。主な副作用は低血圧(本剤群17.12%、エナラプリル群4.46%、以下同順)、高カリウム血症(7.21%、7.14%)、腎機能障害(6.31%、7.14%)であった14)。[5.1、5.2、7.1、7.2参照]
注4)アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬を4週間以上投与されている患者が組入れ可能とされた。
注5)[1]症候性低血圧を有する、又は収縮期血圧が100mmHg未満の患者、[2]eGFRが30mL/min/1.73m2未満の患者、[3]血清カリウム値が5.2mmol/L(mEq/L)を超える患者は除外された。
注6)国内で承認されたエナラプリルの用法及び用量は5〜10mgを1日1回である。
17.1.3 国際共同第II/III相試験(PANORAMA-HF試験、二重盲検期)(小児)
左室収縮機能障害による小児慢性心不全患者注7)(生後1ヵ月〜18歳未満)377例(日本人12例を含む)を対象に、本剤又はエナラプリルを漸増投与し、臨床イベント、症状、機能状態及びQOLに基づく複合評価項目(Global rank endpoint注8))を用いてエナラプリルに対する本剤の相対的な有効性を検討する多施設共同、ランダム化二重盲検並行群間比較試験を実施した(本剤群187例、エナラプリル群188例)。組み入れられた被験者の主な基礎疾患は、特発性心筋症(本剤群34.22%、エナラプリル群32.98%、以下同順)、家族性心筋症(15.51%、15.96%)、先天性心疾患(11.23%、15.43%)、心筋炎(10.70%、14.89%)であった。また、前治療として、アンジオテンシン変換酵素阻害薬又はアンジオテンシンII受容体拮抗薬が投与されていた患者割合は本剤群92.0%、エナラプリル群93.1%、投与されていなかった患者割合は本剤群8.0%、エナラプリル群6.9%であった。本剤(0.8〜3.1mg/kg、又は50〜200mg)又はエナラプリル(0.05〜0.2mg/kg、又は2.5〜10mg)を1日2回注9)、忍容性に応じて約2週間間隔で目標用量(用量範囲の最大用量)まで漸増し、52週間投与した。目標用量又は漸増用量に対して忍容でない場合は減量又は一時中断を可とし、忍容性が良好な最大用量を継続投与した。
主要評価項目であるGlobal rank endpointについて、層別Wilcoxon順位和検定の結果が有意、かつMann-Whitney確率の点推定値が0.5より大きい(Mann-Whitneyオッズ点推定値が1より小さい)場合、エナラプリルに対する本剤の優越性が示されたと判断することとした。Global rank endpointの解析結果は、下表のとおりであり、本剤群のエナラプリル群に対する優越性は検証されなかった。
主要評価項目であるGlobal rank endpointについて、層別Wilcoxon順位和検定の結果が有意、かつMann-Whitney確率の点推定値が0.5より大きい(Mann-Whitneyオッズ点推定値が1より小さい)場合、エナラプリルに対する本剤の優越性が示されたと判断することとした。Global rank endpointの解析結果は、下表のとおりであり、本剤群のエナラプリル群に対する優越性は検証されなかった。
| MWP(95%信頼区間) | MWO(95%信頼区間) | p値*(両側) |
| 0.52(0.47,0.58) | 0.907(0.72,1.14) | 0.424 |
| 本剤群 (187例) | エナラプリル群 (188例) | |
| n(該当割合%) | ||
| カテゴリー1 | 19(10.16) | 30(15.96) |
| カテゴリー2 | 18(9.63) | 9(4.79) |
| カテゴリー3 | 20(10.70) | 15(7.98) |
| カテゴリー4 | 45(24.06) | 57(30.32) |
| カテゴリー5 | 85(45.45) | 77(40.96) |
探索的評価項目であるNT-proBNPのベースラインからの調整済み変化比の推移は下表のとおりであった。
| 本剤群(187例) | エナラプリル群(188例) | |||
| 時点 | 例数 | 対ベースライン比*(95%信頼区間) | 例数 | 対ベースライン比*(95%信頼区間) |
| 4週 | 81 | 0.599(0.528,0.679) | 76 | 0.820(0.721,0.934) |
| 12週 | 159 | 0.503(0.442,0.571) | 155 | 0.551(0.484,0.628) |
| 52週 | 144 | 0.349(0.288,0.423) | 133 | 0.384(0.315,0.469) |
試験期間中の副作用発現頻度は、本剤群で26.74%(50/187例)、エナラプリル群で28.19%(53/188例)であった。主な副作用は低血圧(本剤群8.02%、エナラプリル群7.45%、以下同順)、浮動性めまい(4.81%、2.13%)、頭痛(2.14%、1.60%)、腎機能障害(2.14%、0.53%)であった15)。[5.3、5.4、7.1、7.2、9.7.1参照]
注7)NYHA心機能分類がII〜IV(6歳〜18歳未満)又はRoss分類がII〜IV(6歳未満)の患者で体心室が左室の二心室の患者。LVEFが40%以下、又は左室内径短縮率が20%以下(試験開始後、それぞれ45%、22.5%に変更)が組入れ可能とされ、[1]単心室又は体心室が右室の患者、[2]拘束型又は肥大型心筋症を有する患者、[3]未手術の閉塞性弁又は重度の逆流性弁(大動脈弁、肺動脈弁又は三尖弁)疾患、若しくは重大な左室流出路閉塞又は大動脈弓閉塞を有する患者、[4]症候性低血圧を有する、又は収縮期血圧が年齢別に算出した収縮期血圧の下位5%分位点16)未満、[5]血清カリウム値が5.3mmol/L(mEq/L)を超える患者は除外された。
注8)臨床イベント(死亡、心臓移植待機リスト(UNOS)への登録、循環又は呼吸の機械的補助の必要性)、心不全の悪化、NYHA/Ross機能分類、重症度に関する患者の全般的印象(PGIS)、及び健康関連QOL指標(PedsQL)の身体機能ドメインに基づき、臨床的な重症度の高い順に患者を5つの階層的なカテゴリーに順位付けし、評価する複合評価項目。各カテゴリーの内容は以下のとおり。
カテゴリー1
死亡、UNOSのステータス1Aに登録又はそれに相当、試験終了時に生命維持のために補助人工心臓(VAD)/体外式膜型人工肺(ECMO)/機械的換気/大動脈内バルーンポンプが必要
カテゴリー2
心不全の悪化(心不全の治療強化*が必要な心不全悪化の症状及び徴候)。カテゴリー2はさらに重症度の高い順に、ICUへの入院が必要なもの、ICU以外への入院が必要なもの、入院を必要としないものに細分化、順位付けされる。
*心不全の悪化に対する治療には利尿薬、血管拡張薬、昇圧薬、強心薬の静脈内投与、機器的補助又は循環補助の施術(限外濾過、血液透析、VAD、ECMO、大動脈内バルーンポンプ、機械的換気等)が含まれる。経口薬の場合は、利尿薬の新規投与又は維持量の50%以上の増量が2週間以上継続する場合に該当する。
カテゴリー3〜5
順にNYHA/Ross機能分類又はPGISの悪化、NYHA/Ross機能分類及びPGISの変化なし、NYHA/Ross機能分類又はPGISの改善(いずれも悪化なし)。変化の程度が同じ場合は、さらにPedsQLの身体機能ドメインを用いて同一カテゴリー内での順位付けを行う。いずれも最終評価時点におけるベースラインとの比較。
注9)エナラプリルの小児への用法及び用量は国内で承認されていない。
<高血圧症>
17.1.4 国内第III相試験
軽症又は中等症の日本人本態性高血圧症患者1161例(新たに高血圧症と診断された患者3例、高血圧症の既往を有する患者1158例注10))を対象に、本剤200mg、400mg、又はオルメサルタン20mgを投与し、降圧効果を検討する多施設共同、ランダム化二重盲検並行群間比較試験を実施した。ランダム化後、二重盲検治療期では本剤200mg 1日1回、本剤400mg 1日1回(本剤200mg 1日1回を1週間投与後に400mgに増量)又はオルメサルタン20mg 1日1回を8週間投与した。
主要評価項目とした投与8週時(LOCF*)の平均坐位収縮期血圧のベースラインからの変化量(最小二乗平均値(標準誤差))は、本剤200mg群で−18.21(0.702)mmHg、オルメサルタン20mg群で−13.20(0.700)mmHgであった。本剤200mg群とオルメサルタン20mg群の群間差(最小二乗平均値(標準誤差))は−5.01(0.991)mmHgであり、本剤200mg群でのオルメサルタン20mgに対する優越性が検証された。
主要評価項目とした投与8週時(LOCF*)の平均坐位収縮期血圧のベースラインからの変化量(最小二乗平均値(標準誤差))は、本剤200mg群で−18.21(0.702)mmHg、オルメサルタン20mg群で−13.20(0.700)mmHgであった。本剤200mg群とオルメサルタン20mg群の群間差(最小二乗平均値(標準誤差))は−5.01(0.991)mmHgであり、本剤200mg群でのオルメサルタン20mgに対する優越性が検証された。
*LOCF:Last observation carried forward
| 投与群 (n=例数) | 平均坐位血圧(mmHg) | |||||
| 収縮期 | 拡張期 | |||||
| 投与前値 | 変化量 | オルメサルタン20mgに対する群間差※ | 投与前値 | 変化量 | オルメサルタン20mgに対する群間差※ | |
| 本剤200mg (n=387) | 157.7±6.89 | −18.21±0.702 | −5.01±0.991 (−6.949,−3.061) p<0.001# | 94.3±9.38 | −7.76±0.404 | −1.85±0.571 (−2.976,−0.734) |
| 本剤400mg (n=385) | 158.4±7.29 | −20.18±0.704 | −6.97±0.993 (−8.922,−5.025) | 94.8±9.76 | −8.79±0.406 | −2.89±0.572 (−4.008,−1.762) |
| オルメサルタン20mg (n=389) | 157.6±6.77 | −13.20±0.700 | − | 93.8±9.65 | −5.91±0.404 | − |
本剤200mg群での投与8週時(LOCF)の24時間自由行動下測定による平均収縮期血圧(maSBP)のベースラインからの変化量(平均値)は、24時間にわたるすべての時点で、オルメサルタン20mg群に比べて大きかった。本剤400mg群の変化量は、ほとんどの時点で本剤200mg群に比べて大きかった。
投与8週時のmaSBPの変化量(平均値)の24時間推移(平均値±標準誤差)
治療期の副作用発現頻度は、本剤200mg群で4.7%(18/387例)、本剤400mg群で4.4%(17/385例)、及びオルメサルタン20mg群で4.4%(17/389例)であった。主な副作用は、回転性めまい(本剤200mg群0.5%、本剤400mg群0%、オルメサルタン20mg群0%、以下同順)、血中クレアチンホスホキナーゼ増加(0.3%、0.3%、0.5%)、血圧上昇(0%、0%、0.5%)、高カリウム血症(0.5%、0.3%、0%)、体位性めまい(0%、0.3%、0.5%)、浮動性めまい(0.5%、0%、0%)、そう痒症(0%、0.5%、0%)であった17)。[7.5参照]
注10)
新たに高血圧症と診断された患者
観察期開始時及び治療期開始時の平均坐位収縮期血圧がいずれも150mmHg以上180mmHg未満の患者
高血圧症の既往を有する患者
スクリーニングの少なくとも4週間前から降圧薬の投与を受けておらず、観察期開始時及び治療期開始時の平均坐位収縮期血圧がいずれも150mmHg以上180mmHg未満の患者。またはスクリーニング前4週間以内に降圧薬を使用しており、治療期開始時直前の来院時の平均坐位収縮期血圧が140mmHg以上180mmHg未満、かつ治療期開始時の平均坐位収縮期血圧が150mmHg以上180mmHg未満の患者
18. 薬効薬理
18.1 作用機序
サクビトリルバルサルタンは、サクビトリル及びバルサルタンに解離して、それぞれネプリライシン(NEP)及びアンジオテンシンIIタイプ1(AT1)受容体を阻害する。サクビトリルは、エステラーゼによりNEP阻害の活性体であるsacubitrilatに速やかに変換される。NEP阻害は、血管拡張作用、利尿作用、レニン−アンジオテンシン−アルドステロン系(RAAS)抑制作用、交感神経抑制作用、心肥大抑制作用、抗線維化作用、及びアルドステロン分泌抑制作用を有するナトリウム利尿ペプチドの作用亢進に寄与する。バルサルタンのAT1受容体拮抗作用は、血管収縮、腎ナトリウム・体液貯留、心筋肥大、及び心血管リモデリング異常に対する抑制作用をもたらす。
18.2 ナトリウム利尿ペプチド系及びRAASに対する作用
18.2.1 心房性ナトリウム利尿ペプチド(ANP)を持続静注したラットにサクビトリルバルサルタンを単回経口投与したとき、用量依存的に血漿中ANP濃度が上昇した18)。
18.2.2 低ナトリウム食飼育イヌにサクビトリルバルサルタンを反復経口投与したとき、溶媒投与の対照群と比較して有意な血漿中cGMP濃度の上昇及び血漿中アルドステロン濃度の低下がみられた19)。
18.3 利尿作用
18.3.1 生理食塩水を持続静注したラットにサクビトリルを十二指腸内投与したとき、ANP投与による尿中ナトリウム排泄は溶媒投与の対照群と比較して有意に増強された20)。
18.3.2 正常イヌにsacubitrilatを静脈内投与したとき、ANP投与による利尿及び尿中ナトリウム排泄は溶媒投与の対照群と比較して有意に増強された21)。
18.4 心筋肥大抑制作用
アンジオテンシンIIを介して誘発されるラット心筋細胞の肥大は、sacubitrilat及びバルサルタン併用投与により抑制された22)。
18.5 抗線維化作用
アンジオテンシンIIを介して誘発されるラット心線維芽細胞のコラーゲン産生は、sacubitrilat及びバルサルタンの併用投与により抑制された22)。
18.6 降圧作用
19. 有効成分に関する理化学的知見
19.1. サクビトリルバルサルタンナトリウム水和物
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<エンレスト錠50mg>
100錠[10錠(PTP)×10]
<エンレスト錠100mg>
100錠[10錠(PTP)×10]
500錠[瓶、バラ]
<エンレスト錠200mg>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
<エンレスト粒状錠小児用12.5mg>
カプセル型容器30個[カプセル型容器10個(PTP)×3]
<エンレスト粒状錠小児用31.25mg>
カプセル型容器30個[カプセル型容器10個(PTP)×3]
23. 主要文献
- 阿部真也ほか, 周産期医学, 47, 1353-1355, (2017)
- 齊藤大祐ほか, 鹿児島産科婦人科学会雑誌, 29, 49-54, (2021)
- Sheps,S.G.et al., Arch.Intern.Med., 157 (21), 2413-2446, (1997)
- Briggs,G.G.et al., Ann.Pharmacother., 35 (7-8), 859-861, (2001) »PubMed
- Akahori M,et al., Eur J Drug Metab Pharmacokinet., 42 (3), 407-416, (2017) »PubMed
- 社内資料:小児の薬物動態(2024年2月9日承認、CTD2.7.2.2.2.1)
- 社内資料:メトホルミンとの薬物間相互作用(2020年6月29日承認、CTD2.7.2.2.2.2)
- Ayalasomayajula S,et al., Clin Pharmacokinet., 56 (12), 1461-1478, (2017) »PubMed
- 社内資料:健康成人の尿中濃度(2020年6月29日承認、CTD2.7.2.3.1.4)
- Ayalasomayajula S,et al., Eur J Drug Metab Pharmacokinet., 42 (2), 309-318, (2017) »PubMed
- 社内資料:バイオアベイラビリティ試験(VAL489A1102試験)
- 社内資料:バイオアベイラビリティ試験(VNP489A2106試験)
- 社内資料:海外第III相試験(2020年6月29日承認、CTD2.7.6.4.1.2)
- 社内資料:国内第III相試験(2020年6月29日承認、CTD2.7.6.4.1.1)
- 社内資料:国際共同第II/III相試験(2024年2月9日承認、CTD2.7.6.4.1.1)
- Kleinman ME,et al., Circulation, 122 (18 Suppl 3), S876-908, (2010) »PubMed
- 社内資料:国内第III相試験(2021年9月27日承認、CTD2.7.6.4.1.4)
- 社内資料:ラット血漿中ANP濃度に対する作用(2020年6月29日承認、CTD2.6.2.2.3.3)
- 社内資料:低ナトリウム食飼育イヌの血漿中cGMP及びアルドステロンに対する作用(2020年6月29日承認、CTD2.6.2.2.6.2)
- 社内資料:ラットのANP誘発尿中ナトリウム排泄に対する作用(2020年6月29日承認、CTD2.6.2.2.4.2)
- Ksander GM,et al., J.Med.Chem., 38 (10), 1689-1700, (1995) »PubMed
- von Lueder TG,et al., Circ.Heart Fail., 6 (3), 594-605, (2013) »PubMed
- 社内資料:ダブルトランスジェニックラットにおける降圧作用(2020年6月29日承認、CTD2.6.2.2.5.7)
- 社内資料:高血圧自然発症ラットにおける降圧作用(2020年6月29日承認、CTD2.6.2.2.5.7)
- 社内資料:Dahl食塩感受性ラットにおける降圧作用(2020年6月29日承認、CTD2.6.2.2.5.7)
24. 文献請求先及び問い合わせ先
文献請求先
ノバルティスファーマ株式会社
ノバルティスダイレクト
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-003-293 受付時間:月〜金 9:00〜17:30(祝日及び当社休日を除く)
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
製品情報問い合わせ先
ノバルティスファーマ株式会社
ノバルティスダイレクト
〒105-6333
東京都港区虎ノ門1-23-1
電話:0120-003-293 受付時間:月〜金 9:00〜17:30(祝日及び当社休日を除く)
大塚製薬株式会社
医薬情報センター
〒108-8242
東京都港区港南2-16-4 品川グランドセントラルタワー
電話:0120-189-840
26. 製造販売業者等
26.1 製造販売(輸入)
ノバルティスファーマ株式会社
東京都港区虎ノ門1-23-1
26.2 提携
大塚製薬株式会社
東京都千代田区神田司町2-9