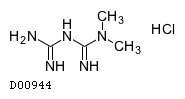
医薬品情報
| 総称名 | メトホルミン塩酸塩 |
|---|---|
| 一般名 | メトホルミン塩酸塩 |
| 欧文一般名 | Metformin Hydrochloride |
| 薬効分類名 | ビグアナイド系経口血糖降下剤 |
| 薬効分類番号 | 3962 |
| ATCコード | A10BA02 |
| KEGG DRUG |
D00944
メトホルミン塩酸塩
|
| KEGG DGROUP |
DG02044
血糖降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年11月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| メトホルミン塩酸塩錠250mgMT「明治」 | METFORMIN HYDROCHLORIDE Tablets MT「MEIJI」 | Meiji Seikaファルマ | 3962002F2132 | 10.4円/錠 | 劇薬, 処方箋医薬品注) |
| メトホルミン塩酸塩錠500mgMT「明治」 | METFORMIN HYDROCHLORIDE Tablets MT「MEIJI」 | Meiji Seikaファルマ | 3962002F3139 | 10.4円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 次に示す患者[乳酸アシドーシスを起こしやすい。][1.1、8.1、11.1.1参照]
・乳酸アシドーシスの既往のある患者
・重度の腎機能障害(eGFR 30mL/min/1.73m2未満)のある患者又は透析患者(腹膜透析を含む)[9.2.1参照]
・重度の肝機能障害のある患者[9.3.1参照]
・心血管系、肺機能に高度の障害(ショック、心不全、心筋梗塞、肺塞栓等)のある患者及びその他の低酸素血症を伴いやすい状態にある患者[嫌気的解糖の亢進により乳酸産生が増加する。]
・脱水症の患者又は脱水状態が懸念される患者(下痢、嘔吐等の胃腸障害のある患者、経口摂取が困難な患者等)
・過度のアルコール摂取者[10.1参照]
2.2 重症ケトーシス、糖尿病性昏睡又は前昏睡、1型糖尿病の患者[輸液、インスリンによる速やかな高血糖の是正が必須である。]
2.4 栄養不良状態、飢餓状態、衰弱状態、脳下垂体機能不全又は副腎機能不全の患者[低血糖を起こすおそれがある。][11.1.2参照]
2.6 本剤の成分又はビグアナイド系薬剤に対し過敏症の既往歴のある患者
4. 効能または効果
ただし、下記のいずれかの治療で十分な効果が得られない場合に限る。
(1)食事療法・運動療法のみ
(2)食事療法・運動療法に加えてスルホニルウレア剤を使用
ただし、肥満、耐糖能異常、又はインスリン抵抗性のいずれかを呈する患者に限る。
5. 効能または効果に関連する注意
<多嚢胞性卵巣症候群における排卵誘発、多嚢胞性卵巣症候群の生殖補助医療における調節卵巣刺激>
5.1 糖尿病を合併する多嚢胞性卵巣症候群の患者では糖尿病の治療を優先すること。
<多嚢胞性卵巣症候群における排卵誘発>
5.2 ゴナドトロピン製剤を除く排卵誘発薬で十分な効果が得られない場合に本剤の併用を考慮すること。
6. 用法及び用量
<2型糖尿病>
通常、成人にはメトホルミン塩酸塩として1日500mgより開始し、1日2〜3回に分割して食直前又は食後に経口投与する。維持量は効果を観察しながら決めるが、通常1日750〜1,500mgとする。なお、患者の状態により適宜増減するが、1日最高投与量は2,250mgまでとする。
通常、10歳以上の小児にはメトホルミン塩酸塩として1日500mgより開始し、1日2〜3回に分割して食直前又は食後に経口投与する。維持量は効果を観察しながら決めるが、通常1日500〜1,500mgとする。なお、患者の状態により適宜増減するが、1日最高投与量は2,000mgまでとする。
<多嚢胞性卵巣症候群における排卵誘発>
他の排卵誘発薬との併用で、通常、メトホルミン塩酸塩として500mgの1日1回経口投与より開始する。患者の忍容性を確認しながら増量し、1日投与量として1,500mgを超えない範囲で、1日2〜3回に分割して経口投与する。なお、本剤は排卵までに中止する。
<多嚢胞性卵巣症候群の生殖補助医療における調節卵巣刺激>
他の卵巣刺激薬との併用で、通常、メトホルミン塩酸塩として500mgの1日1回経口投与より開始する。患者の忍容性を確認しながら増量し、1日投与量として1,500mgを超えない範囲で、1日2〜3回に分割して経口投与する。なお、本剤は採卵までに中止する。
7. 用法及び用量に関連する注意
中等度の腎機能障害のある患者(eGFR 30mL/min/1.73m2以上60mL/min/1.73m2未満)では、メトホルミンの血中濃度が上昇し、乳酸アシドーシスの発現リスクが高くなる可能性があるため、以下の点に注意すること。特に、eGFRが30mL/min/1.73m2以上45mL/min/1.73m2未満の患者には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[8.1、9.2.2、11.1.1、16.6.1参照]
・投与は、少量より開始すること。
・投与中は、より頻回に腎機能(eGFR等)を確認するなど慎重に経過を観察し、投与の適否及び投与量の調節を検討すること。
・効果不十分な場合は、メトホルミン塩酸塩として1日最高投与量を下表の目安まで増量することができるが、効果を観察しながら徐々に増量すること。また、投与にあたっては、1日量を1日2〜3回分割投与すること。
| 推算糸球体濾過量(eGFR)(mL/min/1.73m2) | 1日最高投与量の目安 |
| 45≦eGFR<60 | 1,500mg |
| 30≦eGFR<45 | 750mg |
8. 重要な基本的注意
<効能共通>
8.1 まれに重篤な乳酸アシドーシスを起こすことがある。リスク因子としては、腎機能障害、肝機能障害、低酸素血症を伴いやすい状態、脱水(利尿作用を有する薬剤の併用を含む)、過度のアルコール摂取、感染症、高齢者等が知られている。特に、脱水、過度のアルコール摂取等により患者の状態が急変することもあるので、以下の点に注意すること。[1.1、1.2、2.3、11.1.1参照]
(1)本剤の投与開始前及びその後も投与中は定期的に、腎機能(eGFR等)及び肝機能を確認するとともに、患者の状態に十分注意して投与の適否及び投与量の調節を検討すること。なお、高齢者等、特に慎重な経過観察が必要な場合には、より頻回に確認すること。[2.1、7.、9.2、9.3、9.8参照]
(3)本剤の投与開始時及びその後も投与中は適切に、以下の内容を患者及びその家族に十分指導すること。
・乳酸アシドーシスの症状(胃腸障害、倦怠感、筋肉痛、過呼吸等)があらわれた場合には、直ちに受診すること。[11.1.1参照]
(4)ヨード造影剤を用いて検査を行う患者においては、本剤の併用により乳酸アシドーシスを起こすことがあるので、検査前は本剤の投与を一時的に中止すること(ただし、緊急に検査を行う必要がある場合を除く)。ヨード造影剤投与後48時間は本剤の投与を再開しないこと。なお、投与再開時には、患者の状態に注意すること。[10.2.1参照]
8.2 低血糖症状を起こすことがあるので、高所作業、自動車の運転等に従事している患者に投与するときには注意すること。[11.1.2参照]
<2型糖尿病>
8.4 投与する場合には、少量より開始し、血糖値、尿糖等を定期的に検査し、薬剤の効果を確かめ、本剤を3〜4ヵ月投与しても効果が不十分な場合には、速やかに他の治療法への切り替えを行うこと。
<多嚢胞性卵巣症候群における排卵誘発、多嚢胞性卵巣症候群の生殖補助医療における調節卵巣刺激>
8.6 本剤は、不妊治療に十分な知識と経験のある医師のもとで使用すること。本剤投与により予想されるリスク及び妊娠初期の本剤の服用を避けるための服用中止時期について、あらかじめ患者に説明を行うこと。[2.5、9.4、9.5参照]
8.7 患者に対しては、あらかじめ以下の点を説明すること。
・本剤との関連は明確ではないが、本剤を用いた不妊治療において、卵巣過剰刺激症候群があらわれることがあるので、自覚症状(下腹部痛、下腹部緊迫感、悪心、腰痛等)や急激な体重増加が認められた場合には直ちに医師等に相談すること。
・多嚢胞性卵巣症候群における排卵誘発に本剤を用いた場合、卵巣過剰刺激の結果として多胎妊娠となる可能性があること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 低血糖を起こすおそれのある以下の患者又は状態
9.1.2 感染症
9.2 腎機能障害患者
腎臓における排泄が減少しメトホルミンの血中濃度が上昇するため、乳酸アシドーシス等の発現リスクが高くなる可能性がある。[1.1、1.2、9.8、11.1.1、16.6.1参照]
9.2.1 重度の腎機能障害のある患者(eGFR 30mL/min/1.73m2未満)又は透析患者(腹膜透析を含む)
投与しないこと。[2.1参照]
9.2.2 中等度の腎機能障害のある患者(eGFR 30mL/min/1.73m2以上60mL/min/1.73m2未満)
慎重に経過を観察し、投与の適否及び投与量の調節を検討すること。特に、eGFRが30mL/min/1.73m2以上45mL/min/1.73m2未満の患者には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。[7.、8.1参照]
9.2.3 軽度の腎機能障害のある患者[8.1参照]
9.3 肝機能障害患者
9.4 生殖能を有する者
<多嚢胞性卵巣症候群における排卵誘発、多嚢胞性卵巣症候群の生殖補助医療における調節卵巣刺激>
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行が認められている。
9.7 小児等
低出生体重児、新生児、乳児、幼児を対象とした臨床試験は実施していない。10歳未満の小児への使用経験は限られている。
9.8 高齢者
高齢者では、腎機能、肝機能等が低下していることが多く、また脱水症状を起こしやすい。これらの状態では乳酸アシドーシスを起こしやすいので、以下の点に注意すること。[1.2、8.1、9.2、9.3、11.1.1、16.6.2参照]
・本剤の投与開始前、投与中は定期的に、特に慎重な経過観察が必要な場合にはより頻回に腎機能や肝機能を確認するなど十分に観察しながら慎重に投与すること。本剤はほとんど代謝されず、未変化体のまま尿中に排泄される。また、肝機能の低下により乳酸の代謝能が低下する。[16.4、16.5参照]
・腎機能や脱水症状等患者の状態に十分注意して投与の中止や減量を検討すること。特に75歳以上の高齢者では、本剤投与の適否をより慎重に判断すること。乳酸アシドーシスが多く報告されており、予後も不良であることが多い。国内における本剤の承認時までの臨床試験において、75歳以上の高齢者への1日1,500mgを超える用量の使用経験は限られている。[17.1.1参照]
・血清クレアチニン値が正常範囲内であっても、eGFR等も考慮して、慎重に患者の状態を観察すること。年齢によっては実際の腎機能が低下していることがある。
10. 相互作用
相互作用序文
薬物代謝酵素用語
OCT2
10.1 併用禁忌
10.2 併用注意
| ヨード造影剤 [8.1、11.1.1参照] | 併用により乳酸アシドーシスを起こすことがある。 ヨード造影剤を用いて検査を行う場合には、本剤の投与を一時的に中止すること。 | 腎機能が低下し、本剤の排泄が低下することが考えられている。 |
| 腎毒性の強い抗生物質 ゲンタマイシン等 [11.1.1参照] | 併用により乳酸アシドーシスを起こすことがある。併用する場合は本剤の投与を一時的に減量・中止するなど適切な処置を行うこと。 | 腎機能が低下し、本剤の排泄が低下することが考えられている。 |
| 利尿作用を有する薬剤 利尿剤 SGLT2阻害剤 等 [8.1、11.1.1参照] | 脱水により乳酸アシドーシスを起こすことがある。脱水症状があらわれた場合には、本剤の投与を中止し、適切な処置を行うこと。 | 利尿作用を有する薬剤により、体液量が減少し脱水状態になることがある。 |
| 糖尿病用薬 インスリン製剤 スルホニルウレア剤 速効型インスリン分泌促進薬 α-グルコシダーゼ阻害剤 チアゾリジン系薬剤 DPP-4阻害剤 GLP-1受容体作動薬 SGLT2阻害剤 イメグリミン塩酸塩 等 [11.1.2参照] | 併用により低血糖が起こることがある。 スルホニルウレア剤併用時に低血糖のリスクが増加するおそれがある。 患者の状態を十分観察しながら投与する。 | 併用による血糖降下作用の増強。 |
| たん白同化ホルモン剤 | 併用により低血糖が起こることがある。 スルホニルウレア剤併用時に低血糖のリスクが増加するおそれがある。 患者の状態を十分観察しながら投与する。 | 機序不明。 |
| サリチル酸剤 アスピリン等 | 併用により低血糖が起こることがある。 スルホニルウレア剤併用時に低血糖のリスクが増加するおそれがある。 患者の状態を十分観察しながら投与する。 | サリチル酸剤の血糖降下作用が考えられている。 |
| β遮断剤 プロプラノロール等 | 併用により低血糖が起こることがある。 スルホニルウレア剤併用時に低血糖のリスクが増加するおそれがある。 患者の状態を十分観察しながら投与する。 | β遮断作用によりアドレナリンを介した低血糖からの回復を遅らせることが考えられている。 |
| モノアミン酸化酵素阻害剤 | 併用により低血糖が起こることがある。 スルホニルウレア剤併用時に低血糖のリスクが増加するおそれがある。 患者の状態を十分観察しながら投与する。 | モノアミン酸化酵素阻害剤によるインスリン分泌促進、糖新生抑制が考えられている。 |
| アドレナリン | 併用により血糖降下作用が減弱することがある。 患者の状態を十分観察しながら投与すること。 | アドレナリンによる末梢での糖利用抑制、肝での糖新生促進、インスリン分泌抑制が考えられている。 |
| 副腎皮質ホルモン | 併用により血糖降下作用が減弱することがある。 患者の状態を十分観察しながら投与すること。 | 副腎皮質ホルモンによる肝での糖新生促進等が考えられている。 |
| 甲状腺ホルモン | 併用により血糖降下作用が減弱することがある。 患者の状態を十分観察しながら投与すること。 | 甲状腺ホルモンは糖代謝全般に作用し血糖値を変動させると考えられている。 |
| 卵胞ホルモン | 併用により血糖降下作用が減弱することがある。 患者の状態を十分観察しながら投与すること。 | 卵胞ホルモンには耐糖能を変化させ、血糖を上昇させる作用が認められている。 |
| 利尿剤 | 併用により血糖降下作用が減弱することがある。 患者の状態を十分観察しながら投与すること。 | 利尿剤によるカリウム喪失によりインスリン分泌の低下が考えられている。 |
| ピラジナミド | 併用により血糖降下作用が減弱することがある。 患者の状態を十分観察しながら投与すること。 | 機序不明。 |
| イソニアジド | 併用により血糖降下作用が減弱することがある。 患者の状態を十分観察しながら投与すること。 | イソニアジドによる炭水化物代謝阻害が考えられている。 |
| ニコチン酸 | 併用により血糖降下作用が減弱することがある。 患者の状態を十分観察しながら投与すること。 | ニコチン酸による血糖上昇作用が考えられている。 |
| フェノチアジン系薬剤 | 併用により血糖降下作用が減弱することがある。 患者の状態を十分観察しながら投与すること。 | フェノチアジン系薬剤によるインスリン分泌抑制、副腎からのアドレナリン遊離が考えられている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 乳酸アシドーシス(頻度不明)
11.1.2 低血糖(5%以上)
11.1.3 肝機能障害、黄疸(頻度不明)
AST、ALT、ALP、γ-GTP、ビリルビンの著しい上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.1.4 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがある。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 消化器注1) | 下痢(40.5%)、悪心(15.4%)、食欲不振(11.8%)、腹痛(11.5%)、嘔吐 | 消化不良、腹部膨満感、便秘、胃炎 | 胃腸障害、放屁増加 | |
| 血液 | 貧血、白血球増加、好酸球増加、白血球減少 | 血小板減少 | ||
| 過敏症 | 発疹、そう痒 | |||
| 肝臓 | 肝機能異常 | |||
| 腎臓 | BUN上昇、クレアチニン上昇 | |||
| 代謝異常 | 乳酸上昇 | CK上昇、血中カリウム上昇 | 血中尿酸増加 | ケトーシス |
| その他 | めまい・ふらつき | 全身倦怠感注1)、空腹感、眠気、動悸、脱力感、発汗、味覚異常、頭重、頭痛、浮腫、ビタミンB12減少注2) | 筋肉痛注1) |
13. 過量投与
14. 適用上の注意
14.1 薬剤調製時の注意
本剤とオルメサルタン メドキソミル製剤等との一包化は避けること。一包化して高温高湿度条件下にて保存した場合、本剤が変色することがある。
14.2 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
インスリン又は経口血糖降下剤の投与中にアンジオテンシン変換酵素阻害剤を投与することにより、低血糖が起こりやすいとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性にメトホルミン塩酸塩を空腹時に単回経口投与したときの血漿中メトホルミン濃度推移及び薬物動態パラメータは以下のとおりであった3)。
| 投与量 | Tmax(h) | Cmax(ng/mL) | AUC0-48(ng・h/mL) | T1/2(h) |
| 250mg(6例) | 1.9±1.1 | 898±168 | 4,861±577 | 2.9±0.6 |
| 500mg(6例) | 2.3±0.9 | 1,341±329 | 8,019±2,347 | 4.0±1.4 |
| 750mg(12例) | 2.1±0.7 | 2,163±517 | 11,802±2,221 | 4.7±1.7 |
16.1.2 反復投与
健康成人男性に1日3回メトホルミン塩酸塩500mgあるいは750mg(各9例)を6日間反復経口投与したとき、血漿中メトホルミン濃度は投与2〜4日後には定常状態に達し、反復投与による蓄積性はみられなかった4)。
16.1.3 生物学的同等性試験
メトホルミン塩酸塩錠500mgMT「明治」とメトグルコ錠500mgを、クロスオーバー法によりそれぞれ1錠(メトホルミン塩酸塩として500mg)健康成人男子に絶食単回経口投与して血漿中メトホルミン濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された5)。
図 500mgMT錠投与時の血漿中メトホルミン濃度推移
| 被験者数 | 判定パラメータ | 参考パラメータ | |||
| AUCt(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | ||
| メトホルミン塩酸塩錠500mgMT「明治」 | 34 | 7994±2123 | 1381±397 | 2.4±1.0 | 4.04±0.66 |
| メトグルコ錠500mg | 34 | 7806±1704 | 1304±302 | 2.6±0.9 | 4.23±0.54 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 食事の影響
健康成人男性12例にメトホルミン塩酸塩750mgを食後に単回経口投与したとき、空腹時投与に比べてCmaxが約20%低下したが、AUC0-48及び尿中排泄率に差は認められなかった3)。
健康成人男性にメトホルミン塩酸塩500mgを食直前及び食後に単回経口投与したときの薬物動態パラメータは以下のとおりであった6)。
| 投与時期 | Tmax(h) | Cmax(ng/mL) | AUC0-24(ng・h/mL) | T1/2(h) |
| 食直前(12例) | 1.5±0.6 | 1,060±237 | 6,186±1,249 | 4.5±0.8 |
| 食後(12例) | 3.4±0.6 | 1,014±162 | 6,486±823 | 4.0±0.5 |
16.2.2 生物学的利用率
健康成人3例にメトホルミン塩酸塩500mgを単回経口投与したときの生物学的利用率は60.6%であった7)(外国人データ)。
16.3 分布
16.3.1 血漿蛋白結合率
1.1〜2.8%8)(in vitro、ヒト血漿、0.1〜100μg/mL、限外ろ過法)
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能正常者(クレアチニンクリアランス:>90mL/min)、軽度(クレアチニンクリアランス:61〜90mL/min)及び中等度(クレアチニンクリアランス:31〜60mL/min)の腎機能障害者にメトホルミン塩酸塩850mgを空腹時に単回経口投与したときの薬物動態パラメータは以下のとおりであった10)(外国人データ)。[7.、9.2参照]
| Cmax(μg/mL) | AUC0-∞(μg・h/mL) | T1/2(h) | CLR(mL/min) | |
| 腎機能正常者(3例) | 1.64±0.50 | 11.22±3.19 | 11.2±5.2 | 394.7±83.8 |
| 軽度腎機能障害者(5例) | 1.86±0.52 | 13.22±2.00 | 17.3±21.2 | 383.6±122.3 |
| 中等度腎機能障害者(4例) | 4.12±1.83 | 58.30±36.58 | 16.2±7.6 | 108.3±57.2 |
16.6.2 高齢者
16.6.3 小児
小児2型糖尿病患者を対象とした長期投与試験において、メトホルミン塩酸塩を1日2〜3回に分割して、500〜2,000mg/日を投与したときの血漿中濃度173点を用いて、ポピュレーションPK解析を実施した。小児2型糖尿病患者の薬物動態パラメータを推定した結果は、下表のとおりであった12)。
| 1回投与量 | Tmax(h) | Cmax(ng/mL) | AUC0-48(ng・h/mL) | T1/2(h) |
| 250mg(36例) | 1.5±0.0 | 521±119 | 5,095±2,815 | 5.4±1.7 |
| 500mg(36例) | 1.5±0.0 | 1,042±237 | 10,191±5,629 | 5.4±1.7 |
16.7 薬物相互作用
16.7.1 シメチジン
16.7.2 ドルテグラビル
16.7.3 バンデタニブ
16.7.4 その他の薬剤
2型糖尿病患者に対し本剤とグリベンクラミドを併用した場合、グリベンクラミドのCmaxが約37%低下し、AUC0-∞が約22%減少した16)。健康成人に対し本剤とニフェジピンを併用した場合、メトホルミンのCmaxが約21%上昇し、AUC0-24が約16%増加した17)。フロセミドを併用した場合、メトホルミンのCmaxが約22%上昇し、フロセミドのCmaxが約31%低下し、AUC0-36が約12%減少した18)。プロプラノロール又はイブプロフェンを併用した場合は薬物動態パラメータに影響はなかった19)20)。いずれの薬剤も併用により薬物動態に臨床的意義のある薬物相互作用はみられなかった(外国人データ)。
16.8 その他
メトホルミン塩酸塩錠250mgMT「明治」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」(平成24年2月29日付、薬食審査発0229第10号)に基づき、メトホルミン塩酸塩錠500mgMT「明治」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた21)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 成人
成人2型糖尿病患者を対象とした二重盲検比較試験を含む各種臨床試験注)において、HbA1c値、空腹時血糖値及びグリコアルブミン値の改善が認められた。
(1)国内第II相用量反応検討試験(単独療法)
食事療法・運動療法で効果不十分な2型糖尿病患者に、1回250mg又は500mgを1日3回毎食後に14週間(投与開始1週間は1回250mgを1日2回)投与した結果、HbA1c値はそれぞれ低下した。
副作用発現頻度は、750mg/日群で47.7%(51/107例)、1,500mg/日群で69.8%(74/106例)であった。主な副作用(発現頻度10%以上)は、750mg/日群で下痢30.8%(33例)、悪心15.9%(17例)、腹痛15.0%(16例)、食欲不振11.2%(12例)、1,500mg/日群で下痢48.1%(51例)、悪心22.6%(24例)、腹痛16.0%(17例)、食欲不振15.1%(16例)であった。低血糖症の副作用は認められなかった22)。
副作用発現頻度は、750mg/日群で47.7%(51/107例)、1,500mg/日群で69.8%(74/106例)であった。主な副作用(発現頻度10%以上)は、750mg/日群で下痢30.8%(33例)、悪心15.9%(17例)、腹痛15.0%(16例)、食欲不振11.2%(12例)、1,500mg/日群で下痢48.1%(51例)、悪心22.6%(24例)、腹痛16.0%(17例)、食欲不振15.1%(16例)であった。低血糖症の副作用は認められなかった22)。
(2)国内第II相用量反応検討試験(スルホニルウレア剤併用療法)
食事療法・運動療法に加えてスルホニルウレア剤で効果不十分な2型糖尿病患者に、1回250mg又は500mgを1日3回毎食後に14週間(投与開始1週間は1回250mgを1日2回)投与した結果、HbA1c値はそれぞれ低下した。
副作用発現頻度は、750mg/日群で58.8%(60/102例)、1,500mg/日群で75.0%(78/104例)であった。主な副作用(発現頻度10%以上)は、750mg/日群で下痢26.5%(27例)、1,500mg/日群で下痢40.4%(42例)、食欲不振14.4%(15例)、悪心13.5%(14例)であった。低血糖症の副作用は、それぞれ9.8%(10例)、21.2%(22例)に発現した23)。[11.1.2参照]
副作用発現頻度は、750mg/日群で58.8%(60/102例)、1,500mg/日群で75.0%(78/104例)であった。主な副作用(発現頻度10%以上)は、750mg/日群で下痢26.5%(27例)、1,500mg/日群で下痢40.4%(42例)、食欲不振14.4%(15例)、悪心13.5%(14例)であった。低血糖症の副作用は、それぞれ9.8%(10例)、21.2%(22例)に発現した23)。[11.1.2参照]
(3)国内第II相長期投与試験
食事療法・運動療法のみ又は食事療法・運動療法に加えてスルホニルウレア剤で効果不十分な2型糖尿病患者に、1日500mgより開始し、1日750〜2,250mgを2〜3回に分割して54週間投与した結果、HbA1c値、空腹時血糖値及びグリコアルブミン値は改善し、良好な血糖コントロールが維持された。
副作用発現頻度は67.5%(114/169例)であった。主な副作用(発現頻度10%以上)は、下痢54.4%(92例)、悪心15.4%(26例)、食欲不振14.8%(25例)、腹痛10.1%(17例)であった。低血糖症の副作用は食事療法・運動療法のみの患者では発現せず、食事療法・運動療法に加えてスルホニルウレア剤で効果不十分な患者では11.6%(10/86例)に発現した24)。[11.1.2参照]
副作用発現頻度は67.5%(114/169例)であった。主な副作用(発現頻度10%以上)は、下痢54.4%(92例)、悪心15.4%(26例)、食欲不振14.8%(25例)、腹痛10.1%(17例)であった。低血糖症の副作用は食事療法・運動療法のみの患者では発現せず、食事療法・運動療法に加えてスルホニルウレア剤で効果不十分な患者では11.6%(10/86例)に発現した24)。[11.1.2参照]
17.1.2 小児
(1)国内第III相長期投与試験
小児2型糖尿病患者を対象とした長期投与試験において、HbA1c(NGSP)値、グリコアルブミン値、空腹時血糖値の改善が認められた。
1日500〜2,000mgを2〜3回に分割して24週間投与した結果は以下のとおりであった(なお、組み入れられた患者の体重は44.4〜112.0kgであった)。
1日500〜2,000mgを2〜3回に分割して24週間投与した結果は以下のとおりであった(なお、組み入れられた患者の体重は44.4〜112.0kgであった)。
(1)食事療法・運動療法で効果不十分な2型糖尿病
HbA1c(NGSP)値(平均値、以下同様)は24週間投与で0.76(14例)低下した。
(2)食事療法・運動療法に加えてスルホニルウレア剤で効果不十分な2型糖尿病
HbA1c(NGSP)値は24週間投与で0.40(4例)低下した。
(3)食事療法・運動療法に加えて1日750mg以下のメトホルミンで効果不十分な2型糖尿病
HbA1c(NGSP)値は24週間投与で0.98(17例)低下した。
副作用発現頻度は51.4%(19/37例)であった。主な副作用(発現頻度10%以上)は、下痢29.7%(11例)、悪心18.9%(7例)、腹痛10.8%(4例)であった。低血糖症の副作用は認められなかった12)。
18. 薬効薬理
18.1 作用機序
主に肝臓における糖新生を抑制し、膵β細胞のインスリン分泌を介することなく血糖降下作用を示す。また、末梢組織における糖取り込みの促進、小腸における糖吸収の抑制等も知られている25)。
18.2 血糖降下作用
肥満を呈する糖尿病モデル動物であるdb/dbマウスにおいて、血糖値の低下作用及びHbA1c値の増加抑制作用を示す26)。
19. 有効成分に関する理化学的知見
19.1. メトホルミン塩酸塩
20. 取扱い上の注意
錠剤を取り出すときに特異なにおいがすることがある。(本剤の原料に由来する成分による。)
22. 包装
<メトホルミン塩酸塩錠250mgMT「明治」>
PTP包装(乾燥剤入)
100錠(10錠×10) 1000錠(10錠×100)
バラ包装(ボトル入、乾燥剤入)
500錠
<メトホルミン塩酸塩錠500mgMT「明治」>
PTP包装(乾燥剤入)
100錠(10錠×10) 1000錠(10錠×100)
バラ包装(ボトル入、乾燥剤入)
500錠
23. 主要文献
- Dubourg J.,et al., Diabetes Obes Metab., 24 (4), 609-619, (2022) »PubMed
- Tuchmann-Duplessis H.,et al., Compt.Rend., 253, 321-323, (1961) »PubMed
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.2
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.3
- 社内資料:メトホルミン塩酸塩錠500mgMT「明治」の生物学的同等性試験に関する資料
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.8
- Pentikainen P.J.,et al., Eur.J.Clin.Pharmacol., 16, 195-202, (1979) »PubMed
- メトグルコ錠:2010年1月20日承認、CTD2.6.5.6
- メトグルコ錠:2010年1月20日承認、CTD2.7.2.2
- Sambol N.C.,et al., J.Clin.Pharmacol., 35, 1094-1102, (1995) »PubMed
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.6
- メトグルコ錠:2014年8月29日承認、審査報告書
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.10
- Song I.H.,et al., J Acquir Immune Defic Syndr., 72 (4), 400-407, (2016) »PubMed
- Johansson,S.,et al., Clin Pharmacokinet., 53, 837-847, (2014) »PubMed
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.9
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.11
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.12
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.14
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.13
- 社内資料:メトホルミン塩酸塩錠250mgMT「明治」の溶出性(生物学的同等性試験)に関する資料
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.15
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.16
- メトグルコ錠:2010年1月20日承認、CTD2.7.6.18
- Lee,A.J., Pharmacotherapy., 16, 327-351, (1996) »PubMed
- メトグルコ錠:2010年1月20日承認、CTD2.6.2.2
24. 文献請求先及び問い合わせ先
文献請求先
Meiji Seikaファルマ株式会社
くすり相談室 (Meファルマ株式会社専用ダイヤル)
〒104-8002
東京都中央区京橋2-4-16
電話:フリーダイヤル 0120-261-158
FAX:03-3272-2438
製品情報問い合わせ先
Meiji Seikaファルマ株式会社
くすり相談室 (Meファルマ株式会社専用ダイヤル)
〒104-8002
東京都中央区京橋2-4-16
電話:フリーダイヤル 0120-261-158
FAX:03-3272-2438
26. 製造販売業者等
26.1 製造販売元
Meiji Seikaファルマ株式会社
東京都中央区京橋2-4-16
26.2 販売元
Meファルマ株式会社
東京都中央区京橋2-4-16