医薬品情報
| 総称名 | ピコスルファートナトリウム |
|---|---|
| 一般名 | ピコスルファートナトリウム水和物 |
| 欧文一般名 | Sodium Picosulfate Hydrate |
| 製剤名 | ピコスルファートナトリウム水和物顆粒 |
| 薬効分類名 | 便通促進・便秘治療剤 |
| 薬効分類番号 | 2359 |
| ATCコード | A06AB08 |
| KEGG DRUG |
D01612
ピコスルファートナトリウム水和物
|
| KEGG DGROUP |
DG01770
便秘薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年11月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ピコスルファートナトリウム顆粒1%「ゼリア」 (後発品) | Sodium Picosulfate Granules 1%「ZERIA」 | 日新製薬-山形 | 2359005D1128 | 14.1円/g |
2. 禁忌
次の患者には投与しないこと
<効能共通>
2.1 急性腹症が疑われる患者[腸管蠕動運動の亢進により、症状が増悪するおそれがある。]
2.2 本剤の成分に対して過敏症の既往歴のある患者
<大腸検査(X線・内視鏡)前処置における腸管内容物の排除>
2.3 腸管に閉塞のある患者又はその疑いのある患者[腸管蠕動運動の亢進により腸管の閉塞による症状が増悪し、腸管穿孔に至るおそれがある。]
4. 効能または効果
○各種便秘症
○術後排便補助
○造影剤(硫酸バリウム)投与後の排便促進
○手術前における腸管内容物の排除
○大腸検査(X線・内視鏡)前処置における腸管内容物の排除
6. 用法及び用量
<各種便秘症の場合>
通常、成人に対して1日1回0.5〜0.75gを経口投与する。
小児に対しては1日1回、次の基準で経口投与する。
小児に対しては1日1回、次の基準で経口投与する。
| 年齢 | 6箇月以下 | 7〜12箇月 | 1〜3歳 | 4〜6歳 | 7〜15歳 |
| 用量 | 0.1g | 0.15g | 0.3g | 0.35g | 0.5g |
<術後排便補助の場合>
通常、成人に対して1日1回0.5〜0.75gを経口投与する。
<造影剤(硫酸バリウム)投与後の排便促進の場合>
通常、成人に対して0.3〜0.75gを経口投与する。
<手術前における腸管内容物の排除の場合>
通常、成人に対して0.7gを経口投与する。
<大腸検査(X線・内視鏡)前処置における腸管内容物の排除の場合>
通常、成人に対して検査予定時間の10〜15時間前に15gを経口投与する。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
<手術前における腸管内容物の排除>
8.1 必要に応じて浣腸を併用すること。
<大腸検査(X線・内視鏡)前処置における腸管内容物の排除>
8.2 腸管蠕動運動の亢進により腸管内圧の上昇を来し、虚血性大腸炎を生じることがある。また、腸管に狭窄のある患者では、腸閉塞を生じて腸管穿孔に至るおそれがあるので、投与に際しては次の点を留意すること。[11.1.1、11.1.2参照]
8.2.1 患者の日常の排便状況を確認し、本剤投与前日あるいは投与前に通常程度の排便があったことを確認してから投与すること。
8.2.2 本剤投与後に腹痛等の異常が認められた場合には、腹部の診察や画像検査(単純X線、超音波、CT等)を行い、適切な処置を行うこと。
8.3 自宅で行う際には、副作用があらわれた場合に対応が困難なことがあるので、ひとりでの服用は避けるよう指導すること。
8.4 水を十分に摂取させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
<大腸検査(X線・内視鏡)前処置における腸管内容物の排除>
9.1.1 腸管狭窄及び重度な便秘の患者
腸管蠕動運動の亢進により虚血性大腸炎又は腸閉塞を生じることがある。また、腸閉塞を生じた場合には腸管穿孔に至るおそれがある。
9.1.2 腸管憩室のある患者
腸管蠕動運動の亢進により病態が増悪するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下している。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
<大腸検査(X線・内視鏡)前処置における腸管内容物の排除>
11.1.1 腸閉塞、腸管穿孔(いずれも頻度不明)
腸管に狭窄のある患者において腸閉塞を生じ、腸管穿孔に至るおそれがあるので、観察を十分に行い、腹痛等の異常が認められた場合には適切な処置を行うこと。[8.2参照]
11.1.2 虚血性大腸炎(頻度不明)[8.2参照]
注1)副作用の頻度は承認時までの臨床試験及び使用成績調査を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 消化器 | 腹痛、悪心、嘔吐、腹鳴、腹部膨満感、下痢等 | 腹部不快感 |
| 皮膚 | 蕁麻疹、発疹等 | |
| 肝臓 | AST上昇、ALT上昇等 | |
| 精神神経系 | めまい注2)、一過性の意識消失注2) |
16. 薬物動態
16.3 分布
16.4 代謝
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
国内11研究機関において一般臨床試験を実施し、報告された臨床成績は次のとおりである5)。
17.1.1 各種便秘症
自覚症状改善率95.2%、全般改善度95.5%、総合的有用性92.5%となり各種便秘症に対し有用であることが確認された。
17.1.2 造影剤排泄促進
12例中10例は極めて有用、2例は有用との結果が得られた。
18. 薬効薬理
18.1 作用機序
18.2 生物学的同等性試験
ラット1群10匹に、ピコスルファートナトリウム顆粒1%「ゼリア」とラキソベロン内用液0.75%を、ピコスルファートナトリウム水和物としてそれぞれ1、3、4、5mg/kg経口投与した後の下痢便排泄状態を観察し、50%瀉下有効量(ED50)を算出した結果、ピコスルファートナトリウム顆粒1%「ゼリア」では3.10mg/kg、ラキソベロン内用液0.75%では3.22mg/kgであった。
また、用量-陽性率直線の平行線検定の結果、両製剤は効力比1.0で有意な平行性が認められ、両製剤の生物学的同等性が確認された10)。
また、用量-陽性率直線の平行線検定の結果、両製剤は効力比1.0で有意な平行性が認められ、両製剤の生物学的同等性が確認された10)。
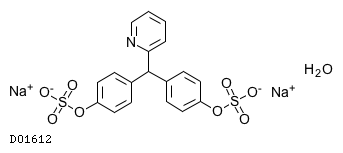
19. 有効成分に関する理化学的知見
19.1. ピコスルファートナトリウム水和物
22. 包装
0.5g×600包[分包]
500g[バラ]
23. 主要文献
- Jauch R,et al., Arzneim-Forsch., 27 (5), 1045-50, (1977) »PubMed
- 大沼規男ほか, 医薬品研究, 8 (4), 485-90, (1977)
- 大沼規男ほか, 医薬品研究, 8 (4), 474-84, (1977)
- 第十八改正日本薬局方解説書, C4263-4266, (2021), (東京:廣川書店)
- 常岡健二ほか, 薬理と治療, 16 (10), 4293-301, (1988)
- 鶴見介登ほか, 応用薬理, 14 (4), 549-55, (1977)
- Jauch R,et al., Arzneim-Forsch., 25 (11), 1796-800, (1975) »PubMed
- Pala G,et al., Arch Int Pharmacodyn., 164 (2), 356-69, (1966)
- Forth W,et al., Naunyn-Schmiedeberg’s Arch Pharmacol, 274 (1), 46-53, (1972) »PubMed
- 社内資料:生物学的同等性試験
24. 文献請求先及び問い合わせ先
文献請求先
ゼリア新薬工業株式会社
お客様相談室 受付時間 9:00〜17:50(土日祝日・弊社休業日を除く)
〒103-8351
東京都中央区日本橋小舟町10-11
電話:03-3661-0277
FAX:03-3663-2352
製品情報問い合わせ先
ゼリア新薬工業株式会社
お客様相談室 受付時間 9:00〜17:50(土日祝日・弊社休業日を除く)
〒103-8351
東京都中央区日本橋小舟町10-11
電話:03-3661-0277
FAX:03-3663-2352
26. 製造販売業者等
26.1 製造販売元
日新製薬株式会社
山形県天童市清池東二丁目3番1号
26.2 販売元
ゼリア新薬工業株式会社
東京都中央区日本橋小舟町10-11