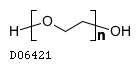医薬品情報
| 総称名 | モビコール |
|---|---|
| 一般名 | マクロゴール4000 ポリエチレングリコール4000 |
| 欧文一般名 | Macrogol 4000 |
| 薬効分類名 | 慢性便秘症治療薬 |
| 薬効分類番号 | 2359 |
| KEGG DRUG |
D11174
マクロゴール4000・塩化ナトリウム・炭酸水素ナトリウム・塩化カリウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2021年1月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| モビコール配合内用剤LD | MOVICOL Combination Powder | EAファーマ | 2359110B1037 | 61.4円/包 | 処方箋医薬品注) |
| モビコール配合内用剤HD | MOVICOL Combination Powder | EAファーマ | 2359110B2025 | 110.8円/包 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 腸閉塞、腸管穿孔、重症の炎症性腸疾患(潰瘍性大腸炎、クローン病、中毒性巨大結腸症等)が確認されている患者又はその疑いがある患者[病態を悪化させるおそれがある。]
4. 効能または効果
慢性便秘症(器質的疾患による便秘を除く)
6. 用法及び用量
本剤は、水で溶解して経口投与する。
通常、2歳以上7歳未満の幼児には初回用量としてモビコール配合内用剤LD(以後LD)1包を1日1回経口投与する。以降、症状に応じて適宜増減し、1日1〜3回経口投与、最大投与量は1日量としてLD4包又はモビコール配合内用剤HD(以後HD)2包まで(1回量としてLD2包又はHD1包まで)とする。ただし、増量は2日以上の間隔をあけて行い、増量幅は1日量としてLD1包までとする。
通常、7歳以上12歳未満の小児には初回用量としてLD2包又はHD1包を1日1回経口投与する。以降、症状に応じて適宜増減し、1日1〜3回経口投与、最大投与量は1日量としてLD4包又はHD2包まで(1回量としてLD2包又はHD1包まで)とする。ただし、増量は2日以上の間隔をあけて行い、増量幅は1日量としてLD1包までとする。
通常、成人及び12歳以上の小児には初回用量としてLD2包又はHD1包を1日1回経口投与する。以降、症状に応じて適宜増減し、1日1〜3回経口投与、最大投与量は1日量としてLD6包又はHD3包まで(1回量としてLD4包又はHD2包まで)とする。ただし、増量は2日以上の間隔をあけて行い、増量幅は1日量としてLD2包又はHD1包までとする。
<参考>
初回は1日1回。以降、適宜増減(1日1〜3回)。
| 年齢区分 | 投与量の区分 | モビコール配合内用剤 | ||
| LD | HD | |||
| 2歳以上7歳未満 | 初回用量 | 1包 | − | |
| 1日量あたりの最大増量幅※ | 1包 | − | ||
| 最大投与量 | 1回量 | 2包 | 1包 | |
| 1日量 | 4包 | 2包 | ||
| 7歳以上12歳未満 | 初回用量 | 2包 | 1包 | |
| 1日量あたりの最大増量幅※ | 1包 | − | ||
| 最大投与量 | 1回量 | 2包 | 1包 | |
| 1日量 | 4包 | 2包 | ||
| 12歳以上 (成人を含む) | 初回用量 | 2包 | 1包 | |
| 1日量あたりの最大増量幅※ | 2包 | 1包 | ||
| 最大投与量 | 1回量 | 4包 | 2包 | |
| 1日量 | 6包 | 3包 | ||
8. 重要な基本的注意
本剤投与中は腹痛や下痢があらわれるおそれがあるので、症状に応じて減量、休薬又は中止を考慮し、本剤を漫然と継続投与しないよう、定期的に本剤の投与継続の必要性を検討すること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
低出生体重児、新生児、乳児、2歳未満の幼児を対象とした臨床試験は実施していない。
9.8 高齢者
減量するなど注意すること。一般に生理機能が低下していることが多い。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
血圧低下、じん麻疹、呼吸困難、顔面浮腫等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 過敏症 | 発疹 | 紅斑 | 血管浮腫、じん麻疹、そう痒症 |
| 精神神経系 | 頭痛 | ||
| 消化器 | 下痢、腹痛、腹部膨満、悪心、腹部不快感、下腹部痛、裂肛、胃腸音異常 | 嘔吐、消化不良、鼓腸、肛門直腸不快感 | |
| その他 | 末梢性浮腫 | 高カリウム血症、低カリウム血症 |
13. 過量投与
下痢又は嘔吐による過度の体液喪失が生じた際には、水分摂取、電解質補正等の適切な処置を行うこと。
14. 適用上の注意
14.1 薬剤調製時の注意
本品6.8523g(モビコール配合内用剤LD1包)あたりコップ1/3程度(約60mL)又は本品13.7046g(モビコール配合内用剤HD1包)あたりコップ2/3程度(約120mL)の水に溶解する。溶解後は速やかに服用すること。
14.2 薬剤調製後の保存時の注意
やむを得ず保存する必要がある場合は、冷蔵庫に保存し、できるかぎり速やかに服用すること。
16. 薬物動態
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 成人国内第III相試験(検証期:プラセボ対照試験)
自発排便回数が平均3回/週未満の状態が6ヵ月以上持続している15歳以上の慢性便秘症の患者156例を対象に、プラセボ又は本剤を排便状況により1日2〜6包(1包あたり6.8523g)を2週間経口投与したとき、主要評価項目である「検証期第2週の自発排便回数の観察期間第2週からの変化量」は下表のとおりであり、本剤のプラセボに対する優越性が検証された4)。
| 投与群 | 自発排便回数(回) | 変化量 | 変化量の群間差注1)[95%信頼区間] | P値注1),注2) | |
| 観察期間第2週 | 検証期第2週 | ||||
| プラセボ群 | 1.39±0.87(76例) | 3.07±2.16(73例) | 1.64±2.00(73例) | 2.66[1.86,3.45] | P<0.0001 |
| 本剤群 | 1.60±0.94(80例) | 5.85±2.87(80例) | 4.25±2.93(80例) | ||
本剤の副作用発現率は7.5%(6/80例)であり、主な副作用は腹部膨満2.5%(2/80例)であった4)。
17.1.2 成人国内第III相試験(継続期:長期投与試験)
15歳以上の慢性便秘症の患者153例を対象に、本剤1日2〜6包(1包あたり6.8523g)を52週間経口投与したときの、52週までの7日あたりの自発排便回数の推移は下図のとおりであった4)。
<自発排便回数の推移(平均値±標準偏差)>
本剤の副作用発現率は16.3%(25/153例)であり、主な副作用は下痢及び腹痛各3.3%(5/153例)であった。
17.1.3 小児国内第III相試験
自発排便回数が平均2回/週以下の状態が2ヵ月以上持続している2歳以上14歳以下の慢性便秘症の患者39例を対象に、排便状況により2歳以上11歳以下:1日1〜4包(1包あたり6.8523g)、12歳以上14歳以下:1日2〜6包(1包あたり6.8523g)を12週間経口投与した。主要評価項目である「投与期間第2週の自発排便回数の観察期間第2週からの変化量」は下表のとおりであった5)。
| 投与群 | 自発排便回数(回) | 変化量 | |
| 観察期間第2週 | 投与期間第2週 | ||
| 本剤群 | 1.00±0.89(39例) | 6.54±4.38(39例) | 5.54±4.55 |
本剤の副作用発現率は7.7%(3/39例)であり、発現した副作用は下痢、腹痛及び食欲減退各2.6%(1/39例)であった5)。
18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
19.1. マクロゴール4000
20. 取扱い上の注意
高温を避けて保存すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
100包
23. 主要文献
- Brady CE 3rd.,et al., Gastroenterology, 90 (6), 1914-1918, (1986) »PubMed
- DiPiro JT.,et al., Clin.Pharm., 5 (2), 153-155, (1986) »PubMed
- Seidman EG.,et al., Gastroenterology, 90 (1), 120-126, (1986) »PubMed
- 社内資料(成人国内第III相試験)(2018年9月21日承認、CTD2.7.3.2.1)
- 社内資料(小児国内第III相試験)(2018年9月21日承認、CTD2.7.3.2.2)
- Schiller LR.,et al., Gastroenterology, 94 (4), 933-941, (1988) »PubMed
- Hammer HF.,et al., J.Clin.Invest., 84 (4), 1056-1062, (1989) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
EAファーマ株式会社
くすり相談室
〒104-0042
東京都中央区入船二丁目1番1号
電話:0120-917-719
製品情報問い合わせ先
EAファーマ株式会社
くすり相談室
〒104-0042
東京都中央区入船二丁目1番1号
電話:0120-917-719
26. 製造販売業者等
26.1 製造販売元
EAファーマ株式会社
東京都中央区入船二丁目1番1号
26.2 プロモーション提携
エーザイ株式会社
東京都文京区小石川4-6-10