医薬品情報
| 総称名 | コレクチム |
|---|---|
| 一般名 | デルゴシチニブ |
| 欧文一般名 | Delgocitinib |
| 製剤名 | デルゴシチニブ軟膏 |
| 薬効分類名 | 外用ヤヌスキナーゼ(JAK)阻害剤 |
| 薬効分類番号 | 2699 |
| ATCコード | D11AH11 |
| KEGG DRUG |
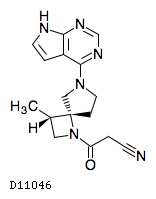
D11046
デルゴシチニブ
|
| KEGG DGROUP |
DG02020
JAK阻害薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 改訂(第7版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| コレクチム軟膏0.5% | CORECTIM Ointment | 塩野義製薬 | 2699714M1029 | 143円/g | 処方箋医薬品注) |
| コレクチム軟膏0.25% | CORECTIM Ointment | 塩野義製薬 | 2699714M2025 | 137.6円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
コレクチム軟膏0.5%
通常,成人には,0.5%製剤を1日2回,適量を患部に塗布する。なお,1回あたりの塗布量は5gまでとする。
通常,小児には,0.25%製剤を1日2回,適量を患部に塗布する。症状に応じて,0.5%製剤を1日2回塗布することができる。なお,1回あたりの塗布量は5gまでとするが,体格を考慮すること。
コレクチム軟膏0.25%
通常,小児には,0.25%製剤を1日2回,適量を患部に塗布する。症状に応じて,0.5%製剤を1日2回塗布することができる。なお,1回あたりの塗布量は5gまでとするが,体格を考慮すること。
7. 用法及び用量に関連する注意
7.1 1回あたりの塗布量は体表面積の30%までを目安とすること。
7.2 0.5%製剤で治療開始4週間以内に症状の改善が認められない場合は,使用を中止すること。
7.3 症状が改善した場合には継続投与の必要性について検討し,漫然と長期にわたって使用しないこと。
7.4 小児に0.5%製剤を使用し,症状が改善した場合は,0.25%製剤への変更を検討すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 皮膚感染症を伴う患者
皮膚感染部位を避けて使用すること。なお,やむを得ず使用する場合には,あらかじめ適切な抗菌剤,抗ウイルス剤,抗真菌剤による治療を行う,若しくはこれらとの併用を考慮すること。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し,授乳の継続又は中止を検討すること。動物実験(ラット,経口投与)で,乳汁中に移行することが報告されている3)。
9.7 小児等
低出生体重児,新生児及び6ヵ月未満の乳児を対象に,有効性及び安全性を指標とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 1%以上 | 1%未満 | |
| 感染症及び寄生虫症 | 適用部位毛包炎(2.4%),ヘルペス性状湿疹 | 口腔ヘルペス,単純ヘルペス,帯状疱疹,膿痂疹 |
| 皮膚及び皮下組織障害 | 接触皮膚炎 | |
| 一般・全身障害及び投与部位の状態 | 適用部位ざ瘡(2.0%),適用部位刺激感,適用部位紅斑 | 適用部位そう痒感 |
14. 適用上の注意
14.1 薬剤投与時の注意
14.1.1 粘膜,潰瘍,明らかに局面を形成しているびらん等への塗布は避けること。
14.1.2 万一,眼に入った場合は,直ちに水で洗い流すこと。
15. その他の注意
15.2 非臨床試験に基づく情報
ラットを用いた2年間経口投与がん原性試験において,胸腺腫(10mg/kg/日以上)及び皮下の脂肪腫(3mg/kg/日以上)が認められた。ラットに3及び10mg/kg/日を反復経口投与したときのデルゴシチニブの曝露量(AUC)は,最大臨床用量における曝露量の84倍及び309倍であった4)。
16. 薬物動態
16.1 血中濃度
16.1.1 16歳以上のアトピー性皮膚炎患者
16歳以上のアトピー性皮膚炎患者に本剤0.5%を1回最大5g,1日2回反復塗布し,デルゴシチニブの血漿中濃度を測定した(定量下限:1.0ng/mL)。デルゴシチニブの血漿中濃度が検出された患者割合は,塗布4週時では11.9%(59/494例),塗布12週時では15.8%(65/411例),塗布28週時では14.2%(54/380例),塗布52週時では11.5%(30/262例)であった。最大値は,塗布4週時では10.8ng/mL,塗布12週時では13.1ng/mL,塗布28週時では13.3ng/mL,塗布52週時では7.3ng/mLであった5)。
16.1.2 2歳以上16歳未満のアトピー性皮膚炎患者
2歳以上16歳未満のアトピー性皮膚炎患者に本剤を1回最大5g,1日2回反復塗布し,デルゴシチニブの血漿中濃度を測定した(定量下限:1.0ng/mL)。本剤0.25%を塗布した場合,デルゴシチニブの血漿中濃度が検出された患者割合は,塗布2週時では4.9%(3/61例),塗布4週時では5.0%(3/60例)であった。最大値は,塗布2週時では4.7ng/mL,塗布4週時では1.6ng/mLであった。また,本剤0.25%又は0.5%の長期塗布期間中,デルゴシチニブの血漿中濃度が検出された患者割合は,塗布12週時では16.4%(11/67例),塗布28週時では4.9%(3/61例),塗布56週時では8.8%(5/57例)であった。最大値は,塗布52週時の11.8ng/mLであった6)。
16.1.3 6ヵ月以上2歳未満のアトピー性皮膚炎患者
6ヵ月以上2歳未満のアトピー性皮膚炎患者に本剤を1回最大2.5g,1日2回反復塗布し,デルゴシチニブの血漿中濃度を測定した(定量下限:1.0ng/mL)。デルゴシチニブの血漿中濃度が検出された患者割合は,塗布4週時では31.8%(7/22例),塗布28週時では22.7%(5/22例),塗布52週時では4.8%(1/21例)であった。最大値は,塗布4週時では2.1ng/mL,塗布28週時では7.3ng/mL,塗布52週時では1.8ng/mLであった7)。
16.3 分布
デルゴシチニブのヒト血漿中蛋白結合率は21.8〜29.1%であった(in vitro)1)。
16.4 代謝
デルゴシチニブは,ヒト皮膚ミクロソーム及びヒト肝細胞では代謝されなかった。デルゴシチニブは,ヒト肝ミクロソームにおいてわずかに代謝され,主にCYP3A4が寄与する(in vitro)8)。
16.5 排泄
ラットに14C標識したデルゴシチニブを静脈内投与したとき,投与168時間後までに投与放射能の65.4%が尿中に排泄され,30.9%が糞中に排泄された。また,イヌに14C標識したデルゴシチニブを静脈内投与したとき,投与168時間後までに投与放射能の68.6%が尿中に排泄され,27.5%が糞中に排泄された3)。
16.7 薬物相互作用
デルゴシチニブは,P-gp,OAT3及びOCT2の基質である(in vitro)9)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 第III相比較試験及び継続長期試験(QBA4-1試験)10)
中等症〜重症注1)の16歳以上のアトピー性皮膚炎患者158例を対象に,本剤0.5%又はプラセボを1日2回,1回最大5gを4週間反復塗布した。その後,継続可能な症例では本剤0.5%を1日2回,1回最大5gを24週間反復塗布した注2)。
主要評価項目である塗布4週時(最終評価時)のmodified Eczema Area and Severity Index(mEASI)スコア注3)変化率は,表17-1のとおりであった。
主要評価項目である塗布4週時(最終評価時)のmodified Eczema Area and Severity Index(mEASI)スコア注3)変化率は,表17-1のとおりであった。
注1)mEASIスコア10以上,Investigator's Global Assessment(IGA)スコア3(中等症)又は4(重症),炎症を伴う皮疹の%BSA(全身の総面積に対する炎症を伴う皮疹面積の割合)10%以上30%未満
注2)経口ステロイド製剤,タクロリムス水和物軟膏,経口シクロスポリン製剤,ヒト型抗ヒトIL-4/13受容体モノクローナル抗体製剤,光線療法は併用禁止とした(4週以降,ステロイド外用剤は,必要な場合に限り使用可能とした)。密封法及び重層法は用いられていなかった。
注3)EASIスコアから頭頸部のスコアを除いたもの
| mEASIスコア | mEASIスコア変化率 [95%信頼区間] | 群間差 [95%信頼区間] p値a) | ||
| 塗布開始時 | 塗布4週時 | |||
| 本剤群(106例) | 14.2±3.5 | 8.1±6.5 | −44.3% [−51.8%,−36.8%] | −46.0% [−59.1%,−32.9%] <0.0001 |
| プラセボ群(52例) | 14.5±3.8 | 15.3±7.8 | 1.7% [−9.0%,12.5%] | |
本剤0.5%を使用した患者における副作用発現頻度は,5.8%(9/154例)であった。主な副作用は,カポジ水痘様発疹1.9%(3/154例)であった。
17.1.2 第III相長期試験(QBA4-2試験)11)
軽症〜重症注1)の16歳以上のアトピー性皮膚炎患者352例を対象に,本剤0.5%を1日2回,1回最大5gを52週間反復塗布した注2)。
mEASIスコア(平均値±標準偏差)は,塗布開始時8.8±4.9,塗布4週時6.3±5.1,塗布28週時5.9±5.9,塗布52週時5.8±6.5であった。
副作用発現頻度は,19.6%(69/352例)であった。主な副作用は,適用部位毛包炎3.1%(11/352例),適用部位ざ瘡2.8%(10/352例),適用部位刺激感2.6%(9/352例),適用部位紅斑2.0%(7/352例)であった。
mEASIスコア(平均値±標準偏差)は,塗布開始時8.8±4.9,塗布4週時6.3±5.1,塗布28週時5.9±5.9,塗布52週時5.8±6.5であった。
副作用発現頻度は,19.6%(69/352例)であった。主な副作用は,適用部位毛包炎3.1%(11/352例),適用部位ざ瘡2.8%(10/352例),適用部位刺激感2.6%(9/352例),適用部位紅斑2.0%(7/352例)であった。
注1)IGAスコア2(軽症)以上4(重症)以下,炎症を伴う皮疹の%BSA 5%以上30%未満
注2)経口ステロイド製剤,タクロリムス水和物軟膏,経口シクロスポリン製剤,ヒト型抗ヒトIL-4/13受容体モノクローナル抗体製剤,光線療法は併用禁止とした。ステロイド外用剤は,必要な場合に限り使用可能とした。密封法及び重層法は用いられていなかった。
17.1.3 第III相比較試験及び継続長期試験(QBB4-1試験)6)
軽症〜重症注1)の2歳以上16歳未満のアトピー性皮膚炎患者137例を対象に,本剤0.25%又はプラセボを1日2回,1回最大5gを4週間反復塗布した。主要評価項目である塗布4週時(最終評価時)のmEASIスコア変化率は,表17-2のとおりであった。その後,継続可能な症例では本剤0.25%又は0.5%を1日2回,1回最大5gを52週間反復塗布した注2)注3)。本剤0.5%を一度でも使用した被験者は,本剤開始群(比較試験で本剤0.25%を塗布した群)で76.1%,プラセボ開始群(比較試験でプラセボを塗布した群)で85.1%であった。本剤開始群では本剤0.25%又は0.5%の長期塗布期間中,mEASIスコアの改善効果は持続した。加えて,プラセボ開始群では本剤0.25%開始例及び0.5%開始例ともに,本剤の塗布開始後にmEASIスコアの改善が認められ,長期塗布期間中もその効果が持続した。
注1)mEASIスコア5以上,IGAスコア2(軽症)以上4(重症)以下,炎症を伴う皮疹の%BSA 5%以上30%未満
注2)経口ステロイド製剤,タクロリムス水和物軟膏,経口シクロスポリン製剤,ヒト型抗ヒトIL-4/13受容体モノクローナル抗体製剤,光線療法は併用禁止とした(4週以降,ステロイド外用剤及びタクロリムス水和物軟膏は,必要な場合に限り使用可能とした)。密封法及び重層法は用いられていなかった。
注3)本剤0.25%で継続塗布を開始した。ただし,mEASIスコアが10以上の場合は本剤0.5%で継続塗布を開始した。本剤0.25%の使用時に,IGAスコアが2(軽症)以上かつ本剤0.25%の効果が不十分と治験担当医師が判断した場合,本剤0.5%への変更を可能とした。本剤0.5%の使用時に,症状及び安全性等を考慮の上,治験担当医師の判断で本剤0.25%への変更を可能とした。
| mEASIスコア | mEASIスコア変化率 [95%信頼区間] | 群間差 [95%信頼区間] p値b) | ||
| 塗布開始時 | 塗布4週時 | |||
| 本剤群(69例) | 10.7±4.3 | 5.9±5.3 | −39.3% [−139.5%,60.8%] | −50.2% [−68.3%,−32.2%] <0.0001 |
| プラセボ群(68例) | 10.6±4.2 | 10.7±6.4 | 10.9% [−86.9%,108.7%] | |
本剤0.25%又は0.5%を使用した患者における副作用発現頻度は,9.6%(13/136例)であった。主な副作用は,適用部位毛包炎2.9%(4/136例)であった。
17.1.4 第III相長期試験(QBB4-2試験)7)
軽症〜重症注1)の6ヵ月以上2歳未満のアトピー性皮膚炎患者22例を対象に,本剤0.25%又は0.5%を1日2回,1回最大2.5gを52週間反復塗布した注2)注3)。
mEASIスコア(平均値±標準偏差)は,塗布開始時10.1±5.4,塗布4週時2.6±3.0,塗布28週時1.7±2.3,塗布52週時1.7±2.0であった。
副作用は認められなかった。
mEASIスコア(平均値±標準偏差)は,塗布開始時10.1±5.4,塗布4週時2.6±3.0,塗布28週時1.7±2.3,塗布52週時1.7±2.0であった。
副作用は認められなかった。
注1)mEASIスコア5以上,IGAスコア2(軽症)以上4(重症)以下,炎症を伴う皮疹の%BSA 5%以上30%未満
注2)経口ステロイド製剤,タクロリムス水和物軟膏,経口シクロスポリン製剤,ヒト型抗ヒトIL-4/13受容体モノクローナル抗体製剤,光線療法は併用禁止とした(ステロイド外用剤は,必要な場合に限り使用可能とした)。密封法及び重層法は用いられていなかった。
注3)本剤0.25%で塗布を開始した。ただし,mEASIスコアが10以上の場合は本剤0.5%で塗布を開始した。本剤0.25%の使用時に,IGAスコアが2(軽症)以上かつ本剤0.25%の効果が不十分と治験担当医師が判断した場合,本剤0.5%への変更を可能とした。本剤0.5%の使用時に,症状及び安全性等を考慮の上,治験担当医師の判断で本剤0.25%への変更を可能とした。
18. 薬効薬理
18.1 作用機序
デルゴシチニブは,ヤヌスキナーゼファミリー(JAK1,JAK2,JAK3及びTyk2)のすべてのキナーゼ活性を阻害することにより,種々のサイトカインシグナル伝達を阻害する。本作用機序に基づき,サイトカインにより誘発される免疫細胞及び炎症細胞の活性化を抑制して皮膚の炎症を抑制する。また,サイトカインにより誘発される掻破行動(そう痒)を抑制する12)。
18.2 JAKに対する作用
JAKファミリーのキナーゼ活性を,アデノシン三リン酸と競合して阻害した。
18.3 サイトカインシグナル伝達に対する作用(in vitro)
ヒト細胞において,サイトカインにより誘発されるSTATリン酸化を阻害した。
18.4 免疫細胞及び炎症細胞に対する作用(in vitro)
サイトカインにより誘発されるヒトT細胞及びB細胞の増殖を抑制した。また,サイトカインにより誘発されるヒトマスト細胞及び単球の炎症性サイトカインの産生を抑制した。
18.5 ラット皮膚炎モデルにおける作用(in vivo)
アトピー性皮膚炎モデルラットにおいて,皮膚の炎症を抑制した。
18.6 マウス掻破行動に対する作用(in vivo)
マウスにおいて,IL-31により誘発される掻破行動を抑制した。
19. 有効成分に関する理化学的知見
19.1. デルゴシチニブ
21. 承認条件
医薬品リスク管理計画を策定の上,適切に実施すること。
22. 包装
<コレクチム軟膏0.5%>
5g[10本]
10g[10本]
<コレクチム軟膏0.25%>
5g[10本]
23. 主要文献
- 社内資料:薬物動態試験(2020年1月23日承認,CTD 2.6.4.4)
- 社内資料:生殖発生毒性試験(2020年1月23日承認,CTD 2.6.6.6)
- 社内資料:薬物動態試験(2020年1月23日承認,CTD 2.6.4.6)
- 社内資料:がん原性試験(2020年1月23日承認,CTD 2.6.6.5)
- 社内資料:第II相及び第III相臨床試験併合解析(2020年1月23日承認,CTD 2.7.2.3)
- 社内資料:第III相比較及び継続長期臨床試験(QBB4-1試験)(2021年3月23日承認,CTD 2.7.6.3)
- 社内資料:第III相長期臨床試験(QBB4-2試験)
- 社内資料:薬物動態試験(2020年1月23日承認,CTD 2.6.4.5)
- 社内資料:薬物動態試験(2020年1月23日承認,CTD 2.6.4.7)
- 社内資料:第III相比較及び継続長期臨床試験(QBA4-1試験)(2020年1月23日承認,CTD 2.7.6.6)
- 社内資料:第III相長期臨床試験(QBA4-2試験)(2020年1月23日承認,CTD 2.7.6.7)
- 社内資料:薬効薬理試験(2020年1月23日承認,CTD 2.4.2.1)
24. 文献請求先及び問い合わせ先
文献請求先
鳥居薬品株式会社
お客様相談室
〒103-8439
東京都中央区日本橋本町3-4-1
電話:0120-316-834
FAX:03-3231-6890
製品情報問い合わせ先
鳥居薬品株式会社
お客様相談室
〒103-8439
東京都中央区日本橋本町3-4-1
電話:0120-316-834
FAX:03-3231-6890
26. 製造販売業者等
26.1 製造販売元
塩野義製薬株式会社
大阪市中央区道修町3丁目1番8号
26.2 販売元
鳥居薬品株式会社
東京都中央区日本橋本町3-4-1