医薬品情報
| 総称名 | アジルバ |
|---|---|
| 一般名 | アジルサルタン |
| 欧文一般名 | Azilsartan |
| 製剤名 | アジルサルタン錠・アジルサルタン顆粒 |
| 薬効分類名 | 持続性AT1レセプターブロッカー |
| 薬効分類番号 | 2149 |
| KEGG DRUG |
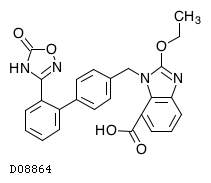
D08864
アジルサルタン
|
| KEGG DGROUP |
DG01495
アンジオテンシンII受容体拮抗薬
DG03231
血圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 改訂(第6版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アジルバ錠10mg | AZILVA Tablets 10mg | 武田薬品工業 | 2149048F3025 | 50.1円/錠 | 処方箋医薬品注) |
| アジルバ錠20mg | AZILVA Tablets 20mg | 武田薬品工業 | 2149048F1022 | 76.3円/錠 | 処方箋医薬品注) |
| アジルバ錠40mg | AZILVA Tablets 40mg | 武田薬品工業 | 2149048F2029 | 112円/錠 | 処方箋医薬品注) |
| アジルバ顆粒1% | AZILVA Granules 1% | 武田薬品工業 | 2149048D1021 | 73.3円/g | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
6. 用法及び用量
アジルバ錠10mg
<製剤共通>
<成人>
通常、成人にはアジルサルタンとして20mgを1日1回経口投与する。なお、年齢、症状により適宜増減するが、1日最大投与量は40mgとする。
<小児>
通常、6歳以上の小児には、アジルサルタンとして体重50kg未満の場合は2.5mg、体重50kg以上の場合は5mgの1日1回経口投与から開始する。なお、年齢、体重、症状により適宜増減するが、1日最大投与量は体重50kg未満の場合は20mg、体重50kg以上の場合は40mgとする。
<アジルバ錠10mg>
<小児>
通常、2歳以上6歳未満の小児には、アジルサルタンとして0.1mg/kg(最大2.5mg)の1日1回経口投与から開始する。なお、年齢、体重、症状により適宜増減するが、1日最大投与量は0.8mg/kg(最大20mg)とする。
アジルバ錠20mg
<製剤共通>
<成人>
通常、成人にはアジルサルタンとして20mgを1日1回経口投与する。なお、年齢、症状により適宜増減するが、1日最大投与量は40mgとする。
<小児>
通常、6歳以上の小児には、アジルサルタンとして体重50kg未満の場合は2.5mg、体重50kg以上の場合は5mgの1日1回経口投与から開始する。なお、年齢、体重、症状により適宜増減するが、1日最大投与量は体重50kg未満の場合は20mg、体重50kg以上の場合は40mgとする。
<アジルバ錠20mg>
<小児>
通常、2歳以上6歳未満の小児には、アジルサルタンとして0.1mg/kg(最大2.5mg)の1日1回経口投与から開始する。なお、年齢、体重、症状により適宜増減するが、1日最大投与量は0.8mg/kg(最大20mg)とする。
アジルバ錠40mg
<製剤共通>
<成人>
通常、成人にはアジルサルタンとして20mgを1日1回経口投与する。なお、年齢、症状により適宜増減するが、1日最大投与量は40mgとする。
<小児>
通常、6歳以上の小児には、アジルサルタンとして体重50kg未満の場合は2.5mg、体重50kg以上の場合は5mgの1日1回経口投与から開始する。なお、年齢、体重、症状により適宜増減するが、1日最大投与量は体重50kg未満の場合は20mg、体重50kg以上の場合は40mgとする。
アジルバ顆粒1%
<製剤共通>
<成人>
通常、成人にはアジルサルタンとして20mgを1日1回経口投与する。なお、年齢、症状により適宜増減するが、1日最大投与量は40mgとする。
<小児>
通常、6歳以上の小児には、アジルサルタンとして体重50kg未満の場合は2.5mg、体重50kg以上の場合は5mgの1日1回経口投与から開始する。なお、年齢、体重、症状により適宜増減するが、1日最大投与量は体重50kg未満の場合は20mg、体重50kg以上の場合は40mgとする。
<アジルバ顆粒1%>
<小児>
通常、2歳以上6歳未満の小児には、アジルサルタンとして0.1mg/kg(最大2.5mg)の1日1回経口投与から開始する。なお、年齢、体重、症状により適宜増減するが、1日最大投与量は0.8mg/kg(最大20mg)とする。
7. 用法及び用量に関連する注意
成人では、本剤の降圧効果を考慮し、本剤適用の可否を慎重に判断するとともに、20mgより低用量からの開始も考慮すること。[17.1.1参照]
8. 重要な基本的注意
8.1 降圧作用に基づくめまい、ふらつきがあらわれることがあるので、高所作業、自動車の運転等危険を伴う機械を操作する際には注意させること。
8.2 手術前24時間は投与しないことが望ましい。アンジオテンシンII受容体拮抗剤投与中の患者は、麻酔及び手術中にレニン−アンジオテンシン系の抑制作用による高度な血圧低下を起こす可能性がある。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 両側性腎動脈狭窄のある患者又は片腎で腎動脈狭窄のある患者
治療上やむを得ないと判断される場合を除き、使用は避けること。腎血流量の減少や糸球体ろ過圧の低下により急速に腎機能を悪化させるおそれがある。
9.1.2 高カリウム血症の患者
治療上やむを得ないと判断される場合を除き、使用は避けること。高カリウム血症を増悪させるおそれがある。
また、腎機能障害、コントロール不良の糖尿病等により血清カリウム値が高くなりやすい患者では、血清カリウム値に注意すること。
また、腎機能障害、コントロール不良の糖尿病等により血清カリウム値が高くなりやすい患者では、血清カリウム値に注意すること。
9.1.3 脳血管障害のある患者
過度の降圧が脳血流不全を引き起こし、病態を悪化させるおそれがある。
9.1.4 厳重な減塩療法中の患者
低用量から投与を開始するなど、慎重に投与すること。急激な血圧の低下を起こすおそれがある。[11.1.2参照]
9.1.5 薬剤過敏症の既往歴のある患者
9.2 腎機能障害患者
9.2.1 重篤な腎機能障害(eGFR 15mL/min/1.73m2未満)のある患者
9.2.2 血液透析中の患者
低用量から投与を開始するなど、慎重に投与すること。急激な血圧の低下を起こすおそれがある。[11.1.2参照]
9.3 肝機能障害患者
中等度の肝機能障害患者(Child-Pugh分類スコア:7〜9)で血中濃度の上昇が報告されている。臨床試験では、高度な肝機能障害患者(Child-Pugh分類スコア:10以上)は除外されていた。[16.6.2参照]
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性
妊娠していることが把握されずアンジオテンシン変換酵素阻害剤又はアンジオテンシンII受容体拮抗剤を使用し、胎児・新生児への影響(腎不全、頭蓋・肺・腎の形成不全、死亡等)が認められた例が報告されている1)2)。
本剤の投与に先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、投与が必要な場合には次の注意事項に留意すること。[9.5参照]
本剤の投与に先立ち、代替薬の有無等も考慮して本剤投与の必要性を慎重に検討し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。また、投与が必要な場合には次の注意事項に留意すること。[9.5参照]
(1)本剤投与開始前に妊娠していないことを確認すること。本剤投与中も、妊娠していないことを定期的に確認すること。投与中に妊娠が判明した場合には、直ちに投与を中止すること。
(2)次の事項について、本剤投与開始時に患者に説明すること。また、投与中も必要に応じ説明すること。
・妊娠中に本剤を使用した場合、胎児・新生児に影響を及ぼすリスクがあること。
・妊娠が判明した又は疑われる場合は、速やかに担当医に相談すること。
・妊娠を計画する場合は、担当医に相談すること。
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。ラットの周産期及び授乳期に本剤を強制経口投与すると、0.3mg/kg/日以上の群で出生児に腎盂拡張が認められ、10mg/kg/日以上で体重増加の抑制が認められている。
9.7 小児等
9.7.1 低出生体重児、新生児、乳児、2歳未満の幼児又は体重8.8kg未満の小児を対象とした臨床試験は実施していない。
9.7.2 eGFRが30mL/min/1.73m2未満もしくは透析を受けている小児等を対象とした臨床試験は実施していない。[9.7.3参照]
9.8 高齢者
低用量から投与を開始するなど慎重に投与すること。一般に過度の降圧は好ましくないとされている。脳梗塞等が起こるおそれがある。
10. 相互作用
10.1 併用禁忌
| アリスキレンフマル酸塩 ラジレス (糖尿病患者に使用する場合。ただし、他の降圧治療を行ってもなお血圧のコントロールが著しく不良の患者を除く。) [2.3参照] | 非致死性脳卒中、腎機能障害、高カリウム血症及び低血圧のリスク増加が報告されている。 | レニン−アンジオテンシン系阻害作用が増強される可能性がある。 |
10.2 併用注意
| カリウム保持性利尿剤 スピロノラクトン、 トリアムテレン、 エプレレノン等 カリウム補給剤 塩化カリウム等 [9.7.3参照] | 血清カリウム値が上昇することがある。 | 本剤のアルドステロン分泌抑制作用によりカリウム貯留作用が増強することによる。 危険因子:特に腎機能障害のある患者 |
| 利尿降圧剤 フロセミド、 トリクロルメチアジド等 [11.1.2参照] | 本剤を初めて投与する場合、降圧作用が増強するおそれがある。本剤の投与を低用量から開始するなど、注意すること。 | 利尿降圧剤で治療を受けている患者にはレニン活性が亢進している患者が多く、本剤が奏効しやすい。 |
| アリスキレンフマル酸塩 | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。eGFRが60mL/min/1.73m2未満の腎機能障害のある患者へのアリスキレンフマル酸塩との併用については、治療上やむを得ないと判断される場合を除き避けること。 | レニン−アンジオテンシン系阻害作用が増強される可能性がある。 |
| アンジオテンシン変換酵素阻害剤 | 腎機能障害、高カリウム血症及び低血圧を起こすおそれがある。 | レニン−アンジオテンシン系阻害作用が増強される可能性がある。 |
| リチウム | リチウム中毒が起こるおそれがある。 | 腎尿細管におけるリチウムの再吸収が促進される。 |
| 非ステロイド性消炎鎮痛剤(NSAIDs) インドメタシン等 | 降圧作用が減弱することがある。 | 非ステロイド性消炎鎮痛剤は血管拡張作用を有するプロスタグランジンの合成を阻害することから、降圧作用を減弱させる可能性がある。 |
| 非ステロイド性消炎鎮痛剤(NSAIDs) インドメタシン等 | 腎機能障害のある患者では、さらに腎機能が悪化するおそれがある。 | 非ステロイド性消炎鎮痛剤のプロスタグランジン合成阻害作用により、腎血流量が低下するためと考えられている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 血管性浮腫(頻度不明)
顔面、口唇、舌、咽・喉頭等の腫脹を症状とする血管性浮腫があらわれることがある。また、腹痛、嘔気、嘔吐、下痢等を伴う腸管血管性浮腫があらわれることがある。
11.1.2 ショック、失神、意識消失(頻度不明)
11.1.3 急性腎障害(頻度不明)
11.1.4 高カリウム血症(頻度不明)
11.1.5 肝機能障害(頻度不明)
AST、ALT、γ-GTPの上昇等を伴う肝機能障害があらわれることがある。
11.1.6 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等があらわれた場合には、投与を中止し、適切な処置を行うこと。横紋筋融解症による急性腎障害の発症に注意すること。
11.2 その他の副作用
| 0.1〜5%未満 | 頻度不明 | |
| 過敏症 | 発疹、湿疹、そう痒 | |
| 循環器 | めまい | |
| 精神神経系 | 頭痛 | |
| 代謝異常 | 血中カリウム上昇、血中尿酸上昇 | |
| 消化器 | 下痢 | |
| 肝臓 | ALT、ASTの上昇 | |
| 腎臓 | BUN、クレアチニンの上昇 | |
| その他 | 血中CK上昇 | 咳嗽 |
13. 過量投与
13.1 処置
アジルサルタン及び代謝物M-IIは、透析により除去されない。
14. 適用上の注意
14.1 薬剤交付時の注意
<錠>
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
臓器が未成熟な時期の幼若ラットにアジルサルタンメドキソミル注1)及び/又はアジルサルタンの代謝物M-IIを投与した毒性試験において、生後7日から生後97日まで1日1回経口投与した結果、水腎症(腎盂の拡張、好塩基性尿細管、間質の線維化、リンパ球浸潤)、小葉間動脈の中膜肥厚、傍糸球体細胞の肥大及び心臓の壁内冠状動脈の中膜肥厚が認められ、また、生後14日から生後27日まで1日1回経口投与した結果、腎臓の乳頭浮腫が認められた3)。
注1)アジルサルタンのプロドラッグ体(国内未承認)
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
<成人>
健康成人にアジルサルタン20mg(9例)及び40mg(9例)を単回経口投与した時、未変化体の血漿中濃度推移及び薬物動態学的パラメータは以下のとおりであった4)。
| 投与量 | Cmax(ng/mL) | Tmax(h) | AUC0-inf(ng・h/mL) | T1/2(h) |
| 20mg | 2,020.1±496.1 | 1.8±0.6 | 15,475.8±4,413.8 | 13.2±1.4 |
| 40mg | 4,707.8±1,048.3 | 2.4±0.5 | 33,892.0±8,109.3 | 12.8±1.3 |
<小児>
6歳以上16歳未満の高血圧症患者に、アジルサルタンを体重50kg未満の患者では5mg(3例)、体重50kg以上の患者では10mg(3例)を単回経口投与した時、未変化体の血漿中濃度推移及び薬物動態学的パラメータは以下のとおりであった5)。
| 投与量 | Cmax(ng/mL) | Tmax(h) | AUC0-inf(ng・h/mL) | T1/2(h) |
| 5mg | 888.3±291.1 | 2.7±0.5 | 6,635.7±3,279.6 | 4.7±1.0 |
| 10mg | 831.3±180.8 | 3.4±1.1 | 7,433.3±1,227.5 | 6.1±0.7 |
16.1.2 反復投与
<成人>
健康成人にアジルサルタン20mg(12例)及び40mg(12例)を1日1回7日間経口投与した時、未変化体の血漿中濃度は投与開始から4日後までに定常状態に達し、蓄積性はなかった6)。
<小児>
健康成人(52例)及び2歳以上16歳未満の高血圧症患者(42例)から得られた血漿中アジルサルタン濃度データ(992点)を用いて母集団薬物動態解析を行った。2歳以上6歳未満の高血圧症患者にアジルサルタン0.1〜0.8mg/kg、6歳以上16歳未満の高血圧症患者に、アジルサルタンを体重50kg未満の患者では2.5〜20mg、体重50kg以上の患者では5〜40mgを1日1回反復経口投与した時の母集団薬物動態解析の結果に基づき推定した薬物動態学的パラメータは、以下のとおりであった7)。
| 投与量 | n | Cmax,ss(ng/mL) | AUCτ,ss(ng・h/mL) |
| 0.1mg/kg | 9 | 461±139 | 3,011±1,044 |
| 0.2mg/kg | 6 | 986±169 | 6,158±2,071 |
| 0.4mg/kg | 5 | 1,909±338 | 11,112±3,245 |
| 0.8mg/kg | 2 | 4,494.2,3,929.9注1) | 20,250,20,280注1) |
| 体重50kg未満 | 体重50kg以上 | ||||||
| 投与量 | n | Cmax,ss(ng/mL) | AUCτ,ss(ng・h/mL) | 投与量 | n | Cmax,ss(ng/mL) | AUCτ,ss(ng・h/mL) |
| 2.5mg | 22 | 348±120 | 2,749±983 | 5mg | 5 | 434±151 | 2,976±560 |
| 5mg | 14 | 723±295 | 5,668±2,252 | 10mg | 4 | 831±337 | 5,555±787 |
| 10mg | 5 | 1,384±553 | 12,156±3,708 | 20mg | 3 | 1,723±812 | 11,857±590 |
| 20mg | 2 | 1,274.8,2,562.0注1) | 20,420,21,110注1) | 40mg | 1 | 4,480注1) | 25,050注1) |
16.2 吸収
<錠>
健康成人(12例)にアジルサルタン40mgを食後経口投与した時、未変化体のCmax、AUCは絶食下投与した時と比較して、それぞれ3.0%、8.4%減少した8)。
<顆粒>
健康成人(11例)にアジルサルタン10mgを食後経口投与した時、未変化体のCmax、AUCは絶食下投与した時と比較して、それぞれ6.3%、0.3%減少した9)。
16.3 分布
[14C]アジルサルタンを0.3、3、30μg/mL濃度でヒト血漿に添加した時、いずれも蛋白結合率は99.5%であった(in vitro)10)。
16.4 代謝
アジルサルタンは脱炭酸により代謝物M-Iに、また、CYP2C9により代謝物M-IIに代謝される。なお、M-I及びM-IIのAT1受容体の阻害作用は未変化体の約1/1,000であった(in vitro)11)12)。
アジルサルタンはCYP1A2、CYP2B6、CYP2C8、CYP2C9、CYP2C19、CYP2D6、CYP2E1及びCYP3A4を阻害せず、CYP3Aを誘導しなかった(in vitro)11)。
16.5 排泄
健康成人にアジルサルタン20mg(12例)及び40mg(12例)を1日1回7日間反復経口投与した時、初回投与から168時間までの未変化体の累積尿中排泄率はそれぞれ15.1%、14.6%であった6)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
成人の腎機能の程度が異なる高血圧症患者(eGFR注1)が15〜30未満の重度腎機能障害者4例、30〜60未満の中等度腎機能障害者10例、60以上の正常〜軽度腎機能障害者8例)にアジルサルタン20mgを1日1回7日間反復経口投与した時、成人の正常〜軽度腎機能障害者と比較して中等度腎機能障害者のCmax、AUCはそれぞれ17.3%、16.7%増加し、重度腎機能障害者のCmax、AUCはそれぞれ8.9%、39.3%増加した13)。
また、成人の腎機能障害を伴う高血圧症患者を対象とした試験において、中等度腎機能障害者(22例)と比較して重度腎機能障害者(19例)のトラフ時血漿中薬物濃度は35.1〜61.3%増加し、重篤な腎機能障害者(eGFR注1)が15未満)(4例)のトラフ時血漿中薬物濃度は51.0〜91.9%増加した14)。[9.2.1参照]
また、成人の腎機能障害を伴う高血圧症患者を対象とした試験において、中等度腎機能障害者(22例)と比較して重度腎機能障害者(19例)のトラフ時血漿中薬物濃度は35.1〜61.3%増加し、重篤な腎機能障害者(eGFR注1)が15未満)(4例)のトラフ時血漿中薬物濃度は51.0〜91.9%増加した14)。[9.2.1参照]
注1)
男性のeGFR(mL/min/1.73m2)=194×Cr−1.094×Age−0.287
女性のeGFR(mL/min/1.73m2)=194×Cr−1.094×Age−0.287×0.739
16.6.2 肝機能障害患者
成人の軽度〜中等度肝機能障害者(Child-Pugh注2)スコアが5〜6の軽度肝機能障害者8例、7〜9の中等度肝機能障害者8例、計16例)及び健康成人(16例)にアジルサルタンメドキソミル注3)として40mgを5日間反復経口投与した時、健康成人と比較して軽度肝機能障害者のCmaxは7.7%減少、AUCは27.9%増加、中等度肝機能障害者のCmax、AUCはそれぞれ17.9%、64.4%増加した15)(外国人データ)。[9.3参照]
注2)ビリルビン、アルブミン、PT又はINR、肝性脳症、腹水症の状態からスコア化する分類
注3)アジルサルタンのプロドラッグ体(国内未承認)
16.6.3 高齢者
健康な高齢者(65歳以上85歳以下、24例)及び非高齢者(18歳以上45歳以下、24例)にアジルサルタン40mgを1日1回5日間反復経口投与した時、高齢者のCmax、AUC(初回投与から8日目)は、非高齢者と比較してそれぞれ15.6%、9.0%減少した16)(外国人データ)。
16.7 薬物相互作用
16.7.1 フルコナゾール
健康成人(18例)にフルコナゾール(CYP2C9阻害剤)200mgを1日1回7日間反復投与及びアジルサルタン40mgを単回経口併用投与(フルコナゾール投与7日目)した時、アジルサルタンのCmax、AUCは、単独投与時と比較してそれぞれ14.1%、42.1%増加した17)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
成人のI度又はII度本態性高血圧症患者を対象にアジルサルタンを1日1回12週間経口投与したプラセボ対照二重盲検比較試験の結果は以下のとおりであった18)。
トラフ時座位血圧変化量注1)はいずれの投与群においてもプラセボ投与群に比べ有意な差が認められた(p<0.0001、対比検定)。
トラフ時座位血圧変化量注1)はいずれの投与群においてもプラセボ投与群に比べ有意な差が認められた(p<0.0001、対比検定)。
注1)LOCF法(Last observation carried forward法)
| 投与群 | n | トラフ時座位血圧(mmHg) | |||
| 拡張期 | 収縮期 | ||||
| 投与前値 | 変化量 | 投与前値 | 変化量 | ||
| プラセボ | 82 | 100.8±4.21 | −4.1±9.12注3) | 160.0±7.66 | −8.2±14.63注3) |
| アジルサルタン10mg | 83 | 100.2±4.07 | −10.8±7.76注3) | 158.5±6.96 | −17.6±14.20注3) |
| アジルサルタン20mg | 85 | 101.5±4.72 | −12.5±9.60 | 159.2±6.71 | −20.5±13.71 |
| アジルサルタン40mg | 82 | 100.4±4.14 | −14.3±9.92 | 159.2±7.04 | −22.2±16.83 |
| カンデサルタン シレキセチル8〜12mg注2) | 82 | 101.0±4.40 | −10.9±10.13注4) | 159.6±7.68 | −18.3±15.88注4) |
副作用発現頻度は、アジルサルタン10mg投与群で15.7%(13/83例)、アジルサルタン20mg投与群で16.5%(14/85例)及びアジルサルタン40mg投与群で13.4%(11/82例)であった。主な副作用は、10mg投与群で尿中血陽性3.6%(3/83例)、20mg投与群で浮動性めまい2.4%(2/85例)及び血中クレアチンホスホキナーゼ増加2.4%(2/85例)であった18)。[7.参照]
17.1.2 国内第III相試験
成人のI度又はII度本態性高血圧症患者を対象にアジルサルタン投与群に1日1回20mg(8週間)及び40mg(8週間)の計16週間投与、並びにカンデサルタン シレキセチル投与群に8mg及び12mgを同一用法にて経口投与した二重盲検比較試験の結果は以下のとおりであった19)。
トラフ時座位血圧変化量(LOCF法)は、アジルサルタン投与群(n=311)において対照群のカンデサルタン シレキセチル投与群(n=309)に比べ有意な差が認められた。
なお、トラフ時座位血圧の投与前値(拡張期/収縮期:平均値±標準偏差)は、アジルサルタン投与群(n=313)は100.3±4.26mmHg/160.0±7.70mmHg、カンデサルタン シレキセチル投与群(n=309)は100.4±4.11mmHg/159.6±7.27mmHgであった。
トラフ時座位血圧変化量(LOCF法)は、アジルサルタン投与群(n=311)において対照群のカンデサルタン シレキセチル投与群(n=309)に比べ有意な差が認められた。
なお、トラフ時座位血圧の投与前値(拡張期/収縮期:平均値±標準偏差)は、アジルサルタン投与群(n=313)は100.3±4.26mmHg/160.0±7.70mmHg、カンデサルタン シレキセチル投与群(n=309)は100.4±4.11mmHg/159.6±7.27mmHgであった。
| 投与群 | トラフ時座位血圧(mmHg) | |||
| 拡張期 | 収縮期 | |||
| 変化量注1) | 群間差注2) | 変化量注1) | 群間差注2) | |
| 投与8週時点 | ||||
| アジルサルタン20mg | −11.0±8.87 | −2.0 [−3.21,−0.69] p=0.0024 | −19.9±14.30 | −2.6 [−4.62,−0.60] p=0.0109 |
| カンデサルタン シレキセチル8mg | −9.0±7.43 | −17.3±11.75 | ||
| 投与16週時点(最終評価時) | ||||
| アジルサルタン20〜40mg | −12.4±9.87 | −2.6 [−4.08,−1.22] p=0.0003 | −21.8±15.30 | −4.4 [−6.53,−2.20] p<0.0001 |
| カンデサルタン シレキセチル8〜12mg | −9.8±8.50 | −17.5±12.69 | ||
副作用発現頻度はアジルサルタン投与群で7.3%(23/313例)であった。主な副作用は、アジルサルタン群で血中尿酸増加1.6%(5/313例)、体位性めまい1.6%(5/313例)及び浮動性めまい1.0%(3/313例)であった19)。
血圧日内変動は、自由行動下血圧測定(ABPM)の結果、アジルサルタン投与群の投与0週及び14週時点の24時間血圧推移は以下のとおりであった。
17.1.3 国内第III相試験(長期投与試験)
17.1.4 国内第III相試験
17.1.5 国内第III相試験
17.1.6 国内第III相試験(長期投与試験)
6歳以上16歳未満の高血圧症患者(27例)を対象とした長期投与試験において、アジルサルタンを体重20kg以上50kg未満の患者では2.5〜20mg(2.5mgより開始し、降圧目標注1)に到達せず、忍容性に問題がない場合は5mg、10mg、20mgの順で段階的注2)に増量)、体重50kg以上の患者では5〜40mg(5mgより開始し、降圧目標注1)に到達せず、忍容性に問題がない場合は10mg、20mg、40mgの順で段階的注2)に増量)を1日1回52週間経口投与した。結果は以下のとおりであった。治療期第1期(0〜12週)ではレニン−アンジオテンシン系阻害薬以外の降圧薬1剤の同一用法・用量での併用を、治療期第2期(12〜52週)ではレニン−アンジオテンシン系阻害薬以外の降圧薬の追加又は用量変更を可能とした24)。
注1)本態性高血圧では「小児の性別・年齢別血圧基準値(小児期心疾患における薬物療法ガイドライン2012)」の95パーセンタイル未満、二次性高血圧では90パーセンタイル未満。
注2)来院時(2、4、8、12、16、20、24、32、40週後)ごとに判断された。
| トラフ時座位血圧(mmHg)注1) | ||
| 拡張期 | 収縮期 | |
| 投与前値 | 72.0±13.43 | 125.7±12.89 |
| 変化量注2) | ||
| 投与12週時点(治療期第1期終了時) | −13.9±13.24 | −12.4±10.33 |
| 投与52週時点(治療期第2期終了時) | −10.9±13.23 | −10.0±11.47 |
副作用発現頻度は、44.4%(12/27例)であった。主な副作用は、浮動性めまい7.4%(2/27例)、頭痛7.4%(2/27例)及び腎機能障害7.4%(2/27例)であった24)。
17.1.7 国内第III相試験(長期投与試験)
2歳以上6歳未満の高血圧症患者(9例)を対象とした長期投与試験において、アジルサルタンを0.1〜0.8mg/kg[0.1mg/kg(最大2.5mg)より開始し、降圧目標注1)に到達せず、忍容性に問題がない場合は0.2mg/kg(最大5mg)、0.4mg/kg(最大10mg)、0.8mg/kg(最大20mg)の順で段階的注2)に増量]を1日1回52週間経口投与した。結果は以下のとおりであった。治療期0〜12週ではレニン−アンジオテンシン系阻害薬以外の降圧薬1剤の同一用法・用量での併用を、治療期12〜52週ではレニン−アンジオテンシン系阻害薬以外の降圧薬の追加又は用量変更を可能とした25)。
注1)本態性高血圧では「小児の性別・年齢別血圧基準値[先天性心疾患並びに小児期心疾患の診断検査と薬物療法ガイドライン(2018年改訂版)]」の95パーセンタイル未満、二次性高血圧では90パーセンタイル未満。
注2)来院時(2、4、8、12、16、20、24、32、40週後)ごとに判断された。
| トラフ時座位血圧(mmHg)注1) | ||
| 拡張期 | 収縮期 | |
| 投与前値 | 67.7±5.48 | 111.0±7.63 |
| 変化量注2) | ||
| 投与12週時点 | −10.9±11.04 | −8.0±6.73 |
| 投与52週時点 | −14.8±8.39 | −10.9±8.30 |
副作用発現頻度は、33.3%(3/9例)であった。副作用は、貧血11.1%(1/9例)、急性腎障害11.1%(1/9例)及び腎機能障害11.1%(1/9例)であった25)。
18. 薬効薬理
18.1 作用機序
アジルサルタンはアンジオテンシンIIタイプ1(AT1)受容体に結合してアンジオテンシンIIと拮抗し、主にその強力な血管収縮作用を抑制することによって生ずる末梢血管抵抗の低下により降圧作用を示す。
18.2 AT1受容体に対する阻害作用
ヒトAT1受容体の活性を濃度依存的に阻害し(IC50値:0.62〜2.6nmol/L)、AT1受容体からの解離は極めて緩やかであった(in vitro)12)。
18.3 レニン−アンジオテンシン系に及ぼす影響
健康成人(12例)にアジルサルタン20mgを1日1回7日間投与した時、血漿レニン活性、血漿アンジオテンシンI濃度及びアンジオテンシンII濃度の増加が認められた6)。
18.4 降圧作用
高血圧自然発症ラット(SHR)及び腎性高血圧(2K-1C)イヌにそれぞれ単回投与した時、24時間後まで降圧作用は持続した26)。
19. 有効成分に関する理化学的知見
19.1. アジルサルタン
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<アジルバ錠10mg>
PTP
100錠(10錠×10)、500錠(10錠×50)
<アジルバ錠20mg>
PTP
100錠(10錠×10)、500錠(10錠×50)
<アジルバ錠40mg>
PTP
100錠(10錠×10)、500錠(10錠×50)
<アジルバ顆粒1%>
瓶
100g(乾燥剤入り)
23. 主要文献
- 阿部真也 他, 周産期医学, 47, 1353-1355, (2017)
- 齊藤大祐 他, 鹿児島産科婦人科学会雑誌, 29, 49-54, (2021)
- アジルサルタンの非臨床毒性試験成績(2021年9月27日承認、CTD2.6.6.6)
- アジルサルタンの薬物動態試験成績[1](2012年1月18日承認、CTD2.7.6.3)
- アジルサルタンの薬物動態試験成績[2](2021年9月27日承認、CTD2.7.6.4)
- アジルサルタンの薬物動態試験成績[3](2012年1月18日承認、CTD2.7.6.5)
- アジルサルタンの母集団薬物動態解析(2024年8月28日承認、CTD2.7.2.3)
- アジルサルタンの薬物動態試験成績[4](2012年1月18日承認、CTD2.7.6.1)
- アジルサルタンの薬物動態試験成績[5](2021年9月27日承認、CTD2.7.6.1)
- アジルサルタンの蛋白結合に関する検討(2012年1月18日承認、CTD2.6.4.4)
- アジルサルタンの代謝に関する検討[1](2012年1月18日承認、CTD2.6.4.1)
- アジルサルタンの代謝に関する検討[2](2012年1月18日承認、CTD2.6.2.1)
- 腎機能障害患者における薬物動態試験成績(2012年1月18日承認、CTD2.7.2.2)
- アジルサルタンの臨床試験成績[1](2012年1月18日承認、CTD2.7.2.2)
- 肝機能障害者における薬物動態試験成績(2012年1月18日承認、CTD2.7.6.17)
- アジルサルタンの薬物動態試験成績[6](2012年1月18日承認、CTD2.7.6.15)
- フルコナゾールとの薬物相互作用試験成績(2012年1月18日承認、CTD2.7.6.18)
- アジルサルタンの臨床試験成績[2](2012年1月18日承認、CTD2.7.6.26)
- アジルサルタンの臨床試験成績[3](2012年1月18日承認、CTD2.7.6.27)
- アジルサルタンの臨床試験成績[4](2012年1月18日承認、CTD2.7.6.28)
- アジルサルタンの臨床試験成績[5](2012年1月18日承認、CTD2.7.6.29)
- アジルサルタンの臨床試験成績[6](2012年1月18日承認、CTD2.7.4.5)
- アジルサルタンの臨床試験成績[7](2012年1月18日承認、CTD2.7.6.30)
- アジルサルタンの臨床試験成績[8](2021年9月27日承認、CTD2.7.6.10)
- アジルサルタンの臨床試験成績[9](2024年8月28日承認、CTD2.7.6.3)
- アジルサルタンの降圧作用に関する検討(2012年1月18日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
武田薬品工業株式会社
くすり相談室
〒103-8668
東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
製品情報問い合わせ先
武田薬品工業株式会社
くすり相談室
〒103-8668
東京都中央区日本橋本町二丁目1番1号
電話:フリーダイヤル 0120-566-587 受付時間 9:00〜17:30(土日祝日・弊社休業日を除く)
26. 製造販売業者等
26.1 製造販売元
武田薬品工業株式会社
〒540-8645
大阪市中央区道修町四丁目1番1号