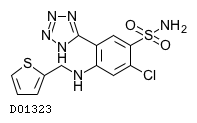
医薬品情報
| 総称名 | アゾセミド |
|---|---|
| 一般名 | アゾセミド |
| 欧文一般名 | Azosemide |
| 薬効分類名 | 持続型ループ利尿剤 |
| 薬効分類番号 | 2139 |
| KEGG DRUG |
D01323
アゾセミド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年12月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アゾセミド錠30mg「DSEP」 (後発品) | AZOSEMIDE TABLETS「DSEP」 | 第一三共エスファ | 2139008F2052 | 10.4円/錠 | 処方箋医薬品注) |
| アゾセミド錠60mg「DSEP」 (後発品) | AZOSEMIDE TABLETS「DSEP」 | 第一三共エスファ | 2139008F1072 | 11.3円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
心性浮腫(うっ血性心不全)、腎性浮腫、肝性浮腫
6. 用法及び用量
<アゾセミド錠30mg「DSEP」>
通常成人1日1回2錠(アゾセミドとして60mg)を経口投与する。
なお、年齢・症状により適宜増減する。
なお、年齢・症状により適宜増減する。
<アゾセミド錠60mg「DSEP」>
通常成人1日1回1錠(アゾセミドとして60mg)を経口投与する。
なお、年齢・症状により適宜増減する。
なお、年齢・症状により適宜増減する。
8. 重要な基本的注意
8.1 本剤の利尿効果は急激にあらわれることがあるので、電解質異常、脱水に十分注意し、少量から投与を開始して、徐々に増量すること。
8.2 連用する場合、電解質異常があらわれることがあるので定期的に検査を行うこと。[11.1.1参照]
8.3 夜間の休息が特に必要な患者には、夜間の排尿を避けるため、午前中に投与することが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 重篤な冠動脈硬化症又は脳動脈硬化症のある患者
急激な利尿があらわれた場合、急速な血漿量減少、血液濃縮をきたし、血栓塞栓症を誘発するおそれがある。
9.1.2 本人又は両親、兄弟に痛風、糖尿病のある患者
痛風発作を起こすことがある。糖尿病が悪化することがある。
9.1.3 下痢、嘔吐のある患者
電解質異常を起こすことがある。[11.1.1参照]
9.1.4 手術前の患者[10.2参照]
9.1.5 減塩療法時の患者
低ナトリウム血症を起こすことがある。[11.1.1参照]
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
排泄遅延により血中濃度が上昇するおそれがある。
9.3 肝機能障害患者
9.3.1 肝性昏睡の患者
投与しないこと。低カリウム血症によるアルカローシスの増悪により肝性昏睡が悪化するおそれがある。[2.2参照]
9.3.2 進行した肝硬変症のある患者
肝性昏睡を誘発するおそれがある。
9.3.3 肝疾患・肝機能障害のある患者
肝性昏睡を誘発するおそれがある。
9.5 妊婦
妊婦(2カ月〜6カ月)又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
動物実験(ラット、マウス)で、生後には消失する一過性の骨格異常が認められている。
動物実験(ラット、マウス)で、生後には消失する一過性の骨格異常が認められている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
類薬において、動物実験で母乳中に移行することが報告されている。
類薬において、動物実験で母乳中に移行することが報告されている。
9.7 小児等
9.7.1 低出生体重児
腎石灰化症があらわれるおそれがある。
9.7.2 乳児
電解質バランスがくずれやすい。
9.8 高齢者
次の点に注意し、少量から投与を開始するなど患者の状態を観察しながら慎重に投与すること。[11.1.1参照]
・急激な利尿は血漿量の減少をきたし、脱水、低血圧等による立ちくらみ、めまい、失神等を起こすことがある。
・特に心疾患等で浮腫のある高齢者では急激な利尿は急速な血漿量の減少と血液濃縮をきたし、脳梗塞等の血栓塞栓症を誘発するおそれがある。
・低ナトリウム血症、低カリウム血症があらわれやすい。
10. 相互作用
10.1 併用禁忌
| デスモプレシン酢酸塩水和物 ミニリンメルト(男性における夜間多尿による夜間頻尿) [2.4参照] | 低ナトリウム血症が発現するおそれがある。 | いずれも低ナトリウム血症が発現するおそれがある。 |
10.2 併用注意
| 昇圧アミン ノルアドレナリン アドレナリン [9.1.4参照] | 昇圧アミンの作用を減弱するおそれがあるので、手術前の患者に使用する場合には、本剤の一時休薬等の処置を行うこと。 | 併用により血管壁の反応性が低下するためと考えられる。 |
| ツボクラリン及びその類似作用物質 [9.1.4参照] | ツボクラリン及びその類似作用物質の麻痺作用を増強するおそれがあるので、手術前の患者に使用する場合には、本剤の一時休薬等の処置を行うこと。 | 利尿剤による血清カリウム値の低下により、これらの薬剤の神経・筋遮断作用が増強されると考えられる。 |
| 降圧剤 ACE阻害剤 β-遮断剤等 | 降圧作用を増強するおそれがあるので、用量調節等に注意すること。 | 本剤はナトリウムの再吸収を抑制するため降圧作用を増強すると考えられる。 |
| アミノグリコシド系抗生物質 ゲンタマイシン硫酸塩 アミカシン硫酸塩等 | アミノグリコシド系抗生物質の第8脳神経障害(聴覚障害)を増強するおそれがある。 | アミノグリコシド系抗生物質の内耳外有毛細胞内濃度が上昇し、最終的には外有毛細胞の壊死を引き起こし、永続的な難聴が起こる場合もあると考えられる。 |
| シスプラチン | シスプラチンの聴覚障害を増強するおそれがある。 | シスプラチンの内耳外有毛細胞内濃度が上昇し、最終的には外有毛細胞の壊死を引き起こし、永続的な難聴が起こる場合もあると考えられる。 |
| セファロスポリン系抗生物質 セファロチンナトリウム等 アミノグリコシド系抗生物質 ゲンタマイシン硫酸塩 アミカシン硫酸塩等 | 抗生物質の腎毒性を増強するおそれがある。 | 近位尿細管でのナトリウム再吸収の増加に伴い、抗生物質の再吸収も増加することにより、組織内濃度が上昇し腎毒性が増強する。 |
| ジギタリス剤 ジゴキシン | ジギタリスの心臓に対する作用を増強するおそれがあるので、血清カリウム値及び血中ジギタリス濃度に注意すること。 | 利尿剤による血清カリウム値の低下により、多量のジギタリスが心筋Na+-K+ATPaseに結合し、心収縮力の増強と不整脈が起こると考えられる。 |
| 糖質副腎皮質ホルモン剤 ヒドロコルチゾン等 ACTH グリチルリチン製剤 甘草含有製剤 | 過剰のカリウム放出により、低カリウム血症が発現するおそれがある。 | 共にカリウム排泄作用を持つ。 |
| 糖尿病用剤 スルホニルウレア剤 インスリン | 糖尿病用剤の作用を著しく減弱するおそれがある。 | 細胞内外のカリウム喪失がインスリン分泌の抑制、末梢でのインスリン感受性の低下をもたらすと考えられる。 |
| ビグアナイド系薬剤 メトホルミン塩酸塩等 | ビグアナイド系薬剤による乳酸アシドーシスを起こすおそれがあるので、脱水症状があらわれた場合には、適切な処置を行うこと。 | 体液量が減少し脱水状態になるおそれがある。 |
| SGLT2阻害剤 | 利尿作用が増強されるおそれがあるので、血圧、脈拍数、尿量、血清ナトリウム濃度等を確認し、脱水症状の発現に注意すること。必要に応じ本剤の用量を調整するなど注意すること。 | 利尿作用が増強されるおそれがある。 |
| リチウム 炭酸リチウム | リチウムの毒性を増強するおそれがあるので、血中リチウム濃度に注意すること。 | リチウムの腎での再吸収を促進し、リチウムの血中濃度が上昇すると考えられる。 |
| サリチル酸誘導体 アスピリン サリチル酸ナトリウム | サリチル酸誘導体毒性が発現するおそれがある。 | 腎の排泄部位において両剤の競合が起こり、サリチル酸誘導体の排泄が遅れサリチル酸中毒が起こると考えられる。 |
| 非ステロイド性消炎鎮痛剤 インドメタシン等 | 本剤の利尿作用を減弱するおそれがある。 | 非ステロイド性消炎鎮痛剤が腎でのプロスタグランジン合成を阻害し、水、ナトリウムの体内貯留を引き起こし、利尿剤の作用と拮抗する。 |
| 尿酸排泄促進剤 プロベネシド | 尿酸排泄促進剤の尿酸排泄作用を減弱するおそれがある。 | 尿酸再吸収の間接的増大により、尿酸排泄促進剤の作用が抑制されると考えられる。 |
| カルバマゼピン | 症候性低ナトリウム血症が発現するおそれがある。 | ナトリウム排泄作用が増強され、低ナトリウム血症が起こると考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 電解質異常(頻度不明)
11.1.2 無顆粒球症、白血球減少(いずれも頻度不明)
注1)発現頻度は、使用成績調査の結果を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 代謝異常 | 低クロール性アルカローシス、高尿酸血症 | 高血糖症、高コレステロール血症、高トリグリセライド血症 | |
| 過敏症 | 発疹 | ||
| 消化器 | 嘔気、嘔吐、食欲不振、胃部不快感、下痢、腹痛、口渇 | 膵炎注2)(血清アミラーゼ値上昇) | |
| 血液 | 血小板減少 | ||
| 肝臓 | AST上昇、ALT上昇 | Al-P上昇、ビリルビン値上昇 | |
| 腎臓 | BUN上昇、クレアチニン上昇 | ||
| 泌尿器 | 頻尿 | ||
| 精神神経系 | めまい、耳鳴、頭痛 | ||
| その他 | 脱力感、倦怠感、筋痙攣、関節痛 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性(6例)にアゾセミド60mgを単回経口投与した場合、血漿中濃度は次図のとおりである1)。
| 投与量(経路) | AUC(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) |
| アゾセミド60mg(経口) | 2640±374 | 445±42 | 3.3±0.5 | 2.6±0.2 |
16.4 代謝
健康成人男性(5例)にアゾセミド60mgを経口投与したとき、尿中にアゾセミドの未変化体、酸化的脱テニル体、グルクロン酸抱合体がそれぞれ排泄された2)。
16.5 排泄
健康成人男性(5例)にアゾセミド60mgを経口投与したとき、48時間までに尿中へ4.4%、72時間までに糞中へ71.1%排泄された2)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
18.2 利尿作用
19. 有効成分に関する理化学的知見
19.1. アゾセミド
22. 包装
<アゾセミド錠30mg「DSEP」>
(PTP)
100錠(10錠×10)
500錠(10錠×50)
1,000錠(10錠×100)
(プラスチックボトル:バラ:乾燥剤入り)
500錠
<アゾセミド錠60mg「DSEP」>
(PTP)
100錠(10錠×10)
500錠(10錠×50)
1,000錠(10錠×100)
(プラスチックボトル:バラ:乾燥剤入り)
500錠
23. 主要文献
- 社内資料:薬物動態に関する資料
- 社内資料:ヒト経口投与後の排泄に関する資料
- 大島研三ほか, 基礎と臨床, 18 (7), 3025-3039, (1984)
- 大島研三ほか, 基礎と臨床, 18 (8), 4117-4218, (1984)
- 大島研三ほか, 医学のあゆみ, 130 (1), 70-94, (1984)
- 山田和生ほか, 基礎と臨床, 18 (9), 4471-4490, (1984)
- 社内資料:アゾセミドの心不全に対する臨床効果
- 藤沢洌ほか, 肝胆膵, 9 (2), 293-304, (1984)
- Greven J,et al., Arzneim-Forsch., 31 (1Nr 2), 350-353, (1981)
- Greven J,et al., Arzneim-Forsch., 31 (1Nr 2), 346-350, (1981)
- Brater DC, Clin Pharmacol Ther., 25, 428-434, (1979) »PubMed
- 林元英ほか, 応用薬理, 28 (5), 859-877, (1984)
- 林元英ほか, 応用薬理, 28 (5), 837-849, (1984)
24. 文献請求先及び問い合わせ先
文献請求先
第一三共エスファ株式会社
お客様相談室
〒103-0027
東京都中央区日本橋2-13-12
電話:0120-100-601
製品情報問い合わせ先
第一三共エスファ株式会社
お客様相談室
〒103-0027
東京都中央区日本橋2-13-12
電話:0120-100-601
26. 製造販売業者等
26.1 製造販売元
第一三共エスファ株式会社
東京都中央区日本橋本町3-5-1
26.2 販売提携
第一三共株式会社
東京都中央区日本橋本町3-5-1