医薬品情報
| 総称名 | ラゲブリオ |
|---|---|
| 一般名 | モルヌピラビル |
| 欧文一般名 | Molnupiravir |
| 製剤名 | モルヌピラビル錠・モルヌピラビルカプセル |
| 薬効分類名 | 抗ウイルス剤 |
| 薬効分類番号 | 6250 |
| ATCコード | J05AB18 |
| KEGG DRUG |
D11943
モルヌピラビル
|
| KEGG DGROUP |
DG03174
抗SARS-CoV-2薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第13版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ラゲブリオ錠400mg | LAGEVRIO Tablets 400mg | MSD | 6250051F1029 | 4329.8円/錠 | 劇薬, 処方箋医薬品 |
| ラゲブリオカプセル200mg | LAGEVRIO Capsules 200mg | MSD | 6250051M1028 | 2164.9円/カプセル | 劇薬, 処方箋医薬品 |
2. 禁忌
4. 効能または効果
5. 効能または効果に関連する注意
5.1 臨床試験における主な投与経験を踏まえ、SARS-CoV-2による感染症の重症化リスク因子を有する等、本剤の投与が必要と考えられる患者に投与すること。また、本剤の投与対象については最新のガイドラインも参考にすること。[17.1.1参照]
5.2 重症度の高いSARS-CoV-2による感染症患者に対する有効性は確立していない。
6. 用法及び用量
通常、18歳以上の患者には、モルヌピラビルとして1回800mgを1日2回、5日間経口投与する。
7. 用法及び用量に関連する注意
SARS-CoV-2による感染症の症状が発現してから速やかに投与を開始すること。臨床試験において、症状発現から6日目以降に投与を開始した患者における有効性を裏付けるデータは得られていない。[17.1.1参照]
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.4 生殖能を有する者
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
ラットの授乳期にモルヌピラビルを投与したとき、出生児の血漿中にNHCが検出されている。ヒト乳汁中への移行の有無及び乳汁産生への影響に関するデータはない。
ラットの授乳期にモルヌピラビルを投与したとき、出生児の血漿中にNHCが検出されている。ヒト乳汁中への移行の有無及び乳汁産生への影響に関するデータはない。
9.7 小児等
18歳未満を対象とした臨床試験は実施していない。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
アナフィラキシー(頻度不明)
11.2 その他の副作用
| 1%以上2%未満 | 1%未満 | 頻度不明 | |
| 胃腸障害 | 下痢、悪心 | 嘔吐 | |
| 神経系障害 | 浮動性めまい | 頭痛 | |
| 皮膚及び皮下組織障害 | 発疹、蕁麻疹 | 中毒性皮疹、紅斑、そう痒 | |
| 過敏症 | 血管性浮腫 |
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 モルヌピラビル及びNHCの細菌を用いた変異原性試験の結果は陽性であった。しかし、げっ歯類を用いた2種の変異原性試験(Pig-a試験及びBig Blueトランスジェニック動物を用いたcII遺伝子座における試験)を実施した結果、変異原性は認められなかった。In vitro小核試験及びラットを用いた小核試験の結果は陰性であった。加えて、rasH2トランスジェニックマウスを用いた6ヵ月間投与がん原性試験において、発がん性は認められなかった。
15.2.2 3ヵ月間投与毒性試験において、NHCのAUCに基づく臨床曝露量の6倍に相当する用量の投与で急速に成長しているラットの大腿骨及び脛骨に骨端軟骨成長板の肥厚が認められた。同様の変化は、ラットの1ヵ月間投与試験(曝露量は上記試験と同程度)並びにマウス(臨床曝露量の21倍までを1ヵ月間投与)及びイヌ(臨床曝露量の2倍までを14日間投与)の試験では認められていない。
15.2.3 イヌにNHCの臨床曝露量の0.4倍以上に相当する用量を投与した際に回復性のある骨髄毒性(すべての造血系細胞に影響)が認められた。モルヌピラビルを7日間投与した際に循環血の血球系細胞数及び血小板数に軽度の減少がみられ、14日間の投与で循環血により重度の変化がみられた。同様の変化は他の動物種では認められていない。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人
モルヌピラビルはNHCのプロドラッグであり、全身循環へ到達する前に主要代謝物であるNHCへ加水分解され細胞内に取り込まれた後、活性型であるリボヌクレオシド三リン酸化体(NHC-TP)にリン酸化される。
(1)単回投与
健康成人にモルヌピラビルカプセルを800mgの用量で単回経口投与した際のNHCの血漿中濃度推移を図1に、血漿中薬物動態パラメータを表1に示す。モルヌピラビル200〜1600mgの範囲で、NHCのCmax及びAUCは概して用量に比例して増加した1)。
図1 健康成人にモルヌピラビル800mgを単回経口投与した際のNHCの血漿中濃度推移(平均値+標準偏差)
| 例数 | Tmax†(hr) | Cmax††(ng/mL) | AUC0-12hr††(ng・hr/mL) |
| 15 | 1.50(1.00-2.00) | 5000(4450-5610) | 12100(11100-13300) |
(2)反復投与
健康成人にモルヌピラビルカプセルを800mgの用量で12時間ごとに反復経口投与した際のNHCの血漿中薬物動態パラメータは表2のとおりであった。1日2回の反復経口投与で得られたNHCのAUC0-12hrの累積係数(1.05)に基づく有効半減期は2.73時間であった1)。
| 例数 | Tmax†(hr) | Cmax††(ng/mL) | AUC0-12hr††(ng・hr/mL) |
| 13 | 1.50(1.00-2.50) | 4660(4130-5260) | 12700(11600-13900) |
(3)生物学的同等性試験
クロスオーバー法により健康成人(64例)にモルヌピラビル錠又はモルヌピラビルカプセルを400mgの用量で単回経口投与した際、得られたNHCの血漿中Cmax及びAUC0-lastの幾何平均比とその90%信頼区間(モルヌピラビル錠/モルヌピラビルカプセル)は、それぞれ0.98(0.93-1.03)及び1.00(0.97-1.03)であった。幾何平均比の90%信頼区間は事前に規定した同等域[0.8〜1.25]の範囲内であり、モルヌピラビル錠はモルヌピラビルカプセルと生物学的に同等であった2)(外国人データ)。
16.2 吸収
16.2.1 食事の影響
16.3 分布
NHCのヒト血漿蛋白に対する結合率は0%であった(in vitroデータ)。
16.4 代謝
モルヌピラビルはNHCのプロドラッグであり、全身循環へ到達する前に主要代謝物であるNHCへ加水分解される。NHCは内因性ピリミジンの代謝と同じ経路でウリジン及びシチジンへ代謝され、消失する。
16.5 排泄
健康成人にモルヌピラビルカプセルを800mgの用量で1日2回5.5日間反復経口投与した際、NHCの尿中排泄率は3%であった(外国人データ)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害者
モルヌピラビル及びNHCの主要な消失経路は腎排泄ではない。母集団薬物動態解析の結果、軽度及び中等度の腎機能障害がNHCの薬物動態に及ぼす意味のある影響はみられなかった。また、臨床薬物動態試験において、重度腎機能障害者(eGFR 30mL/min/1.73m2未満)にモルヌピラビルを単回経口投与した際、NHCのAUC0-infは健康成人の1.24倍(90%信頼区間:0.94,1.64)であり、意味のある差はみられなかった(外国人データ)3)。透析を必要とする患者におけるモルヌピラビル及びNHCの薬物動態の評価は実施していない。
16.6.2 肝機能障害者
非臨床試験の結果、NHCの主要な消失経路は肝代謝ではないと考えられた。臨床薬物動態試験において、中等度肝機能障害者(Child-Pugh分類B)にモルヌピラビルを単回経口投与した際、NHCのAUC0-infは健康成人の1.22倍(90%信頼区間:0.92,1.64)であり、意味のある差はみられなかった(外国人データ)3)。また、モルヌピラビルは主に消化管及び肝臓でNHCへ代謝される一方、モルヌピラビルの加水分解に必要な代謝酵素は広範な組織に分布しているため、肝機能障害がモルヌピラビルの曝露量に影響を及ぼす可能性は低い。
16.6.3 高齢者
母集団薬物動態解析の結果、高齢者におけるNHCの薬物動態は若年者と同様であった(外国人データ)。
16.7 薬物相互作用
16.7.1 In vitro試験成績
モルヌピラビル及びNHCは主要な薬物代謝酵素及びトランスポーターの基質ではない。また、モルヌピラビル及びNHCは主要な薬物代謝酵素及びトランスポーターに対する阻害作用又は誘導作用を示さなかった。
16.7.2 臨床における薬物相互作用試験
臨床薬物相互作用試験は実施していない。
注)本剤の承認された用法及び用量は、1回800mgを1日2回5日間経口投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第II/III相試験[MOVe-OUT(002)試験]
18歳以上のSARS-CoV-2による感染症患者を対象に、モルヌピラビルの有効性、安全性等を評価することを目的として、プラセボ対照無作為化二重盲検並行群間比較試験を実施した。主要評価項目は、無作為化29日目までの理由を問わないすべての入院又は死亡した被験者の割合とした。第III相パートでは、モルヌピラビル800mgを1日2回(12時間ごと)5日間経口投与した。主要な解析である中間解析では775例が無作為割り付けされ、無作為化29日目までの追跡を完了した時点(日本人被験者は含まれなかった)での主要評価項目の結果は、モルヌピラビル800mg群7.3%(28/385例)及びプラセボ群14.1%(53/377例)であり、割合の群間差は−6.8%(95%信頼区間:−11.3,−2.4)であった(表1)。なお、無作為割り付けされた1433例(日本人被験者8例を含む)全例における補足的な解析での主要評価項目の結果は、モルヌピラビル800mg群6.8%(48/709例)及びプラセボ群9.7%(68/699例)であり、割合の群間差は−3.0%(95%信頼区間:−5.9,−0.1)であった。内訳は、モルヌピラビル800mg群で入院48/709例(6.8%)、死亡1/709例(0.1%)であり、プラセボ群で入院67/699例(9.6%)、死亡9/699例(1.3%)、不明1/699例(0.1%)であった。
| モルヌピラビル800mg群 (385例) 例数(%) | プラセボ群 (377例) 例数(%) | 割合の群間差† (95%信頼区間) | P値††† | |
| 無作為化29日目までの理由を問わないすべての入院又は死亡§ | 28 (7.3%) | 53 (14.1%) | −6.8 (−11.3,−2.4) | 0.0012 |
| 入院 | 28 (7.3%) | 52 (13.8%) | ||
| 死亡 | 0 (0%) | 8 (2.1%) | ||
| 不明‖ | 0 (0%) | 1 (0.3%) |
なお、本試験の主な選択・除外基準は表2のとおりであった。
| 選択基準 | 1.SARS-CoV-2陽性(無作為割付け前5日以内に採取した検体を用いたPCR検査等により確認)。 2.SARS-CoV-2による感染症の症状a)発現が無作為割付け前5日以内であり、かつ無作為化時点においてSARS-CoV-2による感染症に関連する症状b)が1つ以上認められる。 3.以下の定義における、軽症患者又は中等症患者。 SARS-CoV-2による感染症の重症度の判定に用いられた定義は以下のとおり。 【軽症】[1]及び[2]を満たす [1]次のすべてが認められる 呼吸数が20回/分未満、心拍数が90回/分未満、SpO2が93%超c) [2]次のいずれも認められない 安静時又は労作時の息切れ、呼吸不全d)、ショック状態、多臓器機能不全 【中等症】[1]〜[3]をすべて満たす [1]次のうち、1つ以上が認められる 労作時の息切れ、呼吸数が20回/分以上30回/分未満、心拍数が90回/分以上125回/分未満 [2]次のうち、いずれかが認められる ・SpO2が93%超c) ・SpO2に関わらず、SARS-CoV-2による感染症のために4L/min以下の酸素投与を要する [3]次のいずれも認められない 安静時の息切れ、呼吸不全d)、ショック状態、多臓器機能不全 4.次のSARS-CoV-2による感染症の重症化リスク因子を1つ以上有する。 ・61歳以上 ・活動性のがん(免疫抑制又は高い死亡率を伴わないがんは除く) ・慢性腎臓病 ・慢性閉塞性肺疾患 ・肥満(BMI 30kg/m2以上) ・重篤な心疾患(心不全、冠動脈疾患又は心筋症) ・糖尿病 |
| 除外基準 | 1.入院中又は無作為割付け後48時間以内にSARS-CoV-2による感染症のために入院が必要となることが予想される。 2.SARS-CoV-2による感染症に対するワクチンを無作為割付け前に接種した、又は無作為化29日目までに接種を予定している。 3.本試験への組入れ理由となった今回のSARS-CoV-2による感染症に対するモノクローナル抗体による治療歴を有する。 |
副作用発現頻度は、モルヌピラビル800mg群で8.0%(57/710例)であり、主な副作用(発現割合1%以上)は、下痢1.7%(12/710例)、悪心1.4%(10/710例)、浮動性めまい1.0%(7/710例)であった。[5.1、7.参照]
18. 薬効薬理
18.1 作用機序
18.2 In vitro抗ウイルス作用
NHCはVero E6細胞を用いた細胞培養系でSARS-CoV-2(USA-WA1/2020株)に対して抗ウイルス作用を示し、50%有効濃度(EC50値)は0.78〜2.03μmol/Lであった。
NHCはSARS-CoV-2の変異株であるalpha株(B.1.1.7系統)、beta株(B.1.351系統)、gamma株(P.1系統)、delta株(B.1.617.2系統)、lambda株(C.37系統)、mu株(B.1.621系統)並びにomicron株(B.1.1.529/BA.1、BA.1.1、BA.2、BA.4、BA.4.6及びBQ.1.1系統)に対して抗ウイルス作用を示し、EC50値の範囲は従来株(USA-WA1/2020株)では0.57〜2.26μmol/L、変異株では0.40〜5.5μmol/Lであった(Vero E6細胞)。また、NHCはSARS-CoV-2の変異株であるomicron株(B.1.1.529/BA.4、BA.5及びXBB.1.16系統)に対して抗ウイルス作用を示し、EC50値の範囲は従来株では0.65〜0.93μmol/L、変異株では0.28〜0.71μmol/Lであった(Vero E6-TMPRSS2細胞)。さらに、NHCはSARS-CoV-2の変異株であるomicron株(B.1.1.529/XBB.1及びXBB.1.5系統)に対して抗ウイルス作用を示し、EC50値の範囲は0.45〜0.67μmol/Lであった(Vero E6-TMPRSS2-ACE2細胞)。
18.3 In vivo抗ウイルス作用
SARS-CoV-2感染マウス、ハムスター及びフェレットモデルを用いてモルヌピラビルの抗ウイルス作用を確認した。マウスでは、モルヌピラビルはウイルスを接種した移植ヒト肺組織でのSARS-CoV-2の感染性ウイルス量を減少させた。SARS-CoV-2感染フェレットモデルでは、モルヌピラビルは上気道でのSARS-CoV-2の感染性ウイルス量を減少させ、同居させたウイルス非接種薬物非投与動物での感染性ウイルス量(感染フェレットから隔離後4日目)は検出限界未満であった。SARS-CoV-2感染シリアンハムスターモデルでは、モルヌピラビルは肺でのウイルスRNA及び感染性ウイルス量を減少させた。感染後に摘出した肺組織の病理組織学的検査で、媒体群と比較してモルヌピラビル群ではSARS-CoV-2のウイルス抗原量の低下及び肺病変の軽減が認められた。
18.4 薬剤耐性
NHCの存在下でSARS-CoV-2(USA-WA1/2020株)をVero E6細胞培養系にて30回継代した結果、NHCのEC50値の変化は2倍未満であった。30回継代したSARS-CoV-2ではゲノム全体にランダムに変異が認められた。
19. 有効成分に関する理化学的知見
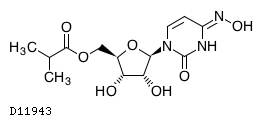
19.1. モルヌピラビル
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<ラゲブリオ錠400mg>
20錠[瓶、バラ]
<ラゲブリオカプセル200mg>
40カプセル[瓶、バラ]
23. 主要文献
- Nakamura K,et al., Clin Transl Sci., 15, 2697-708, (2022) »PubMed
- Fiore JL,et al., Antimicrob Agents Chemother., 69, e0143424, (2025) »PubMed
- Duncan KE, et al., Clin Transl Sci., 17, e70073, (2024) »PubMed
- Crotty S,et al., Nat Med., 6, 1375-9, (2000) »PubMed
- Tejero H,et al., Curr Top Microbiol Immunol., 392, 161-79, (2016) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
MSD株式会社
MSDカスタマーサポートセンター
東京都千代田区九段北1-13-12
電話:医療関係者の方:フリーダイヤル 0120-024-961
製品情報問い合わせ先
MSD株式会社
MSDカスタマーサポートセンター
東京都千代田区九段北1-13-12
電話:医療関係者の方:フリーダイヤル 0120-024-961
26. 製造販売業者等
26.1 製造販売元
MSD株式会社
東京都千代田区九段北1-13-12