医薬品情報
| 総称名 | ラピフォート |
|---|---|
| 一般名 | グリコピロニウムトシル酸塩水和物 |
| 欧文一般名 | Glycopyrronium Tosilate Hydrate |
| 製剤名 | グリコピロニウムトシル酸塩水和物 ワイプ |
| 薬効分類名 | 原発性腋窩多汗症治療剤 |
| 薬効分類番号 | 1259 |
| ATCコード | D11AA01 |
| KEGG DRUG |
D10939
グリコピロニウムトシル酸塩水和物
|
| KEGG DGROUP |
DG02467
グリコピロニウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年5月 改訂(第3版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 25.保険給付上の注意 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ラピフォートワイプ2.5% | Rapifort Wipes | マルホ | 1259701X1026 | 250.6円/包 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 閉塞隅角緑内障の患者[抗コリン作用により眼圧が上昇し、症状を悪化させることがある。]
2.2 前立腺肥大による排尿障害のある患者[抗コリン作用により排尿時の膀胱収縮が抑制され、症状が悪化するおそれがある。][9.1.1参照]
2.3 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
原発性腋窩多汗症
6. 用法及び用量
1日1回、1包に封入されている不織布1枚を用いて薬液を両腋窩に塗布する。
8. 重要な基本的注意
8.1 抗コリン作用により、羞明、霧視、散瞳等の眼の調節障害があらわれることがあるので、自動車の運転等、危険を伴う機械の操作に従事する際には注意するよう患者に十分に説明すること。
8.2 発汗が促進される環境下では、本剤の発汗抑制作用により、体温が上昇するおそれがある。熱中症を疑う症状があらわれた場合には、適切な処置を行うよう患者に指導すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 前立腺肥大症の患者(排尿障害のある患者を除く)
抗コリン作用により、尿閉を誘発するおそれがある。当該患者は臨床試験で除外されている。[2.2参照]
9.1.2 塗布部位に創傷や湿疹・皮膚炎等がみられる患者
創傷や湿疹、皮膚炎等がある部位への使用は避けること。体内移行量が増加し、抗コリン作用に基づく副作用があらわれやすくなる可能性がある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット:皮下投与)で胎盤通過性が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット:皮下投与)で乳汁中移行が報告されている。
9.7 小児等
9歳未満の小児等を対象とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 1%以上 | 1%未満 | 頻度不明 | |
| 眼 | 羞明、散瞳、霧視、ドライアイ | 視力低下 | |
| 泌尿器 | 排尿困難、頻尿 | 尿量減少、排尿回数減少、膀胱炎 | |
| 消化器 | 口渇 | 悪心、口唇乾燥 | |
| 適用部位 | 接触皮膚炎、湿疹 | 皮膚炎、紅斑、色素沈着、皮脂欠乏性湿疹 | そう痒感 |
| その他 | 代償性発汗、鼻乾燥、ALT増加、めまい、血圧上昇、倦怠感、湿疹、鉄欠乏性貧血、皮膚乾燥 | 無汗症、ほてり |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 使用直前に開封すること。
14.1.2 本剤は1回使い切りである。使用後は患者及び他者が触れないところに廃棄すること。
14.1.3 本剤を扱った後は、その手で眼に触れず、直ちに手をよく洗うこと。
14.1.4 本剤の薬液が眼に入った場合、羞明、霧視等の眼の調節障害があらわれることがある。また、刺激を感じることがあるので、眼に入らないよう注意すること。万一、眼に入った場合は、直ちに水で洗い流すこと。
14.2 薬剤使用時の注意
14.2.1 清潔で乾いた状態の腋窩に使用すること。
14.2.2 左右の腋窩に1回ずつ塗布すること。
14.2.3 密封法は行わないこと。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
成人の原発性腋窩多汗症患者11例を対象に、本剤と同一有効成分を3.75%注)含有するワイプ製剤1枚を用いて左右の腋窩に単回塗布し、24時間後まで経時的に血漿中グリコピロニウム濃度を測定したところ、2.55時間後に最高血漿中濃度に達し、0.139ng/mLであった1)(外国人データ)。
16.1.2 反復投与
原発性腋窩多汗症患者を対象に、本剤を1日1回(夜就寝前又は朝起床後)左右の腋窩に最大52週間反復塗布したときの血漿中グリコピロニウム濃度は次のとおりであった2)。
| 例数a)(n/N) | 中央値(pg/mL) | 最小値−最大値(pg/mL) | |
| ベースラインb) | 30/182 | 24.45 | 10.2-201.0 |
| 2週後 | 54/182 | 18.15 | 10.1-170.0 |
| 4週後 | 52/180 | 19.95 | 10.5-154.0 |
| 12週後 | 53/179 | 23.60 | 10.1-1510.0 |
| 28週後 | 49/167 | 20.10 | 10.2-197.0 |
| 52週後 | 40/149 | 21.15 | 10.0-585.0 |
16.3 分布
[14C]グリコピロニウムトシル酸塩水和物をグリコピロニウムとして10〜1000ng/mLの濃度でヒト血漿に添加したときの血漿蛋白結合率は55.7%〜57.8%であり、主にα1-酸性糖蛋白と結合した3)(in vitro)。
16.4 代謝
グリコピロニウムの主要な代謝経路はシクロペンタン環又はベンゼン環の酸化であり4)、この酸化的代謝にはCYP2D6及びCYP3A4の関与が示唆された5)。また、エステル結合の加水分解により生じるカルボン酸化合物を認めた4)(in vitro)。
原発性腋窩多汗症患者に本剤を1日1回左右の腋窩に4週間反復塗布したとき、血漿中にはカルボン酸化合物を、尿中にはカルボン酸化合物のほか、ベンゼン環又はシクロペンタン環の水酸化体を代謝物として認めた6)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II/III相試験
HDSS注)が3又は4かつ左右の腋窩共に5分間の発汗重量が50mg以上である9歳以上の原発性腋窩多汗症患者333例(14〜71歳)を対象に、本剤又はプラセボを1日1回(夜就寝前)左右の腋窩に4週間塗布する無作為化二重盲検並行群間比較試験9)を実施した。投与4週後のHDSSがベースラインから2段階以上改善かつ両腋窩の平均発汗重量が50%以上改善した被験者の割合は、次のとおりであった。
本剤群での副作用発現頻度は、15.5%(26/168例)であった。主な副作用は散瞳3.6%(6/168例)、排尿困難3.0%(5/168例)及び羞明2.4%(4/168例)であった。
本剤群での副作用発現頻度は、15.5%(26/168例)であった。主な副作用は散瞳3.6%(6/168例)、排尿困難3.0%(5/168例)及び羞明2.4%(4/168例)であった。
| 有効性評価項目 | 投与群 | 被験者の割合(例数) | プラセボ群との群間差a) | |
| 群間差 [両側95%信頼区間] | P値 | |||
| HDSSがベースラインから2段階以上改善かつ両腋窩の平均発汗重量がベースラインから50%以上改善した割合 | 本剤群 | 41.1%(69/168) | 24.7% [14.0%〜34.8%] | <0.0001 |
| プラセボ群 | 16.4%(27/165) | − | − | |
17.1.2 国内第III相長期投与試験
HDSSが2以上かつ左右の腋窩共に5分間の発汗重量が30mg以上の原発性腋窩多汗症患者183例(15〜65歳)を対象に、本剤を1日1回(夜就寝前又は朝起床後)左右の腋窩に最大52週間塗布する長期投与試験2)を実施した。HDSSがベースラインから2段階以上改善した被験者の割合は、52週時点で64.3%(83/129例)であった。両腋窩の平均発汗重量がベースラインから50%以上改善した被験者の割合は、52週時点で85.3%(110/129例)であった。
副作用発現頻度は20.8%(38/183例)であった。主な副作用は羞明、口渇が各3.8%(7/183例)、散瞳、霧視、接触皮膚炎が各2.7%(5/183例)、排尿困難が2.2%(4/183例)であった。
副作用発現頻度は20.8%(38/183例)であった。主な副作用は羞明、口渇が各3.8%(7/183例)、散瞳、霧視、接触皮膚炎が各2.7%(5/183例)、排尿困難が2.2%(4/183例)であった。
注)Hyperhidrosis disease severity scale(多汗症重症度判定指標)
18. 薬効薬理
18.1 作用機序
グリコピロニウムは、汗腺細胞のムスカリンM3受容体に結合し、アセチルコリンの作用を阻害することで制汗作用を発揮する10)。
18.2 発汗抑制作用
グリコピロニウムトシル酸水和物は、ピロカルピン誘発による発汗反応を用量依存的に抑制した11)(マウス)。
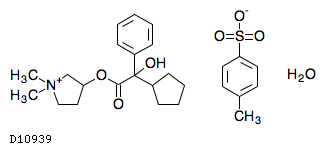
19. 有効成分に関する理化学的知見
19.1. グリコピロニウムトシル酸塩水和物
20. 取扱い上の注意
子供の手のとどかない所に保管すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
アルミパウチ
1包×28
23. 主要文献
- 社内資料:原発性腋窩多汗症患者を対象とした第I相試験(海外臨床薬理試験)(2022年1月20日承認、CTD2.7.6.2)
- 社内資料:原発性腋窩多汗症患者を対象とした第III相試験(長期投与試験)(2022年1月20日承認、CTD2.7.6.8)
- 社内資料:血漿蛋白結合(2022年1月20日承認、CTD2.6.4.4.3)
- 社内資料:In vitro代謝(2022年1月20日承認、CTD2.6.4.5.2)
- グリコピロニウム代謝に関与するCYP分子種の同定(2022年1月20日承認、CTD2.6.4.5.3)
- 社内資料:In vivo代謝(ヒト)(2022年1月20日承認、CTD2.7.2.2.1.3)
- 社内資料:尿及び糞中排泄(2022年1月20日承認、CTD2.6.4.6.1)
- 社内資料:In vivo代謝(ラット、ミニブタ)(2022年1月20日承認、CTD2.6.4.5.1.1)
- 社内資料:原発性腋窩多汗症患者を対象とした第II/III相試験(プラセボ対照試験)(2022年1月20日承認、CTD2.7.6.5)
- 社内資料:ムスカリン受容体に対する親和性(2022年1月20日承認、CTD2.6.2.2.1)
- 社内資料:マウス足蹠における発汗反応に対する作用(2022年1月20日承認、CTD2.6.2.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
マルホ株式会社
製品情報センター
〒531-0071
大阪市北区中津1-11-1
電話:0120-12-2834
製品情報問い合わせ先
マルホ株式会社
製品情報センター
〒531-0071
大阪市北区中津1-11-1
電話:0120-12-2834
25. 保険給付上の注意
25.1 本製剤の効能・効果は「原発性腋窩多汗症」であることから、原発性腋窩多汗症の確定診断が行われた場合にのみ投与すること。
また、本製剤の投与開始に当たっては、多汗症疾患重症度評価尺度(HDSS)を診療報酬明細書の摘要欄に記載すること。
また、本製剤の投与開始に当たっては、多汗症疾患重症度評価尺度(HDSS)を診療報酬明細書の摘要欄に記載すること。
26. 製造販売業者等
26.1 製造販売
マルホ株式会社
大阪市北区中津1-5-22