医薬品情報
| 総称名 | ボルテゾミブ |
|---|---|
| 一般名 | ボルテゾミブ |
| 欧文一般名 | Bortezomib |
| 製剤名 | 注射用ボルテゾミブ |
| 薬効分類名 | 抗悪性腫瘍剤(プロテアソーム阻害剤) |
| 薬効分類番号 | 4291 |
| ATCコード | L01XG01 |
| KEGG DRUG |
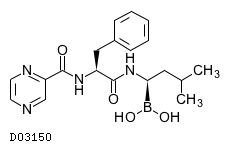
D03150
ボルテゾミブ
|
| KEGG DGROUP |
DG03219
ボルテゾミブ
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年4月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ボルテゾミブ注射用3mg「ヤクルト」 (後発品) | Bortezomib for Injection 3mg「Yakult」 | 高田製薬 | 4291412D1083 | 24869円/瓶 | 毒薬, 処方箋医薬品* |
1. 警告
1.1 本剤の投与は、緊急時に十分対応できる医療施設において、造血器悪性腫瘍の治療に対して十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例のみに行うこと。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分に説明し、同意を得てから投与を開始すること。
1.2 治療初期は入院環境で医師の管理下にて適切な処置を行うこと。
1.3 国内の臨床試験において、本剤との因果関係の否定できない肺障害(間質性肺炎)による死亡例が認められている。海外ではまれであるが、国内では本剤との因果関係の否定できない肺障害(間質性肺炎、肺水腫、急性呼吸窮迫症候群、胸水等)がより高頻度に発生する可能性があるため、特に以下の事項に十分注意すること。[8.1、9.1.1、11.1.1参照]
1.3.1 本剤による治療を開始するにあたり、胸部X線検査、胸部CT検査等を実施し、異常の有無を確認した上で、治療開始の可否を慎重に判断すること。
1.3.2 本剤による治療中及び治療後、特に治療開始後早期は、息切れ、呼吸困難、咳、発熱等の自覚症状や、胸部聴診所見、呼吸数等での異常の有無を慎重に観察すること。必要に応じて動脈血酸素飽和度や胸部CT検査等を適切に実施し、経過を観察すること。本剤による肺障害が疑われた場合には、投与中止も含め適切な処置を行うこと。
2. 禁忌
次の患者には投与しないこと
ボルテゾミブ、マンニトール又はホウ素に対して過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
6. 用法及び用量
<多発性骨髄腫>
通常、成人に1日1回、ボルテゾミブとして1.3mg/m2(体表面積)を以下のA法又はB法で静脈内投与又は皮下投与する。本剤は最低72時間空けて投与すること。
A法
他の抗悪性腫瘍剤との併用において、週2回、2週間(1、4、8、11日目)投与した後、10日間休薬(12〜21日目)する。この3週間を1サイクルとし、2又は8サイクルまで投与を繰り返す。3又は9サイクル以降は、週1回、2週間(1、8日目)投与し、13日間休薬(9〜21日目)する。この3週間を1サイクルとし、18サイクルまで投与を繰り返す。週1回投与への移行時期は併用する抗悪性腫瘍剤を考慮して選択すること。
B法(再発又は難治性の場合に限る)
週2回、2週間(1、4、8、11日目)投与した後、10日間休薬(12〜21日目)する。この3週間を1サイクルとし、投与を繰り返す。
8サイクルを超えて継続投与する場合には上記の用法・用量で投与を継続するか、又は維持療法として週1回、4週間(1、8、15、22日目)投与した後、13日間休薬(23〜35日目)する。この5週間を1サイクルとし、投与を繰り返す。
8サイクルを超えて継続投与する場合には上記の用法・用量で投与を継続するか、又は維持療法として週1回、4週間(1、8、15、22日目)投与した後、13日間休薬(23〜35日目)する。この5週間を1サイクルとし、投与を繰り返す。
<原発性マクログロブリン血症及びリンパ形質細胞リンパ腫>
通常、成人に1日1回、ボルテゾミブとして1.3mg/m2(体表面積)を1、4、8、11日目に静脈内投与又は皮下投与した後、10日間休薬(12〜21日目)する。この3週間を1サイクルとし、投与を繰り返す。本剤は最低72時間空けて投与すること。
7. 用法及び用量に関連する注意
<効能共通>
7.1 本剤の投与については、以下の記載に従って、適切に減量、休薬又は投与中止の判断を行うこと。
・Grade 3/4※の副作用の場合(末梢性ニューロパチー又は神経障害性疼痛を除く)
Grade 3以上の非血液毒性(末梢性ニューロパチー・神経障害性疼痛を除く)又はGrade 4の血液毒性に該当する副作用が発現した場合は、回復するまで休薬する。投与を再開する場合には、本剤の投与による有益性と危険性を慎重に検討した上で、下表を目安として減量等を考慮する。副作用が回復しない場合又は最低投与量(0.7mg/m2)でも再発する場合は、本剤の投与中止を考慮する。[8.6参照]
| 副作用発現時の投与量 | 減量の目安 |
| 1.3mg/m2 | 1.0mg/m2 |
| 1.0mg/m2 | 0.7mg/m2 |
| 0.7mg/m2 | 投与中止 |
・末梢性ニューロパチー又は神経障害性疼痛について
本剤に起因すると考えられる末梢性ニューロパチー又は神経障害性疼痛が発現した場合は、以下に示す用法及び用量変更の目安に従って減量、休薬又は中止すること。[8.4、11.1.3参照]
| NCI-CTCAE Grade※(症状) | 用法及び用量変更の目安 |
| 疼痛又は機能消失を伴わないGrade 1 (症状がない;深部腱反射の低下又は知覚異常) | なし |
| 疼痛を伴うGrade 1又はGrade 2 (中等度の症状がある;身の回り以外の日常生活動作の制限) | 1.3mg/m2の場合1.0mg/m2へ減量又は1.0mg/m2の場合0.7mg/m2へ減量 |
| 疼痛を伴うGrade 2又はGrade 3 (高度の症状がある;身の回りの日常生活動作の制限) | 回復するまで休薬。症状が回復した場合は、0.7mg/m2に減量した上で週1回投与に変更 |
| Grade 4(生命を脅かす;緊急処置を要する) | 投与中止 |
<多発性骨髄腫>
8. 重要な基本的注意
<効能共通>
8.1 肺障害があらわれることがあるので、息切れ、呼吸困難、胸水、咳、及び発熱等の自覚症状や、胸部聴診所見、呼吸数等での異常の有無を慎重に観察すること。また、必要に応じて動脈血酸素飽和度や胸部CT等の検査を適切に実施し、慎重に経過を観察すること。肺障害の危険因子は現時点では明確でないため、肺障害の既往歴のない患者においても、慎重な経過観察を行う必要がある。[1.3.1、1.3.2、9.1.1、11.1.1参照]
8.2 心障害による死亡例、うっ血性心不全の急性発現又は増悪、心嚢液貯留、左室駆出率低下が報告されているため、心障害の既往や症状の危険因子がある場合には、患者の状態には十分に注意すること。[11.1.2参照]
8.3 本剤の投与によりB型肝炎ウイルスの再活性化による肝炎があらわれることがあるので、本剤投与に先立って肝炎ウイルス感染の有無を確認し、本剤投与前に適切な処置を行うこと。[9.1.2、11.1.7参照]
8.4 末梢神経障害があらわれることがあるので、灼熱感、知覚過敏、感覚減退、錯感覚、不快感、神経障害性疼痛等のニューロパチーの症状について観察すること。また、末梢性ニューロパチーが発現する可能性のある薬剤を併用する場合には注意すること。[7.1、9.1.3、11.1.3参照]
8.5 国内臨床試験では重度の発熱性好中球減少症、好中球減少症(好中球数減少)及び貧血(ヘモグロビン減少)が認められているため、頻回に臨床検査(血液検査等)を行うなど、患者の状態を十分に観察すること。[11.1.5参照]
8.6 本剤は血小板減少症を引き起こすことが認められている。本剤の投与前に毎回血小板数を確認すること。本剤投与により発現した血小板減少に伴う胃腸出血及び脳出血の報告例があるので、必要に応じ輸血を考慮すること。[7.1、11.1.5参照]
8.7 本剤の投与により悪心、下痢、便秘及び嘔吐の発現が認められており、制吐剤又は止痢剤による処置を要することがある。脱水症状を予防するため、必要に応じ補液及び電解質補充を行うこと。本剤の投与期間中は嘔吐又は下痢がみられるため、患者には脱水症状を避ける適切な対処方法を指導すること。浮動性めまい、頭部ふらふら感又は失神発作があらわれた場合には、医師の診察を受けるよう患者を指導すること。
また、イレウスが報告されているため、便秘を認めた患者は慎重に観察すること。[11.1.6参照]
また、イレウスが報告されているため、便秘を認めた患者は慎重に観察すること。[11.1.6参照]
8.8 肝機能障害があらわれることがあるので、定期的に肝機能検査を行うこと。[11.1.7参照]
8.10 疲労、浮動性めまい、失神、起立性低血圧、霧視が起こることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作に従事させないよう注意すること。
8.11 腫瘍量の急激な減少に伴い、腫瘍崩壊症候群(tumor lysis syndrome)があらわれることがあるため、予防措置として、高尿酸血症治療剤の投与及び適切な水分補給等を考慮すること。急激に腫瘍量が減少した患者においては血清中電解質濃度及び腎機能検査を行うなど、患者の状態を十分に観察すること。[11.1.9参照]
<原発性マクログロブリン血症及びリンパ形質細胞リンパ腫>
8.12 本剤を使用する際には、関連文献(「医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書」等)1)を熟読すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 間質性肺炎、肺線維症等の肺障害の既往歴のある患者
9.1.2 B型肝炎ウイルスキャリアの患者又はHBs抗原陰性でHBc抗体陽性若しくはHBs抗体陽性の患者
9.1.3 末梢性ニューロパチーの症状(足又は手のしびれ、疼痛又は灼熱感)や徴候のある患者
9.1.4 失神の既往や症状がある患者、低血圧が発現する可能性のある薬剤を投与中の患者及び脱水状態にある患者
9.1.5 経口血糖降下剤を併用した糖尿病患者
血糖値を注意深く観察し、経口血糖降下剤の用量に留意して慎重に投与すること。海外臨床試験において、低血糖及び高血糖が報告されている。
9.3 肝機能障害患者
本剤のクリアランスが低下し、副作用が強くあらわれるおそれがある。[16.6.1参照]
9.4 生殖能を有する者
妊娠可能年齢にある女性においては本剤投与中及び投与終了後一定期間は避妊するよう指導すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、原則として投与しないこと。動物実験では、妊娠ウサギの器官形成期にボルテゾミブを0.05mg/kg(0.6mg/m2)投与したところ、有意な着床後死亡の増加とそれに伴う生存胎児数の減少が認められた。これらの生存胎児は有意な体重の減少も示した。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。海外臨床試験において、65歳以上と65歳未満の患者で安全性及び有効性に差は認められなかったが、高齢者では一般に生理機能が低下している。
なお、年齢別でのGrade 3以上の有害事象の発現頻度は、再発又は難治性の多発性骨髄腫を対象とした海外第III相試験(039試験)の本剤群においては50歳以下で64%(27/42例)、51〜64歳で78%(128/165例)、65歳以上で75%(93/124例)であった。また、海外第II相試験(024試験及び025試験)においては50歳以下で74%(29/39例)、51〜65歳で80%(104/130例)、66歳以上で85%(74/87例)であった。
なお、年齢別でのGrade 3以上の有害事象の発現頻度は、再発又は難治性の多発性骨髄腫を対象とした海外第III相試験(039試験)の本剤群においては50歳以下で64%(27/42例)、51〜64歳で78%(128/165例)、65歳以上で75%(93/124例)であった。また、海外第II相試験(024試験及び025試験)においては50歳以下で74%(29/39例)、51〜65歳で80%(104/130例)、66歳以上で85%(74/87例)であった。
10. 相互作用
相互作用序文
ヒト肝ミクロソームを用いたin vitro試験より、ボルテゾミブがチトクロームP450 3A4、2C19及び1A2の基質であることが示されている。本剤とCYP3A4の基質、阻害剤又は誘導剤を併用している患者においては、副作用又は効果の減弱について注意深く観察すること。
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2C19
薬物代謝酵素用語
CYP1A2
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肺障害
間質性肺炎(0.2%、2.5%注1))、急性肺水腫(0.5%、0.4%注1))、胸水(0.1%、1.6%注1))、急性呼吸窮迫症候群(0.1%、頻度不明注1))があらわれることがある。国内の臨床試験及び市販後の報告において、本剤との因果関係の否定できない肺障害(間質性肺炎)による死亡例が認められており4)、海外と比較して肺障害の発生頻度が高い可能性がある。なお、肺障害の対処方法及び可能性のあるリスク因子について臨床試験では確認されていない。急性骨髄性白血病に対し、本剤、ダウノルビシン塩酸塩及び高用量シタラビンの24時間持続点滴(2000mg/m2/日)を併用した海外の臨床試験において、本剤との因果関係を否定できない急性呼吸窮迫症候群による死亡が報告されている。[1.3.1、1.3.2、8.1、9.1.1参照]
11.1.2 心障害
うっ血性心不全(1.3%)、心嚢液貯留(0.1%)、心原性ショック(0.1%)、心停止(0.1%)、心肺停止(頻度不明)があらわれることがある。また、投与前の左室駆出率に異常の無い患者においても左室駆出率低下が報告されている。海外臨床試験においてQT間隔延長の報告があるが、薬剤との関連性については明らかになっていない。再発又は難治性の多発性骨髄腫を対象とした海外第III相試験において、本剤群及びデキサメタゾン群で発現した心障害の発現頻度はそれぞれ14%及び12%であった。そのうち心不全等(急性肺水腫、心不全、うっ血性心不全、心原性ショック、肺水腫)の発現頻度はそれぞれ5%及び4%であった。[8.2参照]
11.1.3 末梢神経障害
末梢性感覚ニューロパチー(28.2%)、神経障害性疼痛(14.8%)、錯感覚(8.6%)、末梢性ニューロパチー(8.1%)、感覚減退(3.6%)、末梢性運動ニューロパチー(2.3%)、灼熱感(0.4%)があらわれることがあり、重症の感覚性ニューロパチーも報告されている。本剤の投与により、感覚障害による末梢性ニューロパチーが主に認められるが、感覚障害と運動障害が混在するニューロパチーの発現例も報告されている。末梢性ニューロパチーに加えて、起立性低血圧やイレウスを伴う重度の便秘等、一部の有害事象に自律神経ニューロパチーが関与している可能性があるが、十分な情報は得られていない。また、本剤の投与により糖尿病性ニューロパチー等の基礎疾患を悪化させる可能性がある。再発又は難治性の多発性骨髄腫を対象とした海外第III相試験においてGrade 2以上の末梢性ニューロパチーを認めた患者では用量調整により末梢性ニューロパチーの改善あるいは回復が51%で認められた。また、海外第II相試験においてGrade 3以上の末梢性ニューロパチーを発現した患者又はGrade 2のニューロパチーを呈し、投与を中止した患者では、末梢性ニューロパチーの改善あるいは回復が73%で認められた。[7.1、8.4、9.1.3参照]
11.1.4 ギラン・バレー症候群、脱髄性多発ニューロパチー(頻度不明)
11.1.5 骨髄抑制
血小板減少(39.0%)、好中球減少(34.8%)、貧血(21.9%)、白血球減少(17.9%)、リンパ球減少(10.9%)、発熱性好中球減少症(2.8%)、汎血球減少(0.1%)があらわれることがある。骨髄機能が抑制された結果、感染症(敗血症性ショック等)や出血等の重篤な副作用が発現することがある。再発又は難治性の多発性骨髄腫を対象とした海外第III相試験における重症の出血(Grade 3以上)の発現率は本剤群で4%、デキサメタゾン群で5%であった。血小板数は各サイクルの11日目に最低値に達し、通常は次サイクル開始前までに回復した。血小板数の減少と回復のパターンは週2回投与の8サイクルにわたり一貫しており、蓄積性の血小板減少症は認められなかった。再発又は難治性の多発性骨髄腫を対象とした海外第III相試験において血小板数の最低値の平均は、投与開始前の約40%であった。再発又は難治性の多発性骨髄腫を対象とした海外第III相試験における投与開始前の血小板数と血小板減少症の重症度との関係を以下の表に示す。[8.5、8.6参照]
| 投与開始前の血小板数注2) | 患者数(n=331)注3) | 10,000/μL未満の患者数(%) | 10,000〜25,000/μLの患者数(%) |
| 75,000/μL以上 | 309 | 8(3%) | 36(12%) |
| 50,000/μL以上75,000/μL未満 | 14 | 2(14%) | 11(79%) |
| 10,000/μL以上50,000/μL未満 | 7 | 1(14%) | 5(71%) |
11.1.6 イレウス(0.7%)
食欲不振、嘔吐、便秘、腹部膨満感等の症状があらわれた場合には適切な処置を行うこと。[8.7参照]
11.1.7 肝機能障害
11.1.8 低血圧
11.1.9 腫瘍崩壊症候群(0.3%)[8.11参照]
11.1.10 皮膚粘膜眼症候群(Stevens-Johnson症候群)、中毒性表皮壊死症(Toxic Epidermal Necrolysis:TEN)(頻度不明)
11.1.11 発熱(12.4%)
本剤の投与日から翌日にかけて高頻度にGrade 1〜2の薬剤性の発熱があらわれることがあるので、患者の状態を観察し、必要に応じて解熱剤等による処置を考慮すること。また発熱が持続する場合や呼吸器症状を伴う場合には、肺障害の可能性について注意すること。
11.1.12 可逆性後白質脳症症候群(頻度不明)
痙攣、血圧上昇、頭痛、意識障害、錯乱、視覚障害等があらわれることがある。
11.1.13 進行性多巣性白質脳症(頻度不明)
本剤の治療期間中及び治療終了後は患者の状態を十分に観察し、意識障害、認知障害、麻痺症状(片麻痺、四肢麻痺)、言語障害等の症状があらわれた場合は、MRIによる画像診断及び脳脊髄液検査を行うとともに、投与を中止し、適切な処置を行うこと。
注1)日本人における発現率(多発性骨髄腫を対象とした静脈内投与における国内臨床試験、特定使用成績調査及び使用成績調査、並びにマントル細胞リンパ腫、多発性骨髄腫及び全身性ALアミロイドーシスを対象とした国際共同試験(日本人症例のみ)の集計)
11.2 その他の副作用
| 10%以上 | 10%未満5%以上 | 5%未満 | 頻度不明 | |
| 感染症 | 感染 | 帯状疱疹、肺炎 | 単純ヘルペス、鼻咽頭炎、敗血症、口腔カンジダ症、麦粒腫、感染性腸炎、膀胱炎、中耳炎、蜂巣炎、毛包炎 | 気管支肺炎、白癬感染、外耳炎 |
| 血液 | 出血、白血球数増加、好中球数増加、単球数増加 | |||
| 免疫系障害 | 過敏症 | |||
| 代謝・栄養 | 食欲不振 | 体重減少、脱水、高血糖、高尿酸血症、低アルブミン血症、低血糖症、高アミラーゼ血症 | 高コレステロール血症 | |
| 電解質 | 低カリウム血症、低ナトリウム血症、高カリウム血症、高カルシウム血症 | 高ナトリウム血症 | ||
| 精神神経系 | 頭痛、不眠症 | 浮動性めまい、うつ病、失神、味覚異常、嗜眠、神経痛、不安、痙攣、傾眠、体位性めまい | 嗅覚錯誤 | |
| 眼 | 霧視、結膜炎、眼瞼炎、眼部腫脹、ドライアイ、霰粒腫 | 角膜びらん、眼瞼出血、後天性涙腺炎、視力障害 | ||
| 循環器 | 高血圧、心房細動、動悸、頻脈、期外収縮、不整脈、心房粗動、徐脈 | 心電図QT延長 | ||
| 呼吸器 | 呼吸困難、咳嗽、鼻出血、咽喉頭疼痛、鼻漏、肺高血圧症 | 喀血、上気道の炎症、咽頭不快感、無気肺、胸膜炎、気胸 | ||
| 消化器 | 下痢、悪心、便秘、嘔吐 | 腹痛 | 消化不良、口内炎、腹部膨満、胃炎、鼓腸、胃腸出血、歯肉炎、嚥下障害、胃食道逆流、腸炎、過敏性腸症候群、歯周炎、レッチング、舌潰瘍、おくび、齲歯 | 口唇炎、耳下腺腫大 |
| 肝臓 | 肝機能異常 | 肝障害 | ||
| 皮膚 | 発疹 | そう痒症、脱毛症、紅斑、多汗症、蕁麻疹、点状出血、顔面腫脹、紫斑、多形紅斑、薬疹、紅色汗疹、皮膚出血 | 好中球浸潤・有痛性紅斑・発熱を伴う皮膚障害(Sweet症候群)、丘疹、水疱性皮膚炎 | |
| 筋骨格 | 筋骨格痛 | 筋痙縮、筋痛、筋力低下、骨痛、筋骨格硬直、関節炎 | ||
| 腎臓・泌尿器 | 腎機能障害、排尿障害(尿閉、神経因性膀胱等)、尿中血陽性 | 蛋白尿、β2ミクログロブリン増加、尿沈渣異常 | ||
| 全身 | 疲労、無力症 | 浮腫 | 悪寒、疼痛、倦怠感、口渇、胸痛、顔面浮腫 | |
| その他 | 注射部位反応、静脈炎、潮紅、血中クレアチニン増加、総蛋白減少、ほてり、PO2低下、末梢冷感、血中重炭酸塩減少、血中尿酸減少 | LDH増加、CRP増加、腫瘍熱、PO2上昇、血中クレアチニン減少、総蛋白増加、血中重炭酸塩増加 |
13. 過量投与
13.1 徴候、症状
推奨用量の2倍を超えた過量投与により、致命的な転帰を伴う急性の症候性低血圧及び血小板減少症が報告されている。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 静脈内投与
1バイアルを日局生理食塩液3.0mLで溶解して使用すること。
14.1.2 皮下投与
1バイアルを日局生理食塩液1.2mLで溶解して使用すること。
| 投与経路 | ボルテゾミブ(mg/バイアル) | 日局生理食塩液 | ボルテゾミブ最終濃度 |
| 静脈内投与 | 3.0mg | 3.0mL | 1.0mg/mL |
| 皮下投与 | 3.0mg | 1.2mL | 2.5mg/mL |
14.1.3 本剤の取り扱い及び調製にあたっては、手袋を使用するなど慎重に行うこと。本剤が皮膚又は粘膜に触れた場合には、直ちに石鹸でよく洗うこと。
14.2 薬剤投与時の注意
本剤のバイアルは1回使い切りである。溶解後は8時間以内に使用すること。バイアル中の未使用残液は適切に廃棄すること。
14.2.1 静脈内投与
他の薬剤の混入を避けるため、本剤投与のためのルートを留置して実施すること。他の薬剤が投与されているルートを用いての投与は行わないこと。また、延長チューブを使用した際は、投与後速やかに日局生理食塩液でフラッシングを行うこと。
14.2.2 皮下投与
繰り返し皮下投与する場合には、左右の大腿部、腹部等に交互に投与するなど同一注射部位を避けること。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 動物(サル及びイヌ)を用いた試験において、ボルテゾミブを体表面積換算で臨床推奨用量の約2〜3倍量を静脈内投与することにより、心拍数増加、心筋収縮力減弱及び低血圧が認められ、死に至った。この心筋収縮力減弱及び低血圧の状態においても、陽性変力作用を示す薬剤あるいは昇圧剤投与に対する反応は認められた。イヌの試験において、致死用量ではQTc間隔の軽度な延長が認められた5)。
15.2.2 動物実験(ラット)において、0.20及び0.15mg/kg(1.20及び0.90mg/m2)群で精巣−精上皮の変性/萎縮及び低用量から卵巣黄体の単細胞壊死が認められた6)。
15.2.3 チャイニーズハムスター卵巣細胞を用いたin vitro染色体異常試験で、評価を行った最低用量である3.125μg/mL以上で染色体異常誘発性(構造的染色体異常)を示した7)。
16. 薬物動態
16.1 血中濃度
16.1.1 単独投与
再発又は難治性の多発性骨髄腫患者に、ボルテゾミブ0.7、1.0又は1.3mg/m2(各n=3、6又は5〜7)を単独で、1日1回、週2回、2週間(1、4、8、11日目)静脈内投与したときの1日目及び11日目における血漿中ボルテゾミブ濃度を検討した。
各用量群の血漿中濃度推移は類似しており、速やかな分布相とそれに続く緩やかな長い消失相を特徴とする二相性の低下を示した。また、最終消失相における分布容積(Vz)より、ボルテゾミブの組織移行性が良好であることが示唆された。投与日間での比較の結果、1日目と比較し、11日目において、消失半減期(t1/2)の延長、全身クリアランス(CL)の低下が各用量群で見られた。このことに伴い、投与終了時の血漿中濃度(C0)並びに血漿中濃度−時間曲線下面積(AUC)も1日目より11日目で高値を示した。一方、用量間での比較の結果、C0に用量相関性は認められなかったが、AUCに関しては各試験日において、個体間でのばらつきは大きいが、用量相関性が認められた8)9)。
各用量群の血漿中濃度推移は類似しており、速やかな分布相とそれに続く緩やかな長い消失相を特徴とする二相性の低下を示した。また、最終消失相における分布容積(Vz)より、ボルテゾミブの組織移行性が良好であることが示唆された。投与日間での比較の結果、1日目と比較し、11日目において、消失半減期(t1/2)の延長、全身クリアランス(CL)の低下が各用量群で見られた。このことに伴い、投与終了時の血漿中濃度(C0)並びに血漿中濃度−時間曲線下面積(AUC)も1日目より11日目で高値を示した。一方、用量間での比較の結果、C0に用量相関性は認められなかったが、AUCに関しては各試験日において、個体間でのばらつきは大きいが、用量相関性が認められた8)9)。
| 薬物動態パラメータ | 試験日 | 0.7mg/m2(n=3) | 1.0mg/m2(n=6) | 1.3mg/m2(n=5〜7)注) | |||
| 平均値 | SD | 平均値 | SD | 平均値 | SD | ||
| C0(ng/mL) | 1 | 73.75 | 7.89 | 144.92 | 179.31 | 185.84 | 57.65 |
| 11 | 130.68 | 71.97 | 147.19 | 72.33 | 187.03 | 54.31 | |
| AUC(ng・hr/mL) | 1 | 14.04 | 0.70 | 28.58 | 24.86 | 46.50 | 19.89 |
| 11 | 112.01 | 47.74 | 108.39 | 52.32 | 186.60 | 49.79 | |
| t1/2(hr) | 1 | 3.31 | 0.88 | 6.81 | 8.81 | 16.11 | 20.75 |
| 11 | 64.59 | 30.29 | 32.46 | 12.91 | 57.39 | 24.92 | |
| CL(L/hr) | 1 | 83.35 | 10.52 | 105.41 | 75.66 | 51.97 | 18.99 |
| 11 | 11.77 | 4.67 | 19.63 | 14.50 | 12.10 | 3.73 | |
| Vz(L) | 1 | 406.92 | 154.03 | 520.08 | 349.87 | 894.41 | 682.35 |
| 11 | 978.51 | 263.13 | 731.69 | 242.35 | 957.81 | 350.40 | |
16.1.2 単独又は併用投与
造血幹細胞移植の適応とならない未治療の多発性骨髄腫患者に、ボルテゾミブ0.7、1.0又は1.3mg/m2(各n=6、5〜6又は3〜4)を単独又はメルファラン及びプレドニゾロン併用で静脈内投与したときの血漿中ボルテゾミブ濃度を検討した。その結果、血漿中ボルテゾミブの薬物動態はボルテゾミブ単独投与時とメルファラン及びプレドニゾロン併用で大きく異ならなかった10)。
| 薬物動態パラメータ | 投与法 | 0.7mg/m2(n=6) | 1.0mg/m2(n=5〜6)注1) | 1.3mg/m2(n=3〜4)注2) | |||
| 平均値 | SD | 平均値 | SD | 平均値 | SD | ||
| C0.08h(ng/mL) | 単独 | 45.4 | 10.1 | 59.4 | 18.9 | 120 | 24.5 |
| 併用 | 34.4 | 5.8 | 69.5 | 19.5 | 88.9 | 19.6 | |
| AUClast(ng・hr/mL) | 単独 | 28.8 | 14.6 | 62.6 | 24.8 | 115 | 28.7 |
| 併用 | 26.7 | 12.9 | 82.8 | 13.8 | 75.6 | 20.4 | |
16.1.3 単独投与
前治療歴のある多発性骨髄腫患者に、ボルテゾミブ1.3mg/m2を単独で、1日1回、週2回、2週間(1、4、8、11日目)皮下投与(n=17)及び静脈内投与(n=14)したとき11日目における血漿中ボルテゾミブ濃度を検討した。その結果、ボルテゾミブ皮下投与時のCmaxは静脈内投与時の約1/10であったが、AUClastは両投与間で大きく異ならなかった11)。(外国人データ)
| 薬物動態パラメータ | 皮下投与(n=17) | 静脈内投与(n=14) | ||
| 平均値 | SD | 平均値 | SD | |
| Cmax(ng/mL) | 20.4 | 8.87 | 223 | 101 |
| tmax(hr)注) | 0.50 | (0.08〜1.00) | 0.03 | (0.03〜0.08) |
| AUClast(ng・hr/mL) | 155 | 56.8 | 151 | 42.9 |
16.2 吸収
16.2.1 血漿蛋白結合率
ヒトにおけるボルテゾミブの血漿蛋白結合率は78.9〜85.7%であった12)(in vitro、限外ろ過法、10〜1000ng/mL)。
16.4 代謝
ヒトにおけるボルテゾミブの主な代謝経路は脱ホウ素化であり、ヒト肝ミクロソームを用いたin vitro試験より、ボルテゾミブが主にチトクロームP450 3A4、2C19及び1A2の基質であることが示されている。チトクロームP450 2D6及び2C9の寄与は小さい。また、ヒト肝ミクロソームを用いたin vitro試験より、ボルテゾミブによるチトクロームP450 1A2、2C9、2D6及び3A4への阻害能は弱いが(IC50=>30μmol/L、>11.5μg/mL)、チトクロームP450 2C19に対する阻害能(IC50=18μmol/L、6.9μg/mL)が示されているため、本酵素の基質である薬剤の血中濃度を上昇させる可能性がある。初代培養ヒト肝細胞を用いたin vitro試験より、ボルテゾミブによるチトクロームP450 1A2及び3A4の明確な誘導能は認められなかった。
代謝物の活性の有無:脱ホウ素化された代謝物は活性を示さない13)14)。
代謝物の活性の有無:脱ホウ素化された代謝物は活性を示さない13)14)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害
16.8 その他
ボルテゾミブ注射用3mg「ヤクルト」は、ベルケイド注射用3mgと添加剤の種類及び含量(濃度)が同一となるよう処方設計を行ったものであり、pH、粘度、浸透圧、ボルテゾミブの複合体比率などの製剤学的な評価項目を比較した結果、両剤の同等性が確認された16)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<多発性骨髄腫>
17.1.1 海外第III相比較試験(039試験)
再発又は難治性の多発性骨髄腫に対する海外第III相比較試験(039試験)における成績概要は以下のとおりであった。
1〜3回の前治療歴を有する患者を対象とする無作為化非盲検群間比較試験のボルテゾミブ群では1.3mg/m2を静脈内投与した。腫瘍増殖抑制期間(TTP)は、デキサメタゾン群の3.5ヵ月(中央値)に対して、ボルテゾミブ群で6.2ヵ月(中央値)であった。生存期間のハザード比は、0.57(95%信頼区間0.40,0.81;p<0.05)であった。なお、生存期間中央値は、全患者のボルテゾミブ群で16.6ヵ月であった以外は、追跡期間が短くすべて評価不能であった17)。
| 全患者 | 前治療回数1回のみ | 前治療回数>1回 | ||||
| ボルテゾミブ | デキサメタゾン | ボルテゾミブ | デキサメタゾン | ボルテゾミブ | デキサメタゾン | |
| 評価項目 | n=333 | n=336 | n=132 | n=119 | n=200 | n=217 |
| TTP | ||||||
| イベント数(%) | 147(44) | 196(58) | 55(42) | 64(54) | 92(46) | 132(61) |
| 中央値(月) (95%信頼区間) | 6.2 (4.9,6.9) | 3.5 (2.9,4.2) | 7.0 (6.2,8.8) | 5.6 (3.4,6.3) | 4.9 (4.2,6.3) | 2.9 (2.8,3.5) |
| ハザード比 (95%信頼区間) | 0.55 (0.44,0.69) | 0.55 (0.38,0.81) | 0.54 (0.41,0.72) | |||
| p値注1) | <0.0001 | 0.0019 | <0.0001 | |||
| 生存期間 | ||||||
| 死亡患者数(%) | 51(15) | 84(25) | 12(9) | 24(20) | 39(20) | 60(28) |
| ハザード比 (95%信頼区間) | 0.57 (0.40,0.81) | 0.39 (0.19,0.81) | 0.65 (0.43,0.97) | |||
| p値注1) | <0.05 | <0.05 | <0.05 | |||
331例中324例(97.9%)に副作用が認められた。主な副作用[10%以上を記載]は、下痢[173例52.3%]、悪心[172例52.0%]、疲労[131例39.6%]、血小板減少[109例32.9%]、食欲不振[100例30.2%]、便秘[99例29.9%]、嘔吐[96例29.0%]、末梢性ニューロパチー[93例28.1%]、発熱[67例20.2%]、錯感覚[65例19.6%]、無力症[64例19.3%]、貧血[63例19.0%]、頭痛[62例18.7%]、発疹[61例18.4%]、筋骨格痛[61例18.4%]、好中球減少[59例17.8%]、腹痛[54例16.3%]、呼吸困難[42例12.7%]、感染[39例11.8%]、末梢性感覚ニューロパチー[38例11.5%]であった。[5.、7.3参照]
17.1.2 海外第III相試験(MMY3002試験)
造血幹細胞移植の適応とならない未治療の多発性骨髄腫に対する海外第III相試験(MMY3002試験)における成績概要は以下のとおりであった。
造血幹細胞移植の適応とならない未治療の多発性骨髄腫患者を対象とする無作為化非盲検群間比較試験において、メルファラン9mg/m2とprednisone※60mg/m2の併用療法(MP療法)とMP療法にボルテゾミブ注1)(静脈内投与)1.3mg/m2を上乗せしたMPB療法を比較した。腫瘍増殖抑制期間(TTP)は、MP群の15.0ヵ月(中央値)に対して、MPB群で20.7ヵ月(中央値)であった。生存期間は、MP群の43.1ヵ月(中央値)に対して、MPB群では未到達であった18)19)。
| MPB n=344 | MP n=338 | |
| TTP | ||
| イベント数(%) | 101(29) | 152(45) |
| 中央値(月)(95%信頼区間) | 20.7(17.6,24.7) | 15.0(14.1,17.9) |
| ハザード比(95%信頼区間) | 0.54(0.42,0.70) | |
| p値注2) | 0.000002 | |
| 生存期間 | ||
| 死亡患者数(%) | 109(32) | 148(44) |
| 中央値(月)(95%信頼区間) | NE(46.2,NE) | 43.1(34.8,NE) |
| ハザード比(95%信頼区間) | 0.65(0.51,0.84) | |
| p値注2) | 0.00084 | |
注1)1サイクルを21日間として、ボルテゾミブ1.3mg/m2を、第1〜8サイクルの第1、4、8及び11日目、第9〜18サイクルの第1及び8日目に静脈内投与。
注2)無作為化の層別因子により調整したLog-rank検定でのp値
340例中331例(97.4%)に副作用が認められた。主な副作用[10%以上を記載]は、血小板減少[164例48.2%]、好中球減少[163例47.9%]、末梢性感覚ニューロパチー[148例43.5%]、悪心[134例39.4%]、下痢[119例35.0%]、神経障害性疼痛[117例34.4%]、貧血[109例32.1%]、白血球減少[108例31.8%]、嘔吐[87例25.6%]、疲労[85例25.0%]、リンパ球減少[78例22.9%]、便秘[77例22.7%]、食欲不振[70例20.6%]、腹痛[63例18.5%]、感染[59例17.4%]、発熱[55例16.2%]、無力症[54例15.9%]、発疹[48例14.1%]、錯感覚[41例12.1%]、筋骨格痛[41例12.1%]、帯状疱疹[40例11.8%]、不眠症[35例10.3%]であった。[5.、7.3参照]
※:国内未承認
17.1.3 国際共同第III相試験(MMY3007試験)
造血幹細胞移植の適応とならない未治療の多発性骨髄腫に対する国際共同第III相試験(MMY3007試験)における成績概要は以下のとおりであった。
造血幹細胞移植の適応とならない未治療の多発性骨髄腫患者680例(日本人患者24例を含む)を対象とする無作為化非盲検群間比較試験において、ボルテゾミブ注1)1.3mg/m2(皮下又は静脈内投与)、メルファラン9mg/m2及びプレドニゾロン又はprednisone※60mg/m2の併用療法(MPB療法)とMPB療法にダラツムマブ(遺伝子組換え)16mg/kgを上乗せしたDMPB療法を比較した。主要評価項目である無増悪生存期間(PFS)は、DMPB群では未到達、MPB群で17.9ヵ月(中央値)(95%信頼区間:16.1〜19.8)であり、DMPB群で統計学的に有意な延長を示した[ハザード比:0.51、95%信頼区間:0.39〜0.67、p<0.0001注2)]20)。
注1)1サイクルを21日間として、ボルテゾミブ1.3mg/m2を、第1〜2サイクルの第1、4、8及び11日目、第3〜18サイクルの第1及び8日目に皮下又は静脈内投与。
注2)無作為化の層別因子により調整したLog-rank検定でのp値
※:国内未承認
333例(日本人11例を含む)中250例(75.1%)に副作用が認められた。主な副作用[10%以上を記載]は、血小板減少[115例34.5%]、好中球減少[104例31.2%]、末梢性感覚ニューロパチー[92例27.6%]、貧血[39例11.7%]であった。[5.、7.3参照]
17.1.4 海外第III相試験(MMY3021試験)
前治療歴のある多発性骨髄腫患者に対する海外第III相試験(MMY3021試験)における成績概要は以下のとおりであった。
1〜3回の前治療歴を有する患者を対象とする無作為化非盲検非劣性試験の皮下投与群及び静脈内投与群ではボルテゾミブ1.3mg/m2を投与した。主要評価項目であるサイクル4までの全奏効率(ORR)は、皮下投与群、静脈内投与群ともに42%であり、非劣性が検証された。副次評価項目である腫瘍増殖抑制期間(TTP)及び1年生存率は、静脈内投与群で9.4ヵ月(中央値)及び76.7%、皮下投与群で10.4ヵ月(中央値)及び72.6%であった11)。
| ボルテゾミブ静脈内投与 | ボルテゾミブ皮下投与 | |
| サイクル4までの全奏効率(ORR注1)) | ||
| 評価例数 | 73 | 145 |
| 全奏効例数 | 31 | 61 |
| ORR(%) | 42 | 42 |
| p値注2) | 0.00201 | |
| ORR比(95%信頼区間) | 0.99(0.71,1.37) | |
| TTP | ||
| 評価例数 | 74 | 148 |
| 中央値(月)(95%信頼区間) | 9.4(7.6,10.6) | 10.4(8.5,11.7) |
| ハザード比(95%信頼区間) | 0.839(0.564,1.249) | |
| p値注3) | 0.38657 | |
| 1年生存率(%)(95%信頼区間) | 76.7(64.1,85.4) | 72.6(63.1,80.0) |
ボルテゾミブを皮下投与した症例において、147例中124例(84%)に副作用が認められた。主な副作用[10%以上を記載]は、末梢性感覚ニューロパチー[51例35%]、血小板減少[44例30%]、好中球減少[34例23%]、神経痛[34例23%]、貧血[28例19%]、下痢[28例19%]、白血球減少[26例18%]、悪心[24例16%]、発熱[18例12%]であった。なお、皮下投与による局所注射部位反応は85例(58%)に認められた。[5.、7.3参照]
17.2 製造販売後調査等
再発又は難治性の多発性骨髄腫及び未治療の多発性骨髄腫患者を対象にボルテゾミブを静脈内投与した特定使用成績調査及び使用成績調査において、1186例中1060例(89.4%)に副作用が認められた21)。
17.3 その他
再発又は難治性の多発性骨髄腫患者を対象にボルテゾミブを静脈内投与した国内臨床試験、及び未治療の多発性骨髄腫患者を対象にメルファラン及びプレドニゾロンとの併用でボルテゾミブを静脈内投与した国内臨床試験の安全性評価症例において、133例中133例(100%)に副作用が認められた22)。
18. 薬効薬理
18.1 作用機序
18.1.1 ボルテゾミブは、腫瘍細胞のプロテアソームを阻害することにより、その増殖を抑制しアポトーシスを誘導する23)。
18.1.2 ボルテゾミブは、細胞の増殖やアポトーシスを制御する転写因子NF-κBの活性化を阻害する24)。
18.1.3 ボルテゾミブは、NF-κBの活性化を阻害することにより、骨髄腫細胞と骨髄ストローマ細胞の接着を阻害し、IL-6等のサイトカインの分泌を抑制し、骨髄腫細胞の増殖を抑制する25)。
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. ボルテゾミブ
20. 取扱い上の注意
包装開封後もバイアルを箱に入れて遮光保存すること。
22. 包装
1バイアル
23. 主要文献
- 独立行政法人 医薬品医療機器総合機構, 医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書(ボルテゾミブ:原発性マクログロブリン血症及びリンパ形質細胞リンパ腫), 1-52, (2017)
- Venkatakrishnan, K. et al., Clin. Ther., 31, 2444-2458, (2009) »PubMed
- Hellmann, A. et al., Clin. Pharmacokinet., 50, 781-791, (2011) »PubMed
- 向井陽美他, 臨床血液, 52, 1859-1869, (2011) »PubMed
- ボルテゾミブの毒性試験(ベルケイド注射用:2006年10月20日承認、申請資料概要2.6.2.4)
- ボルテゾミブの毒性試験(ベルケイド注射用:2006年10月20日承認、申請資料概要2.6.6.3)
- ボルテゾミブの染色体異常試験(ベルケイド注射用:2006年10月20日承認、申請資料概要2.6.6.4)
- Ogawa, Y. et al., Cancer Sci., 99, 140-144, (2008) »PubMed
- ボルテゾミブの国内第I/II相臨床試験(JPN-101)(ベルケイド注射用:2006年10月20日承認、申請資料概要2.7.6.2.7)
- ボルテゾミブの国内第I/II相臨床試験(JPN-102)(ベルケイド注射用:2011年9月16日承認、審査報告書)
- Moreau, P. et al., Lancet Oncol., 12, 431-440, (2011) »PubMed
- ボルテゾミブの蛋白結合率の検討(ベルケイド注射用:2006年10月20日承認、申請資料概要2.6.4.4)
- ボルテゾミブの代謝の検討(ベルケイド注射用:2006年10月20日承認、申請資料概要2.6.4.5)
- ボルテゾミブの代謝物の活性の検討(ベルケイド注射用:2006年10月20日承認、申請資料概要2.6.2)
- LoRusso, P. M. et al., Clin. Cancer Res., 18, 2954-2963, (2012) »PubMed
- 社内資料:同等性試験(ボルテゾミブ注射用3mg「ヤクルト」)
- Richardson, P. G. et al., N. Engl. J. Med., 352, 2487-2498, (2005) »PubMed
- San Miguel, J. F. et al., N. Engl. J. Med., 359, 906-917, (2008) »PubMed
- Mateos, M. V. et al., J. Clin. Oncol., 28, 2259-2266, (2010) »PubMed
- DMPB療法を検討した国際共同第III相試験(MMY3007試験)(ベルケイド注射用:2019年8月22日承認、審査報告書)
- 製造販売後調査等(ベルケイド注射用:2018年3月29日承認、再審査報告書)
- その他(ベルケイド注射用:2018年3月29日承認、再審査報告書)
- Hideshima, T. et al., Cancer Res., 61, 3071-3076, (2001) »PubMed
- LeBlanc, R. et al., Cancer Res., 62, 4996-5000, (2002) »PubMed
- ボルテゾミブの薬理作用(2006年10月20日承認、申請資料概要2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-838-2121
製品情報問い合わせ先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-838-2121
26. 製造販売業者等
26.1 製造販売元
高田製薬株式会社
さいたま市西区宮前町203番地1