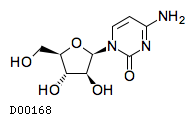
医薬品情報
| 総称名 | シタラビン |
|---|---|
| 一般名 | シタラビン |
| 欧文一般名 | Cytarabine |
| 製剤名 | シタラビン注射液 |
| 薬効分類名 | 急性白血病・悪性リンパ腫治療剤 |
| 薬効分類番号 | 4224 |
| ATCコード | L01BC01 |
| KEGG DRUG |
D00168
シタラビン
|
| KEGG DGROUP |
DG00686
シタラビン
DG02018
代謝拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年11月 改訂(効能変更、用法変更、用量変更)(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| シタラビン点滴静注液400mg「NIG」 (後発品) | Cytarabine for I.V.Infusion | 日医工岐阜工場 | 4224401A8030 | 1490円/瓶 | 劇薬, 処方箋医薬品注) |
| シタラビン点滴静注液1g「NIG」 (後発品) | Cytarabine for I.V.Infusion | 日医工岐阜工場 | 4224401A7041 | 3347円/瓶 | 劇薬, 処方箋医薬品注) |
1. 警告
<シタラビン大量療法>
1.1 シタラビン大量療法(以下、本療法)は高度の危険性を伴うので、投与中及び投与後の一定期間は患者を入院環境で医師の管理下に置くこと。
また、緊急医療体制の整備された医療機関においてがん化学療法に十分な知識と経験を持つ医師のもとで本療法が適切と判断される症例についてのみ実施すること。他の抗腫瘍剤と併用する場合、適応患者の選択にあたっては、各併用薬剤の電子添文を参照して十分注意すること。
また、緊急医療体制の整備された医療機関においてがん化学療法に十分な知識と経験を持つ医師のもとで本療法が適切と判断される症例についてのみ実施すること。他の抗腫瘍剤と併用する場合、適応患者の選択にあたっては、各併用薬剤の電子添文を参照して十分注意すること。
1.2 本療法施行にあたっては、患者又はその家族に有効性及び危険性を十分に説明し、同意を得てから投与を開始すること。
1.3 本療法は強い骨髄機能抑制作用を有する療法であり、本療法に関連したと考えられる死亡例が確認されている。本療法を施行したすべての患者に強い骨髄機能抑制が起こり、その結果致命的な感染症及び出血等を惹起することがあるので、本療法施行にあたっては、感染予防として無菌状態に近い状況下(無菌室、簡易無菌室等)で治療を行うなど、十分注意すること。[8.1.1、8.1.4、11.1.1参照]
1.4 感染症あるいは出血傾向が発現又は増悪し、致命的となることがあるので、本療法施行時に骨髄が低形成あるいは前治療又は他の薬剤による骨髄機能抑制を起こしている患者では、治療上の有益性が危険性を上回ると判断されるとき以外は施行しないこと。[9.1.1参照]
1.5 本療法により白血球(好中球)数が減少しているとき、38℃以上あるいはそれ未満でも悪寒・戦慄を伴う発熱をみた場合には感染症を疑い、血液培養により感染菌の同定を試みるとともに、直ちに十分な種類・量の広域抗菌剤を投与すること。[8.1.1参照]
1.6 本療法施行にあたっては、「2.禁忌」、「8.重要な基本的注意」及び「9.特定の背景を有する患者に関する注意」に十分留意し、慎重に患者を選択すること。
2. 禁忌
次の患者には投与しないこと
2.1 本剤に対する重篤な過敏症の既往歴のある患者
2.2 重篤な感染症を合併している患者[感染症が増悪し致命的となることがある。]
4. 効能または効果
6. 用法及び用量
<シタラビン大量療法>
(1)急性骨髄性白血病
再発又は難治例に対する寛解導入療法(サルベージ療法)
通常、成人には、シタラビンとして1回2g/m2を5%ブドウ糖液あるいは生理食塩液に混合して300〜500mLとし、12時間毎に3時間かけて点滴で最大6日間連日静脈内投与する。
小児に投与する場合には、シタラビンとして1回3g/m2を12時間毎に3時間かけて点滴で3日間連日静脈内投与する。
小児に投与する場合には、シタラビンとして1回3g/m2を12時間毎に3時間かけて点滴で3日間連日静脈内投与する。
地固め療法
通常、成人には、シタラビンとして1回2g/m2を5%ブドウ糖液あるいは生理食塩液に混合して300〜500mLとし、12時間毎に3時間かけて点滴で最大6日間静脈内投与、又は1回3g/m2を12時間毎に3時間かけて点滴で3日間静脈内投与する。
小児に投与する場合には、シタラビンとして1回1〜2g/m2を12時間毎に3時間かけて点滴で3〜5日間静脈内投与、又は1回3g/m2を12時間毎に3時間かけて点滴で3日間静脈内投与する。
小児に投与する場合には、シタラビンとして1回1〜2g/m2を12時間毎に3時間かけて点滴で3〜5日間静脈内投与、又は1回3g/m2を12時間毎に3時間かけて点滴で3日間静脈内投与する。
(2)急性リンパ性白血病
通常、成人には、他の抗腫瘍剤と併用し、シタラビンとして1回2g/m2を5%ブドウ糖液あるいは生理食塩液に混合して300〜500mLとし、12時間毎に3時間かけて点滴で最大6日間連日静脈内投与する。
小児に投与する場合には、他の抗腫瘍剤と併用し、シタラビンとして1回2g/m2を12時間毎に3時間かけて点滴で3日間連日静脈内投与する。
小児に投与する場合には、他の抗腫瘍剤と併用し、シタラビンとして1回2g/m2を12時間毎に3時間かけて点滴で3日間連日静脈内投与する。
(3)悪性リンパ腫
通常、成人には、他の抗腫瘍剤と併用し、シタラビンとして1回2g/m2を5%ブドウ糖液あるいは生理食塩液に混合して300〜500mLとし、1日1〜2回3時間かけて点滴で1〜2日間(最大2回)連日静脈内投与する。
小児に投与する場合には、他の抗腫瘍剤と併用し、シタラビンとして1回2g/m2を12時間毎に3時間かけて点滴で3日間連日静脈内投与する。
小児に投与する場合には、他の抗腫瘍剤と併用し、シタラビンとして1回2g/m2を12時間毎に3時間かけて点滴で3日間連日静脈内投与する。
なお、患者の年齢、末梢血及び骨髄の状態等により適宜減量する。
<腫瘍特異的T細胞輸注療法の前処置>
再生医療等製品の用法及び用量又は使用方法に基づき使用する。
7. 用法及び用量に関連する注意
<効能共通>
7.1 点滴時間は本剤の有効性及び安全性に関与しており、時間の短縮は血中濃度の上昇により中枢神経系毒性の増加につながるおそれがあり、時間の延長は患者の負担も大きく、薬剤の暴露時間増加により骨髄抑制の遷延に伴う感染症・敗血症の増加につながるおそれがある。
<シタラビン大量療法>
7.2 他の抗腫瘍剤との併用療法においては、併用薬剤の電子添文も参照すること。
7.3 急性骨髄性白血病に対して本剤を使用する際には、本剤の投与量、投与スケジュール、併用薬等について、学会のガイドライン等、最新の情報を参考にすること。
8. 重要な基本的注意
8.1 本療法施行にあたっては、患者の状態を十分観察し、以下の事項について特に注意すること。
8.1.1 本療法の強い骨髄機能抑制作用により、白血球数減少及び免疫能が低下し、易感染状態になるので、感染予防として無菌状態に近い状況下(無菌室、簡易無菌室等)で治療を行うこと。また、必ず感染予防処置(消化管殺菌、真菌予防等)を行うこと。[1.3、1.5、9.1.1、11.1.1参照]
(1)38℃以上あるいはそれ未満でも悪寒・戦慄を伴う発熱をみた場合、感染症を疑い、血液培養による感染菌の同定を試みるとともに、直ちに十分な種類・量の広域抗菌剤を投与する。
また、抗菌剤が無効の場合は、好中球減少時にも有効な抗真菌剤を早期より併用する。
また、抗菌剤が無効の場合は、好中球減少時にも有効な抗真菌剤を早期より併用する。
(2)G-CSFは、承認されている範囲内で、積極的に投与する。
8.1.2 他の抗腫瘍剤と併用する場合には、併用する薬剤の組合せ、用量等に注意すること。[10.2参照]
8.1.3 本療法中に急激に白血球数が減少し、高度の骨髄機能抑制が予想される場合は、効果と副作用を評価し、休薬、減量、中止等、適切な処置を行うこと。[11.1.1参照]
8.1.5 本療法の継続に際しては、末梢血液及び骨髄の検査を行うなど、患者の状態を十分観察し、効果と副作用を評価し、減量、休薬、中止等、適切な処置を行うこと。[11.1.1参照]
8.2 本療法に特有な副作用として眼症状、皮膚症状が知られている。
眼症状は結膜炎、眼痛、羞明、眼脂、結膜充血、角膜潰瘍等が発現する。これらの症状は副腎皮質ホルモン点眼剤により予防及び軽減することができる。皮膚症状は四肢末端に発疹、発赤、紅斑(しばしば高度の痛みを伴う)等が発現する。これらの症状は副腎皮質ホルモン剤により軽減することができる。[11.1.3参照]
眼症状は結膜炎、眼痛、羞明、眼脂、結膜充血、角膜潰瘍等が発現する。これらの症状は副腎皮質ホルモン点眼剤により予防及び軽減することができる。皮膚症状は四肢末端に発疹、発赤、紅斑(しばしば高度の痛みを伴う)等が発現する。これらの症状は副腎皮質ホルモン剤により軽減することができる。[11.1.3参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
減量を考慮するなど、注意して投与すること。中枢神経系障害が多く発生するとの報告がある。副作用が強くあらわれるおそれがある。
9.3 肝機能障害患者
副作用が強くあらわれるおそれがある。
9.4 生殖能を有する者
9.4.1 妊娠可能な女性に対しては、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[9.5参照]
9.4.2 パートナーが妊娠する可能性のある男性に対しては、本剤投与中及び投与終了後一定期間は適切な避妊を行うよう指導すること。[15.2参照]
9.4.3 小児及び生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。催奇形性を疑う症例報告があり、また、動物実験(マウス、ラット)で催奇形作用が報告されている。[9.4.1参照]
9.6 授乳婦
授乳しないことが望ましい。本剤が乳汁に移行する可能性があり、乳児が乳汁を介して本剤を摂取した場合、乳児に重篤な副作用が発現するおそれがある。[15.2参照]
9.7 小児等
副作用の発現に特に注意すること。
9.8 高齢者
60歳以上の高齢者には、中枢神経系障害があらわれやすいので十分注意し、1回投与量1.5g/m2までの減量投与も考慮すること。また、用量並びに投与間隔に留意する等患者の状況を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
地固め療法においても、支持療法を積極的に行い、患者の状態を観察しながら慎重に投与すること。なお、本療法を高齢者に施行するにあたっては、患者の全身状態等を考慮し、慎重に患者を選択すること。
地固め療法においても、支持療法を積極的に行い、患者の状態を観察しながら慎重に投与すること。なお、本療法を高齢者に施行するにあたっては、患者の全身状態等を考慮し、慎重に患者を選択すること。
10. 相互作用
10.2 併用注意
| 他の抗腫瘍剤 放射線照射 [8.1.2参照] | 骨髄機能抑制等の副作用が増強するおそれがある。併用療法を行う場合には患者の状態を観察しながら、減量するなど慎重に行うこと。 | 骨髄機能抑制等の予想される副作用項目が重複している薬剤及び放射線照射。 |
| フルシトシン [8.1.2参照] | 骨髄機能抑制の副作用が増強することがあるので、患者の状態を観察しながら、減量するなど慎重に投与すること。 | 骨髄機能抑制の相加・相乗作用による。 |
| フルシトシン [8.1.2参照] | フルシトシンの効果を減弱させるとの報告がある。 | フルシトシンの血中濃度の低下による。 |
| フルダラビン [8.1.2参照] | 骨髄機能抑制等の副作用が増強するおそれがある。 | in vivo試験及びin vitro試験において、シタラビンの活性代謝物であるAra-CTPの細胞内濃度の上昇が認められている。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄機能抑制に伴う血液障害(頻度不明)
11.1.2 ショック(頻度不明)
呼吸困難、全身潮紅、血管浮腫、蕁麻疹等のアナフィラキシーを伴うことがある。異常が認められた場合には投与を中止し、血圧の維持、体液の補充管理、気道の確保等の適切な処置を行うこと。
11.1.3 シタラビン症候群(頻度不明)
シタラビン症候群として発熱、筋肉痛、骨痛、ときに斑状丘疹性皮疹、胸痛、結膜炎及び倦怠感があらわれることがある。この症候群は通常薬剤投与後6〜12時間で発現する。なお、このような症状があらわれた場合には副腎皮質ホルモン剤の投与等、適切な処置を行うこと。[8.2参照]
11.1.4 急性呼吸促迫症候群(2.4%)、間質性肺炎(頻度不明)
急速に進行する呼吸困難、低酸素血症、両側性びまん性肺浸潤影・間質性陰影等の胸部X線異常等が認められた場合には投与を中止し、呼吸管理等の適切な処置を行うこと。
11.1.5 肝機能障害(2.4%)、黄疸(2.4%)
AST、ALT、ビリルビンの著しい上昇等を伴う肝機能障害、黄疸があらわれることがある。高度な肝障害が引き起こされることがあり、また肝障害が遷延する傾向がある。このため、肝障害出現時には、肝機能の回復が認められるまで、適切な間隔にて肝機能検査を行うこと。肝障害出現時、肝機能の悪化や回復の遷延を引き起こす可能性のある薬剤は慎重に投与すること。
11.1.6 不整脈、心不全
完全房室ブロック(2.4%)、徐脈、心筋障害(いずれも頻度不明)があらわれることがある。
11.1.7 消化管障害(頻度不明)
消化管潰瘍、出血、好中球減少性腸炎等の消化管障害があらわれたとの報告がある。
11.1.8 中枢神経系障害
一般に可逆的である言語障害(7.3%)、運動失調(頻度不明)、傾眠(12.2%)、昏睡(頻度不明)、白質脳症(頻度不明)等の中枢神経系障害があらわれることがある。
11.1.9 肝膿瘍(頻度不明)
11.1.10 急性膵炎、肺浮腫、有痛性紅斑(いずれも頻度不明)
11.2 その他の副作用
| 50%以上 | 5〜50%未満 | 5%未満 | 頻度不明 | |
| 皮膚 | 脱毛(症)、発疹 | |||
| 精神神経系 | 頭痛、活動低下 | めまい、知覚不全 | 末梢神経障害 | |
| 消化器 | 食欲不振、嘔気、嘔吐、下痢 | 口内炎、血便、イレウス、しゃっくり、舌痛、肛門周囲炎 | 腹痛 | |
| 肝臓 | LDH上昇、肝機能異常、Al-P上昇、γ-GTP上昇 | |||
| 代謝異常 | 電解質異常、血中尿酸上昇・低下 | |||
| 循環器 | 頻脈、低血圧 | ECG異常、高血圧、心膜炎 | ||
| 血液凝固系 | フィブリノーゲン増加、凝固時間延長・短縮、FDP増加 | 播種性血管内凝固症候群、血痰、出血 | ||
| 腎臓 | BUN上昇・低下、尿糖陽性、クレアチニン上昇、尿蛋白陽性 | 尿潜血、尿円柱、尿中結晶、腎機能異常 | ||
| その他 | 倦怠(感)、発熱、CRP上昇 | 低蛋白血症、結膜炎、体重増加・減少、CK上昇・低下、感染、敗血症、ウロビリノーゲン陽性 | 薬物性発熱、筋(肉)痛、胸膜炎、腹水、IgG減少 | 血栓性静脈炎、出血性膀胱炎、浮腫(末梢性、顔面、頚部等) |
13. 過量投与
13.1 症状
外国において、4.5g/m2を1時間かけて静脈内注入し、12時間毎に12回投与した結果、不可逆的な中枢神経系障害があらわれたとの報告がある。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は細胞毒性を有するため、調製時には手袋を着用することが望ましい。皮膚に薬液が付着した場合には、直ちに多量の流水でよく洗い流すこと。
14.1.2 細菌汚染に注意して用時調製し、未使用の残液は適切に廃棄すること。
15. その他の注意
15.1 臨床使用に基づく情報
本剤と他の抗悪性腫瘍剤を併用した患者に、白血病、肺腺癌等の二次性悪性腫瘍が発生したとの報告がある。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
16.4 代謝
16.5 排泄
シタラビン(Ara-C)を癌患者に静脈内投与あるいは持続点滴静脈内投与すると、大部分が24時間以内に尿中に排泄された3)(外国人データ)。
| 投与経路 | 投与量(mg/m2) | 患者数 | 24時間累積尿中排泄(% of 用量、平均値) | ||
| 合計 | Ara-C | Ara-U | |||
| 静脈内投与 | 47〜3000 | 8 | 78 | 7.1 | 70.9 |
| 持続点滴静脈内投与 | 100〜400 | 4 | 83.8 | 7.8 | 76.0 |
17. 臨床成績
17.1 有効性及び安全性に関する試験
<シタラビン大量療法>
17.1.1 国内第II相臨床試験
副作用発現頻度は100.0%(41例中41例)であった。主な副作用は、食欲不振39例(95.1%)、倦怠(感)38例(92.7%)、嘔気37例(90.2%)、発熱36例(87.8%)、嘔吐33例(80.5%)であった7)。
17.1.2 海外臨床試験
(1)再発・難治性急性リンパ性白血病に対する効果(併用療法)
(2)再発・難治性悪性リンパ腫に対する効果(併用療法)
18. 薬効薬理
18.1 作用機序
18.2 薬理作用
19. 有効成分に関する理化学的知見
19.1. シタラビン
22. 包装
<シタラビン点滴静注液400mg「NIG」>
20mL×1バイアル
<シタラビン点滴静注液1g「NIG」>
50mL×1バイアル
23. 主要文献
- Benedict WF,et al., Science., 171, 680-2, (1971) »PubMed
- Kouri RE,et al., Cancer Res., 35, 2413-9, (1975) »PubMed
- Ho DHW,et al., Clin Pharmacol Ther., 12 (6), 944-54, (1971)
- 第十八改正日本薬局方 医薬品情報 JPDI2021, 304-5, (2021), (じほう)
- 宮脇修一他, 癌と化学療法, 25 (14), 2229-42, (1998) »PubMed
- 臨床第II相試験(キロサイドN注;2000年1月18日承認、申請資料概要ト.1.)
- 審査報告書(キロサイドN注;2000年1月18日)
- Hiddemann W,et al., Sem Oncol., 14 (2 S1), 73-7, (1987)
- Wells RJ,et al., J Clin Oncol., 3 (7), 998-1004, (1985) »PubMed
- Gore M,et al., Cancer Chemother Pharmacol., 23, 373-6, (1989) »PubMed
- Hiddemann W,et al., Leukemia., 4 (9), 637-40, (1990) »PubMed
- Velasquez WS,et al., Blood., 71 (1), 117-22, (1988) »PubMed
- Velasquez WS,et al., J Clin Oncol., 12 (6), 1169-76, (1994) »PubMed
- Ho AD,et al., Cancer., 64, 1388-92, (1989) »PubMed
- White JC,et al., J Clin Invest., 79, 380-7, (1987) »PubMed
- Wiley JS,et al., J Clin Invest., 69, 479-89, (1982) »PubMed
- Furth JJ,et al., Cancer Res., 28, 2061-7, (1968) »PubMed
- シタラビン大量療法時の薬理作用(キロサイドN注;2000年1月18日承認、申請資料概要ホ.1.)
- Yang JL,et al., J Clin Invest., 75, 141-6, (1985) »PubMed
- Kees UR,et al., Cancer Res., 49, 3015-9, (1989) »PubMed
- Chandrasekaran B,et al., Cancer Chemother Pharmacol., 29, 455-60, (1992) »PubMed
- Chandrasekaran B,et al., Cancer Res., 49, 3259-66, (1989) »PubMed
- Gunji H,et al., Cancer Res., 51, 741-3, (1991) »PubMed
- Gorczyca W,et al., Cancer Res., 53, 3186-92, (1993) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
製品情報問い合わせ先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
26. 製造販売業者等
26.1 製造販売元
日医工岐阜工場株式会社
富山市総曲輪1丁目6番21
26.2 発売元
日医工株式会社
富山市総曲輪1丁目6番21
26.3 販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号