医薬品情報
| 総称名 | ベラプロストNa |
|---|---|
| 一般名 | ベラプロストナトリウム |
| 欧文一般名 | Beraprost Sodium |
| 薬効分類名 | 経口プロスタサイクリン(PGI2)誘導体製剤 |
| 薬効分類番号 | 3399 |
| ATCコード | B01AC19 |
| KEGG DRUG |
D01551
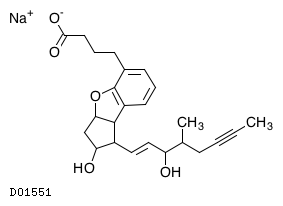
ベラプロストナトリウム
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ベラプロストNa錠20μg「VTRS」 (後発品) | ヴィアトリス・ヘルスケア | 3399005F1315 | 12.8円/錠 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 出血している患者(血友病、毛細血管脆弱症、上部消化管出血、尿路出血、喀血、眼底出血等)[出血を増大するおそれがある。]
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
5. 効能または効果に関連する注意
<原発性肺高血圧症>
5.1 原発性肺高血圧症と診断された患者にのみ使用すること。
5.2 本剤は経口投与であるため、重症度の高い患者等では効果が得られにくい場合がある。循環動態あるいは臨床症状の改善が見られない場合は、注射剤や他の治療に切り替えるなど適切な処置を行うこと。
6. 用法及び用量
<慢性動脈閉塞症に伴う潰瘍、疼痛及び冷感の改善>
通常、成人には、ベラプロストナトリウムとして1日120μgを3回に分けて食後に経口投与する。
<原発性肺高血圧症>
通常、成人には、ベラプロストナトリウムとして1日60μgを3回に分けて食後に経口投与することから開始し、症状(副作用)を十分観察しながら漸次増量する。増量する場合には、投与回数を1日3〜4回とし、最高用量を1日180μgとする。
7. 用法及び用量に関連する注意
<原発性肺高血圧症>
原発性肺高血圧症は薬物療法に対する忍容性が患者によって異なることが知られており、本剤の投与にあたっては、投与を少量より開始し、増量する場合は患者の状態を十分に観察しながら行うこと。
8. 重要な基本的注意
<効能共通>
8.1 意識障害等があらわれることがあるので、自動車の運転等、危険を伴う機械の操作に従事する際には注意するよう患者に十分に説明すること。
<原発性肺高血圧症>
8.2 本剤の有効成分は「ケアロードLA錠60μg」、「ベラサスLA錠60μg」と同一であるが、用法・用量が異なることに注意すること。
8.3 「ケアロードLA錠60μg」、「ベラサスLA錠60μg」から本剤へ切り替える場合には、「ケアロードLA錠60μg」、「ベラサスLA錠60μg」の最終投与時から12時間以上が経過した後に、本剤をベラプロストナトリウムとして原則1日60μgを3回に分けて食後に経口投与することから開始すること。また、「ケアロードLA錠60μg」、「ベラサスLA錠60μg」と同用量の本剤に切り替えると、過量投与になるおそれがあるため注意すること。[16.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 月経期間中の患者
出血傾向を助長するおそれがある。
9.1.2 出血傾向並びにその素因のある患者
出血傾向を助長するおそれがある。
9.2 腎機能障害患者
9.2.1 高度の腎機能障害(血清クレアチニン2.5mg/dL以上)のある患者
曝露量(AUC)が増加するおそれがある。[16.6.1参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないこと。[2.2参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中へ移行することが報告されている。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| 抗凝血剤 ワルファリン等 抗血小板剤 アスピリン チクロピジン等 血栓溶解剤 ウロキナーゼ等 | 出血傾向を助長することがある。 | 相互に作用を増強することがある。 |
| プロスタグランジンI2製剤 エポプロステノール ベラプロスト注) エンドセリン受容体拮抗剤 ボセンタン | 血圧低下を助長するおそれがあるので、血圧を十分に観察すること。 | 相互に作用を増強することが考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 出血傾向(頻度不明)
脳出血、消化管出血、肺出血、眼底出血があらわれることがある。
11.1.2 ショック、失神、意識消失(いずれも頻度不明)
血圧低下、頻脈、顔面蒼白、嘔気等が認められた場合には投与を中止すること。
11.1.3 間質性肺炎(頻度不明)
11.1.4 肝機能障害(頻度不明)
黄疸や著しいAST、ALTの上昇を伴う肝機能障害があらわれることがある。
11.1.5 狭心症(頻度不明)
11.1.6 心筋梗塞(頻度不明)
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 出血傾向 | 出血傾向、皮下出血、鼻出血 | |||
| 血液 | 貧血、白血球増多 | 好酸球増多、血小板減少、白血球減少 | ||
| 過敏症 | 発疹、湿疹、そう痒 | 蕁麻疹、紅斑 | ||
| 精神・神経系 | 頭痛 | 眠気、ふらつき | めまい、立ちくらみ、もうろう状態、しびれ感、振戦、不眠、浮遊感 | |
| 消化器系 | 下痢、嘔気、食欲不振、腹痛 | 嘔吐、口渇、胃不快感 | 上腹部痛、胃潰瘍、胃障害、胸やけ | |
| 肝臓 | AST上昇、ALT上昇、γ-GTP上昇、LDH上昇 | ビリルビン上昇、Al-P上昇 | 黄疸 | |
| 腎臓 | BUN上昇 | 血尿 | 頻尿 | |
| 循環器系 | 顔面潮紅 | ほてり、のぼせ | 動悸、潮紅 | 血圧低下、頻脈 |
| その他 | トリグリセライド上昇 | 倦怠感、疼痛、関節痛、息苦しさ、耳鳴、発汗、冷汗 | 浮腫、胸部不快感、胸痛、発熱、熱感、顎痛、気分不良、背部痛、頸部痛、脱毛、咳嗽、筋痛、脱力感 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
慢性動脈閉塞症において本剤を1日180μg投与したとき、副作用発現頻度が高くなるとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人にベラプロストナトリウム100μg注)を経口単回投与したときの薬物動態パラメータは以下のとおりであった1)。
| Cmax(pg/mL) | Tmax(h) | t1/2(h) |
| 440 | 1.42 | 1.11 |
16.1.2 反復投与
健康成人にベラプロストナトリウム50μg注)を1日3回10日間経口反復投与したときの最高血漿中未変化体濃度は0.3〜0.5ng/mLであり、反復投与による蓄積性は認められなかった3)。
16.1.3 生物学的同等性試験
ベラプロストNa錠20μg「VTRS」とドルナー錠20μgを、クロスオーバー法によりそれぞれ2錠(ベラプロストナトリウムとして40μg)健康成人男子に絶食時単回経口投与して血漿中ベラプロストナトリウム濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両製剤の生物学的同等性が確認された4)。
| 判定パラメータ | 参考パラメータ | |||
| AUCt(pg・hr/mL) | Cmax(pg/mL) | Tmax(hr) | T1/2(hr) | |
| ベラプロストNa錠20μg「VTRS」 | 593.5±169.3 | 461.2±187.3 | 0.5±0.2 | 0.8±0.2 |
| ドルナー錠20μg | 603.2±146.0 | 451.6±158.7 | 0.5±0.2 | 0.9±0.3 |
血漿中ベラプロストナトリウムの濃度推移
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
血漿蛋白結合率は約90%であった5)(in vitro)。
16.4 代謝
16.5 排泄
健康成人12人にベラプロストナトリウム50μg注)を経口単回投与したときの24時間後までの尿中未変化体排泄量は2.8μgであり、β-酸化体は5.4μgであった。未変化体及びβ-酸化体は、グルクロン酸抱合体としても排泄される。なお、排泄量における遊離体の割合はそれぞれ14%、70%であった1)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能正常者、中等度腎機能障害患者及び高度腎機能障害患者を対象にベラプロストナトリウム錠40μgを食後経口単回投与したときの薬物動態パラメータは以下のとおりであり、腎機能正常者と比較し、高度腎機能障害患者でAUC0-24が増加する傾向が認められた8)。[9.2.1参照]
| Cmax(pg/mL) | Tmax(h) | t1/2(h) | AUC0-24(pg・h/mL) | |
| 腎機能正常者 (Scr<1.3mg/dL) | 141.28±76.98 | 2.77±1.50 | 1.46±0.30※ | 404.15±185.75 |
| 中等度腎機能障害患者 (1.3≦Scr<2.5mg/dL) | 132.33±85.70 | 2.02±0.85 | 1.27±0.62 | 308.18±117.71 |
| 高度腎機能障害患者 (Scr≧2.5mg/dL) | 148.55±60.13 | 3.15±2.16 | 1.55±0.39※ | 682.83±189.27 |
注)本剤の承認された用量は、慢性動脈閉塞症に伴う潰瘍、疼痛及び冷感の改善では1日120μg、原発性肺高血圧症では1日60〜180μgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<慢性動脈閉塞症に伴う潰瘍、疼痛及び冷感の改善>
17.1.1 国内臨床試験
慢性動脈閉塞症に対する国内第III相二重盲検比較試験によりベラプロストナトリウム錠の有用性が認められた。国内二重盲検比較試験において、最終全般改善度は、中等度改善以上67.6%(50/74例)、軽度改善以上86.5%(64/74例)であった9)。
<原発性肺高血圧症>
17.1.2 国内第II相試験
肺高血圧症に対する多施設オープン試験において、原発性肺高血圧症21例における全肺血管抵抗等の心血行動態指標及び自他覚所見等を総合した最終全般改善度は、中等度改善以上38.1%(8例)、軽度改善以上61.9%(13例)であった10)。
18. 薬効薬理
18.1 作用機序
18.2 抗血小板作用
18.3 血管拡張・血流増加作用
18.3.1 健康成人への経口投与において皮膚血流量の増加が認められる20)。
18.4 血管平滑筋細胞増殖抑制作用
血小板由来増殖因子刺激によるヒト肺動脈血管平滑筋細胞の増殖を抑制する23)(in vitro)。
18.5 病態モデルに対する作用
19. 有効成分に関する理化学的知見
19.1. ベラプロストナトリウム
22. 包装
100錠[10錠(PTP)×10]
23. 主要文献
- 加藤隆一ほか, 臨床薬理, 20 (3), 515-527, (1989) »DOI
- 健康成人男子における第I相臨床試験−単回投与試験:食事の影響−(ケアロードLA錠/ベラサスLA錠:2007.10.19承認、CTD2.7.6)
- 加藤隆一ほか, 臨床薬理, 20 (3), 529-539, (1989) »DOI
- 社内資料:生物学的同等性試験(ベラプロストNa錠20μg「VTRS」)
- 分布(ドルナー錠/プロサイリン錠:1999.9.22承認、申請資料概要ヘ.1.(9))
- 代謝(ドルナー錠/プロサイリン錠:1999.9.22承認、申請資料概要へ.1.(8))
- Fukazawa T,et al., 薬学雑誌, 128 (10), 1459-1465, (2008) »DOI
- 腎機能正常者及び腎機能障害患者における薬物動態(ドルナー錠/プロサイリン錠:2012.12.19、再審査報告書)
- 阪口周吉ほか, 臨牀と研究, 67 (2), 575-584, (1990)
- 国枝武義ほか, 臨牀と研究, 74 (10), 2611-2629, (1997)
- Nishio S,et al., Japan J Pharmacol., 47 (1), 1-10, (1988) »DOI
- 西尾伸太郎ほか, 日本薬理学雑誌, 94 (6), 351-361, (1989) »PubMed
- Umetsu T,et al., Japan J Pharmacol., 43 (1), 81-90, (1987) »DOI
- Umetsu T,et al., Arzneim -Forsch/Drug Res., 39 (1), 68-73, (1989)
- Kajikawa N,et al., Arzneim -Forsch/Drug Res., 39 (4), 495-499, (1989)
- 北村正樹, 日本内科学会雑誌, 99 (7), 1563-1568, (2010) »DOI
- 勝村達喜ほか, 新薬と臨牀, 38 (9), 1401-1406, (1989)
- 池田康夫ほか, 現代医療, 24 (特), 141-146, (1992)
- 安納重康ほか, 血栓と循環, 9 (3), 298-302, (2001)
- 木村忠広ほか, 脈管学, 32 (4), 327-331, (1992)
- 勝村達喜ほか, 血管, 12 (4), 195-199, (1989)
- Akiba T,et al., Br J Pharmacol., 89 (4), 703-711, (1986) »PubMed
- 車谷元ほか, 血栓と循環, 7 (2), 185-196, (1999)
- 血管拡張・血流増加作用(ドルナー錠/プロサイリン錠:1999.9.22承認、申請資料概要ホ.2.(1))
- Murai T,et al., Arzneim -Forsch /Drug Res., 39 (8), 856-859, (1989)
- Nishio S,et al., Res Comm Chem Pathol Pharmacol., 64 (3), 381-393, (1989)
- 結城秀樹ほか, 血栓と循環, 9 (3), 293-297, (2001)
24. 文献請求先及び問い合わせ先
文献請求先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
製品情報問い合わせ先
ヴィアトリス製薬合同会社
メディカルインフォメーション部
〒106-0041
東京都港区麻布台一丁目3番1号
電話:フリーダイヤル 0120-419-043
26. 製造販売業者等
26.1 製造販売元
ヴィアトリス・ヘルスケア合同会社
東京都港区麻布台一丁目3番1号
26.2 販売元
ヴィアトリス製薬合同会社
東京都港区麻布台一丁目3番1号