医薬品情報
| 総称名 | マヴィレット |
|---|---|
| 一般名 | グレカプレビル水和物 ピブレンタスビル |
| 欧文一般名 | Glecaprevir Hydrate Pibrentasvir |
| 製剤名 | グレカプレビル水和物・ピブレンタスビル配合剤 |
| 薬効分類名 | 抗ウイルス化学療法剤 |
| 薬効分類番号 | 6250 |
| ATCコード | J05AP57 |
| KEGG DRUG |
D11014
グレカプレビル・ピブレンタスビル
|
| KEGG DGROUP |
DG03198
抗C型肝炎ウイルス薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年8月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| マヴィレット配合顆粒小児用 | MAVIRET Combination granules for pediatric use | アッヴィ | 6250113D1020 | 20313.9円/包 | 処方箋医薬品注) |
1. 警告
1.1 本剤は、ウイルス性肝疾患の治療に十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される患者に対してのみ投与すること。
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
本剤の使用に際しては、HCV RNAが陽性であることを確認すること。また、肝予備能、臨床症状等により、非代償性肝硬変でないことを確認すること。
6. 用法及び用量
<セログループ1(ジェノタイプ1)又はセログループ2(ジェノタイプ2)のC型慢性肝炎の場合>
通常、3歳以上12歳未満かつ体重45kg未満の小児には、グレカプレビル及びピブレンタスビルとして下記の体重別の用量を1回量とし、1日1回、食後又は食事とともに経口投与する。投与期間は8週間とする。なお、C型慢性肝炎に対する前治療歴に応じて投与期間は12週間とすることができる。
12kg以上20kg未満:3包(グレカプレビルとして150mg及びピブレンタスビルとして60mg)
20kg以上30kg未満:4包(グレカプレビルとして200mg及びピブレンタスビルとして80mg)
30kg以上45kg未満:5包(グレカプレビルとして250mg及びピブレンタスビルとして100mg)
<セログループ1(ジェノタイプ1)又はセログループ2(ジェノタイプ2)のC型代償性肝硬変の場合>
通常、3歳以上12歳未満かつ体重45kg未満の小児には、グレカプレビル及びピブレンタスビルとして下記の体重別の用量を1回量とし、1日1回、食後又は食事とともに経口投与する。投与期間は12週間とする。
12kg以上20kg未満:3包(グレカプレビルとして150mg及びピブレンタスビルとして60mg)
20kg以上30kg未満:4包(グレカプレビルとして200mg及びピブレンタスビルとして80mg)
30kg以上45kg未満:5包(グレカプレビルとして250mg及びピブレンタスビルとして100mg)
<セログループ1(ジェノタイプ1)又はセログループ2(ジェノタイプ2)のいずれにも該当しないC型慢性肝炎又はC型代償性肝硬変の場合>
通常、3歳以上12歳未満かつ体重45kg未満の小児には、グレカプレビル及びピブレンタスビルとして下記の体重別の用量を1回量とし、1日1回、食後又は食事とともに経口投与する。投与期間は12週間とする。
12kg以上20kg未満:3包(グレカプレビルとして150mg及びピブレンタスビルとして60mg)
20kg以上30kg未満:4包(グレカプレビルとして200mg及びピブレンタスビルとして80mg)
30kg以上45kg未満:5包(グレカプレビルとして250mg及びピブレンタスビルとして100mg)
7. 用法及び用量に関連する注意
7.1 セログループ1(ジェノタイプ1)又はセログループ2(ジェノタイプ2)のC型慢性肝炎患者に対しては、前治療の有無により投与期間を考慮すること。グレカプレビル・ピブレンタスビル配合錠の国内臨床試験において、NS3/4Aプロテアーゼ阻害剤、NS5A阻害剤又はNS5Bポリメラーゼ阻害剤の前治療歴を有する患者に対するグレカプレビル・ピブレンタスビル配合錠の投与期間は12週間であった。
7.2 本剤とグレカプレビル・ピブレンタスビル配合錠の生物学的同等性は示されていないため、互換使用を行わないこと。
8. 重要な基本的注意
8.1 B型肝炎ウイルス感染の患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)において、C型肝炎直接型抗ウイルス薬を投与開始後、C型肝炎ウイルス量が低下する一方B型肝炎ウイルスの再活性化が報告されているので、本剤投与に先立って、B型肝炎ウイルス感染の有無を確認すること。[9.1.1参照]
8.2 肝機能障害、黄疸があらわれることがあるので、定期的に肝機能検査を行うなど、観察を十分に行うこと。[11.1参照]
8.3 C型肝炎直接型抗ウイルス薬を投与開始後、ワルファリンやタクロリムスの増量、低血糖によりインスリン等の糖尿病治療薬の減量が必要となった症例が報告されており、本剤による抗ウイルス治療に伴い、使用中の併用薬の用量調節が必要になる可能性がある。特にワルファリン、タクロリムス等の肝臓で代謝される治療域の狭い薬剤や糖尿病治療薬を使用している患者に本剤を開始する場合には、原則、処方医に連絡するとともに、PT-INRや血中薬物濃度、血糖値のモニタリングを頻回に行うなど患者の状態を十分に観察すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 B型肝炎ウイルス感染の患者又は既往感染者
B型肝炎ウイルス感染の患者又は既往感染者(HBs抗原陰性、かつHBc抗体又はHBs抗体陽性)に本剤を投与する場合は、HBV DNA量等のB型肝炎ウイルスマーカーのモニタリングを行うなど、B型肝炎ウイルスの再活性化の徴候や症状の発現に注意すること。C型肝炎直接型抗ウイルス薬を投与後、C型肝炎ウイルス量が低下する一方B型肝炎ウイルスの再活性化が報告されている。[8.1参照]
9.3 肝機能障害患者
9.5 妊婦
9.6 授乳婦
9.7 小児等
3歳未満の幼児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
10. 相互作用
相互作用序文
薬物代謝酵素用語
P糖蛋白(P-gp)
薬物代謝酵素用語
乳癌耐性蛋白(BCRP)
薬物代謝酵素用語
有機アニオントランスポーター(OATP)1B1
薬物代謝酵素用語
有機アニオントランスポーター(OATP)1B3
10.1 併用禁忌
| アタザナビル硫酸塩 [レイアタッツ] [2.3、16.7.2参照] | グレカプレビルの血中濃度が上昇するおそれがある。 ALT上昇のリスクが増加するおそれがある。 | アタザナビルのOATP1B阻害作用によるものと考えられる。ALT上昇の機序は不明。 |
| アトルバスタチンカルシウム水和物 [リピトール] [2.3、16.7.2参照] | アトルバスタチンの血中濃度が上昇するおそれがある。 アトルバスタチンによる副作用の発現リスクが高くなるおそれがある。 | グレカプレビル及びピブレンタスビルのOATP1B及びBCRP阻害作用による。 |
| リファンピシン [リファジン] [2.3、16.7.2参照] | グレカプレビル及びピブレンタスビルの血中濃度が低下し、効果が減弱するおそれがある。 | リファンピシンのP-gp誘導作用による。 |
10.2 併用注意
| ジゴキシン ダビガトランエテキシラートメタンスルホン酸塩[16.7.2参照] | これら薬剤の血中濃度が上昇するおそれがある。 | グレカプレビル及びピブレンタスビルのP-gp阻害作用による。 |
| カルバマゼピン エファビレンツ フェニトイン フェノバルビタール セイヨウオトギリソウ(St.John's Wort、セント・ジョーンズ・ワート)含有食品[16.7.2参照] | グレカプレビル及びピブレンタスビルの血中濃度が低下し、効果が減弱するおそれがある。 | これら薬剤のP-gp誘導作用による。 |
| エチニルエストラジオール | ALT上昇のリスクが増加するおそれがある。 | 機序不明 |
| ロスバスタチンカルシウム[16.7.2参照] | ロスバスタチンの血中濃度が上昇するおそれがある。 ロスバスタチンによる副作用の発現リスクが高くなるおそれがある。 | グレカプレビル及びピブレンタスビルのOATP1B及びBCRP阻害作用による。 |
| シンバスタチン[16.7.2参照] | シンバスタチンの血中濃度が上昇するおそれがある。 シンバスタチンによる副作用の発現リスクが高くなるおそれがある。 | グレカプレビル及びピブレンタスビルのOATP1B及びBCRP阻害作用による。 |
| プラバスタチンナトリウム[16.7.2参照] | プラバスタチンの血中濃度が上昇するおそれがある。 プラバスタチンによる副作用の発現リスクが高くなるおそれがある。 | グレカプレビル及びピブレンタスビルのOATP1B阻害作用による。 |
| フルバスタチンナトリウム ピタバスタチンカルシウム水和物 | これら薬剤の血中濃度が上昇するおそれがある。これらスタチンによる副作用の発現リスクが高くなるおそれがある。 | グレカプレビル及びピブレンタスビルのOATP1B阻害作用による。 |
| シクロスポリン[16.7.2参照] | グレカプレビル及びピブレンタスビルの血中濃度が上昇するおそれがある。 | シクロスポリンのOATP1B、P-gp及びBCRP阻害作用によるものと考えられる。 |
| ロピナビル・リトナビル[16.7.2参照] | グレカプレビル及びピブレンタスビルの血中濃度が上昇するおそれがある。 | これら薬剤のOATP1B、P-gp又はBCRP阻害作用によるものと考えられる。 |
| ダルナビルエタノール付加物/リトナビル ダルナビルエタノール付加物・コビシスタット[16.7.2参照] | グレカプレビルの血中濃度が上昇するおそれがある。 | これら薬剤のOATP1B、P-gp又はBCRP阻害作用によるものと考えられる。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い異常が認められた場合には投与を中止するなど適切な処置を行うこと。
肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、ビリルビンの上昇等を伴う肝機能障害、黄疸があらわれることがある。[8.2参照]
11.2 その他の副作用
| 5%以上 | 5%未満 | 頻度不明 | |
| 消化器 | 嘔吐 | 悪心、上腹部痛、腹痛 | 腹部膨満 |
| 代謝・栄養 | − | − | 食欲減退 |
| 精神神経 | 頭痛 | − | 傾眠 |
| 皮膚 | − | そう痒、発疹 | 薬疹、血管炎性皮疹、血管性浮腫 |
| 泌尿器・生殖器 | − | − | 蛋白尿 |
| 全身症状 | − | 倦怠感、疲労 | 悪寒、活動性低下、無力症 |
| 臨床検査 | − | − | 血中ビリルビン増加、ALT増加、尿中結晶陽性 |
13. 過量投与
13.1 処置
グレカプレビル及びピブレンタスビルは血液透析ではほとんど除去されない。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 患者用説明文書を用いて、以下の服用方法を説明すること。
・本剤を低水分含量で軟らかい食品に混合し、混合後15分以内に可能な限り速やかに噛まずに飲み込むこと。
・苦みを呈すること、薬剤が急速に溶解して効果の減弱につながるおそれがあることから、液体又は液状の食品との混合は避けること。
・薬剤の吸収に影響を与えるおそれがあることから、本剤を砕かないこと。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与(健康成人)
健康成人(23例)に本剤(300mg/120mg)を食後に単回経口投与したときの薬物動態パラメータを下表に示す5)(外国人データ)。
| パラメータ | グレカプレビル | ピブレンタスビル |
| Cmax(ng/mL) | 621(51) | 213(51) |
| tmax(h) | 3.0(1.5−6.0) | 5.0(3.0−6.0) |
| t1/2(h) | 6.85(1.45) | 14.1(1.38) |
| AUC∞(ng・h/mL) | 2710(50) | 1580(52) |
16.1.2 反復投与(小児C型慢性肝炎患者)
3歳以上12歳未満のC型慢性肝炎患者80例(9例の日本人患者を含む)に、本剤を1日1回食後又は食事とともに反復経口投与したときのグレカプレビル及びピブレンタスビルの定常状態における薬物動態パラメータを母集団薬物動態解析で推定した結果を下表に示す6)。
| 体重区分 | グレカプレビル/ピブレンタスビル用量 | 例数 | AUCtau(ng・h/mL) | Cmax(ng/mL) |
| グレカプレビル | ||||
| 12kg以上 20kg未満 | 150/60mg | 17 | 8493(175) | 1347(188) |
| 20kg以上 30kg未満 | 200/80mg | 20 | 6963(133) | 1109(152) |
| 30kg以上 45kg未満 | 250/100mg | 24 | 7098(140) | 1038(145) |
| ピブレンタスビル | ||||
| 12kg以上 20kg未満 | 150/60mg | 17 | 1820(66) | 201(45) |
| 20kg以上 30kg未満 | 200/80mg | 20 | 1896(57) | 204(41) |
| 30kg以上 45kg未満 | 250/100mg | 24 | 2057(71) | 203(49) |
16.2 吸収
16.2.1 食事の影響
健康成人(15例)に本剤(300mg/120mg)を単回経口投与し、グレカプレビル及びピブレンタスビルの吸収に及ぼす食事の影響を検討した。食事摂取によりグレカプレビル及びピブレンタスビルの曝露量は増加したが、食物中の脂肪含量の影響はごくわずかであった(外国人データ)。本剤は食物中の脂肪含量にかかわらず食後に投与できる7)。
| Cmax | AUC∞ | |
| グレカプレビル | ||
| 中脂肪食 | 2.89(2.36,3.53) | 2.67(2.29,3.10) |
| 高脂肪食 | 2.12(1.73,2.59) | 2.31(1.98,2.68) |
| ピブレンタスビル | ||
| 中脂肪食 | 1.83(1.49,2.26) | 1.56(1.28,1.91) |
| 高脂肪食 | 2.30(1.87,2.83) | 2.14(1.75,2.61) |
16.3 分布
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
HCV非感染の肝機能正常被験者と比較し、軽度肝機能障害患者(Child-Pugh分類A)においてグレカプレビル錠300mg及びピブレンタスビル錠120mg単回経口投与後のグレカプレビルのAUCは1.33倍になり、中等度肝機能障害患者(Child-Pugh分類B)で2倍になり、重度肝機能障害患者(Child-Pugh分類C)では11倍となった。軽度肝機能障害患者においてピブレンタスビルのAUCの増加は0.80倍未満であり、中等度肝機能障害患者で1.26倍であり、重度肝機能障害患者では2.14倍であった11)(外国人データ)。[2.2、9.3.1参照]
| 肝機能障害の程度 | パラメータ | グレカプレビル | ピブレンタスビル |
| 軽度(Child-Pugh分類A) | Cmax | 1.01(0.38,2.70) | 0.84(0.58,1.21) |
| AUC∞ | 1.33(0.49,3.58) | 0.80(0.48,1.34) | |
| 中等度(Child-Pugh分類B) | Cmax | 1.38(0.53,3.59) | 1.26(0.85,1.86) |
| AUC∞ | 2.00(0.76,5.25) | 1.26(0.73,2.16) | |
| 重度(Child-Pugh分類C) | Cmax | 4.78(1.75,13.1) | 0.59(0.41,0.85) |
| AUC∞ | 11.1(4.03,30.8) | 2.14(1.28,3.58) |
16.6.2 腎機能障害患者
HCV非感染の腎機能正常被験者と比較し、軽度(eGFR:60〜89mL/min/1.73m2)、中等度(eGFR:30〜59mL/min/1.73m2)、重度(eGFR:15〜29mL/min/1.73m2)又は透析を要する末期腎不全(eGFR:<15mL/min/1.73m2)患者において、グレカプレビル錠300mg及びピブレンタスビル錠120mg単回経口投与後のグレカプレビル及びピブレンタスビルの曝露量は56%以下の増加率を示した。末期腎不全におけるグレカプレビル及びピブレンタスビルの曝露量に及ぼす透析の影響は18%以下の差であった12)(外国人データ)。
| 腎機能障害の程度 | パラメータ | グレカプレビル | ピブレンタスビル |
| 軽度(eGFR:60〜89) | Cmax | 1.02(0.89,1.17) | 1.06(0.98,1.15) |
| AUC∞ | 1.13(1.01,1.26) | 1.11(1.02,1.20) | |
| 中等度(eGFR:30〜59) | Cmax | 1.05(0.77,1.42) | 1.14(0.95,1.37) |
| AUC∞ | 1.30(1.02,1.66) | 1.25(1.05,1.50) | |
| 重度(eGFR:15〜29) | Cmax | 1.07(0.70,1.64) | 1.20(0.93,1.55) |
| AUC∞ | 1.45(1.03,2.04) | 1.37(1.07,1.77) | |
| 末期(非透析時)(eGFR:<15) | Cmax | 1.08(0.65,1.80) | 1.25(0.92,1.69) |
| AUC∞ | 1.56(1.03,2.35) | 1.46(1.08,1.97) |
16.7 薬物相互作用
16.7.1 in vitro試験
グレカプレビルはP-gp、BCRP及びOATP1B1/1B3の阻害剤である。
ピブレンタスビルはP-gp、BCRP及びOATP1B1の阻害剤である。
グレカプレビルはP-gp、BCRP及びOATP1B1/1B3の基質である。
ピブレンタスビルはP-gpの基質である。[10.参照]
ピブレンタスビルはP-gp、BCRP及びOATP1B1の阻害剤である。
グレカプレビルはP-gp、BCRP及びOATP1B1/1B3の基質である。
ピブレンタスビルはP-gpの基質である。[10.参照]
16.7.2 薬物相互作用臨床試験
[2.3、10.、10.1、10.2参照]
| 併用薬 用量(mg) | グレカプレビル/ピブレンタスビル用量(mg)注) | 例数 | グレカプレビルの薬物動態パラメータ比 併用薬併用/非併用時(90%信頼区間) | |
| AUC | Cmax | |||
| シクロスポリン 100 単回13) | 300/120 QD | 12 | 1.37(1.13,1.66) | 1.30(0.95,1.78) |
| シクロスポリン 400 単回14) | 300/120 単回 | 11 | 5.08(4.11,6.29) | 4.51(3.36,6.05) |
| リファンピシン 600(初回投与)15) | 300/120 単回 | 12 | 8.55(7.01,10.44) | 6.52(5.06,8.41) |
| リファンピシン 600 QD15) | 300/120 単回 | 12 | 1.05(0.75,1.46) | 1.40(0.95,2.06) |
| リファンピシン 600 QD(最終投与から24時間後)15) | 300/120 単回 | 12 | 0.12(0.09,0.15) | 0.14(0.11,0.19) |
| カルバマゼピン 200 BID16) | 300/120 単回 | 10 | 0.34(0.28,0.40) | 0.33(0.27,0.41) |
| アタザナビル/リトナビル 300/100 単回17) | 300/120 QD | 12 | 6.53(5.24,8.14) | 4.06(3.15,5.23) |
| ダルナビル/リトナビル 800/100 QD18) | 300/120 QD | 8 | 4.97(3.62,6.84) | 3.09(2.26,4.20) |
| ロピナビル・リトナビル 400・100 BID19) | 300/120 QD | 9 | 4.38(3.02,6.36) | 2.55(1.84,3.52) |
| ジゴキシン 0.5 単回22) | 400/120 QD | 12 | 1.05(0.83,1.31) | 1.10(0.80,1.50) |
| ダビガトラン 150 単回21) | 300/120 QD | 11 | 0.80(0.69,0.93) | 0.82(0.69,0.97) |
| ラモトリギン 50 単回 | 300/120 QD | 12 | 0.80(0.69,0.92) | 0.75(0.61,0.94) |
| フェロジピン 2.5 単回 | 300/120 QD | 11 | 0.90(0.81,1.01) | 0.86(0.72,1.03) |
| アムロジピン 5 単回 | 300/120 QD | 12 | 0.82(0.75,0.89) | 0.75(0.65,0.87) |
| ロサルタン 50 単回 | 300/120 QD | 12 | 1.00(0.90,1.11) | 0.93(0.78,1.11) |
| バルサルタン 80 単回 | 300/120 QD | 12 | 0.86(0.79,0.93) | 0.85(0.78,0.94) |
| エチニルエストラジオール・norgestimate 35μg・250μg QD24) | 300/120 QD | 9 | 0.95(0.78,1.15) | 1.00(0.85,1.19) |
| ノルエチステロン 0.35 QD | 300/120 QD | 12 | 1.20(1.06,1.35) | 1.31(1.09,1.57) |
| エチニルエストラジオール・レボノルゲストレル 20μg・100μg QD24) | 300/120 QD | 12 | 0.84(0.77,0.92) | 0.87(0.77,0.98) |
| プラバスタチン 10 QD20) | 400/120 QD | 12 | 1.44(1.25,1.67) | 1.59(1.25,2.03) |
| ロスバスタチン 5 QD20) | 400/120 QD | 11 | 1.21(0.98,1.49) | 1.25(0.93,1.67) |
| アトルバスタチン 10 QD20) | 400/120 QD | 11 | 0.97(0.83,1.14) | 0.90(0.70,1.15) |
| シンバスタチン 5 QD23) | 300/120 QD | 12 | 0.91(0.78,1.06) | 0.80(0.65,0.99) |
| Lovastatin 10 QD23) | 300/120 QD | 12 | 1.09(0.91,1.31) | 1.34(0.97,1.85) |
| オメプラゾール 20 QD | 300/120 単回 | 12 | 0.71(0.58,0.86) | 0.78(0.60,1.00) |
| オメプラゾール 40 QD | 300/120 単回 | 12 | 0.49(0.35,0.68) | 0.36(0.21,0.59) |
| タクロリムス 1 単回 | 300/120 QD | 10 | 1.01(0.94,1.08) | 1.07(0.94,1.21) |
| ラルテグラビル 400 BID | 300/120 QD | 12 | 0.93(0.84,1.03) | 0.94(0.78,1.12) |
| リルピビリン 25 QD | 300/120 QD | 11 | 0.90(0.79,1.02) | 0.87(0.74,1.03) |
| エルビテグラビル・コビシスタット・エムトリシタビン・テノホビルアラフェナミド 150・150・200・10 QD | 300/120 QD | 11 | 3.05(2.55,3.64) | 2.50(2.08,3.00) |
| アバカビル・ドルテグラビル・ラミブジン 600・50・300 QD | 300/120 QD | 12 | 0.75(0.69,0.83) | 0.74(0.64,0.86) |
| ソホスブビル 400 QD | 400/120 QD | 8 | 0.99(0.80,1.24) | 0.98(0.75,1.29) |
| 併用薬 用量(mg) | グレカプレビル/ピブレンタスビル用量(mg)注) | 例数 | ピブレンタスビルの薬物動態パラメータ比 併用薬併用/非併用時(90%信頼区間) | |
| AUC | Cmax | |||
| シクロスポリン 100 単回13) | 300/120 QD | 12 | 1.22(1.10,1.36) | 1.11(0.92,1.33) |
| シクロスポリン 400 単回14) | 300/120 単回 | 11 | 1.93(1.78,2.09) | 1.22(1.08,1.38) |
| リファンピシン 600(初回投与)15) | 300/120 単回 | 12 | 1.04(0.89,1.22) | 0.91(0.76,1.10) |
| リファンピシン 600 QD15) | 300/120 単回 | 12 | 0.17(0.14,0.21) | 0.21(0.16,0.27) |
| リファンピシン 600 QD(最終投与から24時間後)15) | 300/120 単回 | 12 | 0.13(0.11,0.15) | 0.17(0.14,0.20) |
| カルバマゼピン 200 BID16) | 300/120 単回 | 10 | 0.49(0.43,0.55) | 0.50(0.42,0.59) |
| アタザナビル/リトナビル 300/100 単回17) | 300/120 QD | 12 | 1.64(1.48,1.82) | 1.29(1.15,1.45) |
| ダルナビル/リトナビル 800/100 QD18) | 300/120 QD | 8 | 1.16(0.98,1.36) | 0.85(0.75,0.96) |
| ロピナビル・リトナビル 400・100 BID19) | 300/120 QD | 9 | 2.46(2.07,2.92) | 1.40(1.17,1.67) |
| ジゴキシン 0.5 単回22) | 400/120 QD | 12 | 1.08(1.02,1.14) | 1.16(1.07,1.27) |
| ダビガトラン 150 単回21) | 300/120 QD | 11 | 0.91(0.83,0.99) | 0.86(0.78,0.96) |
| ラモトリギン 50 単回 | 300/120 QD | 12 | 0.98(0.92,1.03) | 0.91(0.83,0.99) |
| フェロジピン 2.5 単回 | 300/120 QD | 11 | 1.02(0.94,1.11) | 0.97(0.86,1.10) |
| アムロジピン 5 単回 | 300/120 QD | 12 | 1.02(0.97,1.08) | 0.99(0.93,1.05) |
| ロサルタン 50 単回 | 300/120 QD | 12 | 1.02(0.95,1.10) | 1.15(1.03,1.29) |
| バルサルタン 80 単回 | 300/120 QD | 12 | 0.92(0.85,1.00) | 0.97(0.87,1.08) |
| エチニルエストラジオール・norgestimate 35μg・250μg QD24) | 300/120 QD | 9 | 0.92(0.82,1.02) | 1.00(0.92,1.10) |
| ノルエチステロン 0.35 QD | 300/120 QD | 12 | 0.95(0.88,1.02) | 1.00(0.92,1.09) |
| エチニルエストラジオール・レボノルゲストレル 20μg・100μg QD24) | 300/120 QD | 12 | 0.83(0.77,0.90) | 0.85(0.78,0.93) |
| プラバスタチン 10 QD20) | 400/120 QD | 12 | 1.23(1.13,1.35) | 1.24(1.13,1.37) |
| ロスバスタチン 5 QD20) | 400/120 QD | 11 | 1.20(1.12,1.29) | 1.23(1.11,1.37) |
| アトルバスタチン 10 QD20) | 400/120 QD | 11 | 1.09(0.96,1.23) | 1.05(0.91,1.21) |
| シンバスタチン 5 QD23) | 300/120 QD | 12 | 1.10(0.93,1.30) | 0.96(0.79,1.17) |
| Lovastatin 10 QD23) | 300/120 QD | 12 | 0.98(0.91,1.05) | 0.99(0.87,1.13) |
| オメプラゾール 20 QD | 300/120 単回 | 12 | 0.97(0.80,1.18) | 1.00(0.83,1.22) |
| オメプラゾール 40 QD | 300/120 単回 | 12 | 1.15(0.94,1.40) | 0.85(0.70,1.03) |
| タクロリムス 1 単回 | 300/120 QD | 10 | 1.01(0.93,1.10) | 0.98(0.87,1.11) |
| ラルテグラビル 400 BID | 300/120 QD | 12 | 0.99(0.92,1.07) | 1.01(0.94,1.07) |
| リルピビリン 25 QD | 300/120 QD | 11 | 0.96(0.89,1.05) | 0.97(0.89,1.05) |
| エルビテグラビル・コビシスタット・エムトリシタビン・テノホビルアラフェナミド 150・150・200・10 QD | 300/120 QD | 11 | 1.57(1.39,1.76) | 1.24(1.11,1.39) |
| アバカビル・ドルテグラビル・ラミブジン 600・50・300 QD | 300/120 QD | 12 | 0.72(0.65,0.79) | 0.74(0.66,0.83) |
| ソホスブビル 400 QD | 400/120 QD | 8 | 1.04(0.89,1.22) | 0.99(0.82,1.20) |
| 併用薬 用量(mg) | グレカプレビル/ピブレンタスビル用量(mg)注) | 例数 | 併用薬の薬物動態パラメータ比 本剤併用/非併用時(90%信頼区間) | |
| AUC | Cmax | |||
| アトルバスタチン 10 QD20) | 400/120 QD | 11 | 8.28(6.06,11.3) | 22.0(16.4,29.6) |
| ダビガトラン 150 単回21) | 300/120 QD | 11 | 2.38(2.11,2.70) | 2.05(1.72,2.44) |
| ジゴキシン 0.5 単回22) | 400/120 QD | 12 | 1.48(1.40,1.57) | 1.72(1.45,2.04) |
| プラバスタチン 10 QD20) | 400/120 QD | 12 | 2.30(1.91,2.76) | 2.23(1.87,2.65) |
| ロスバスタチン 5 QD20) | 400/120 QD | 11 | 2.15(1.88,2.46) | 5.62(4.80,6.59) |
| シンバスタチン 5 QD23) | 300/120 QD | 12 | 2.32(1.93,2.79)a 4.48(3.11,6.46)b | 1.99(1.60,2.48)a 10.7(7.88,14.6)b |
| Lovastatin 10 QD23) | 300/120 QD | 12 | 1.70(1.40,2.06)c 4.10(3.45,4.87)d | 1.17(0.97,1.42)c 5.73(4.65,7.07)d |
| エチニルエストラジオール・norgestimate 35μg・250μg QD24) | 300/120 QD | 11 | 1.28(1.23,1.32)e 1.63(1.50,1.76)f 1.44(1.34,1.54)g | 1.31(1.24,1.38)e 1.54(1.34,1.76)f 1.24(1.08,1.41)g |
| ノルエチステロン 0.35 単回 | 300/120 QD | 12 | 0.94(0.84,1.04) | 0.83(0.74,0.95) |
| エチニルエストラジオール・レボノルゲストレル 20μg・100μg QD24) | 300/120 QD | 12 | 1.40(1.33,1.48)e 1.68(1.57,1.80)f | 1.30(1.18,1.44)e 1.37(1.23,1.52)f |
| カフェイン/tolbutamide/オメプラゾール/ミダゾラム/デキストロメトルファン臭化水素酸塩 100/500/20/1/30 単回 | 300/120 単回 | 12 | 1.35(1.23,1.48)h 1.10(1.03,1.18)i 1.03(0.99,1.07)j 0.79(0.70,0.90)k | 1.02(0.97,1.70)h 0.93(0.88,0.98)i 0.92(0.87,0.97)j 0.57(0.43,0.75)k |
| 9 | 0.84(0.75,0.94)l | 0.61(0.46,0.81)l | ||
| 12 | 1.27(1.11,1.45)m 1.34(1.21,1.48)n 0.75(0.66,0.85)o 1.32(1.21,1.40)p | 1.03(0.91,1.17)m 1.11(0.92,1.32)n 0.70(0.61,0.81)o 1.10(0.96,1.25)p | ||
| ラモトリギン 50 単回 | 300/120 QD | 12 | 0.96(0.88,1.04) | 0.98(0.94,1.02) |
| カルバマゼピン 200 BID16) | 300/120 単回 | 10 | 1.02(0.99,1.05)q 1.05(1.03,1.07)r | 0.98(0.95,1.02)q 1.04(0.98,1.10)r |
| リファンピシン 600 QD15) | 300/120 単回 | 12 | 1.13(1.05,1.21) | 1.18(1.05,1.32) |
| フェロジピン 2.5 単回 | 300/120 QD | 11 | 1.31(1.08,1.58) | 1.31(1.05,1.62) |
| アムロジピン 5 単回 | 300/120 QD | 12 | 1.21(1.09,1.34) | 1.22(1.07,1.39) |
| ロサルタン 50 単回 | 300/120 QD | 12 | 1.56(1.28,1.89)s 1.14(1.04,1.25)t | 2.51(2.00,3.15)s 2.18(1.88,2.53)t |
| バルサルタン 80 単回 | 300/120 QD | 12 | 1.31(1.16,1.49) | 1.36(1.17,1.58) |
| メサドン 20-120 QD | 300/120 QD | 11 | 1.02(0.98,1.06)u 1.05(1.01,1.09)v | 0.96(0.91,1.02)u 0.98(0.93,1.03)v |
| ブプレノルフィン/ナロキソン 6/24 QD | 300/120 QD | 12 | 1.17(1.08,1.27)w 1.07(0.90,1.28)x 1.30(1.19,1.42)y | 1.08(0.97,1.19)w 0.88(0.74,1.06)x 1.25(1.17,1.34)y |
| シクロスポリン 400 単回14) | 300/120 単回 | 11 | 1.01(0.95,1.09) | 0.94(0.82,1.08) |
| タクロリムス 1 単回 | 300/120 QD | 10 | 1.45(1.24,1.70) | 1.50(1.25,1.82) |
| ラルテグラビル 400 BID | 300/120 QD | 12 | 1.47(1.15,1.87) | 1.34(0.89,1.98) |
| リルピビリン 25 QD | 300/120 QD | 12 | 1.84(1.72,1.98) | 2.05(1.73,2.43) |
| ダルナビル/リトナビル 800/100 QD18) | 300/120 QD | 12 | 1.29(1.18,1.42)z 1.87(1.74,2.02)a1 | 1.30(1.21,1.40)z 2.03(1.78,2.32)a1 |
| ロピナビル・リトナビル 400・100 BID19) | 300/120 QD | 9 | 1.24(1.14,1.34)b1 1.23(1.10,1.38)a1 | 1.11(1.01,1.23)b1 1.17(0.95,1.45)a1 |
| アタザナビル/リトナビル 300/100 単回17) | 300/120 QD | 11 | 1.11(1.03,1.19)c1 1.30(1.21,1.40)a1 | 1.00(0.90,1.10)c1 1.21(1.05,1.38)a1 |
| エファビレンツ・エムトリシタビン・テノホビルジソプロキシルフマル酸 600・200・300 QD | 300/120 QD | 12 | 1.03(0.99,1.06)d1 1.07(1.02,1.12)d2 1.29(1.23,1.35)d3 | 1.06(0.97,1.14)d1 1.04(0.95,1.14)d2 1.22(1.08,1.38)d3 |
| エルビテグラビル・コビシスタット・エムトリシタビン・テノホビルアラフェナミド 150・150・200・10 QD | 300/120 QD | 12 | 1.47(1.37,1.57)e1 1.42(1.32,1.52)e2 1.12(1.09,1.16)e3 1.06(0.99,1.13)d3 | 1.36(1.24,1.49)e1 1.29(1.22,1.38)e2 1.07(1.00,1.14)e3 1.04(0.99,1.09)d3 |
| アバカビル・ドルテグラビル・ラミブジン 600・50・300 QD | 300/120 QD | 12 | 1.05(0.99,1.10)f1 1.13(1.05,1.21)f2 1.03(0.97,1.09)f3 | 0.96(0.89,1.05)f1 1.10(1.01,1.19)f2 0.99(0.90,1.10)f3 |
| ソホスブビル 400 QD | 400/120 QD | 8 | 2.25(1.86,2.72)g1 1.21(1.13,1.29)g2 | 1.66(1.23,2.22)g1 0.85(0.76,0.96)g2 |
注)本剤の最大承認用量は3歳以上12歳未満の小児に対しグレカプレビル250mg及びピブレンタスビル100mg配合顆粒を1日1回である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第II/III相試験(小児、配合顆粒)
M16-123試験(パート2)
未治療又はインターフェロン製剤既治療の3歳以上12歳未満のC型慢性肝炎又はC型代償性肝硬変患者(ジェノタイプ1、2、3、4、5又は6)を対象とした非盲検非対照試験を実施した。初期用量(グレカプレビル120〜200mg・ピブレンタスビル45〜75mg)又は承認された用量が投与された。治験薬投与終了から12週間後まで血中HCVの陰性化(HCV RNA量が定量下限未満)が持続している患者の割合(SVR12率)は96.3%(77/80例)であった。承認用量が投与された被験者におけるSVR12率は98.4%(61/62例)であった。各部分集団におけるSVR12率は下表のとおりであった。DAA既治療患者、C型代償性肝硬変患者、ジェノタイプ5又は6の患者は組み入れられなかった。
| ジェノタイプ | DAA既治療 | SVR12率 | ||
| 全体集団注) | 日本人 | 外国人注) | ||
| ジェノタイプ1 | あり | − | − | − |
| なし§ | 98.3(57/58) | 100(6/6) | 98.1(51/52) | |
| ジェノタイプ2 | あり | − | − | − |
| なし§ | 100(2/2) | 100(2/2) | − | |
| ジェノタイプ3 | あり | − | − | − |
| なし§ | 88.9(16/18) | 100(1/1) | 88.2(15/17) | |
| ジェノタイプ4 | あり | − | − | − |
| なし§ | 100(2/2) | − | 100(2/2) | |
副作用は80例中23例(28.8%)で発現した。主な副作用は疲労、嘔吐及び頭痛で各6例(7.5%)等であった25)。
注)3歳以上12歳未満の小児における本剤の承認用量はグレカプレビル・ピブレンタスビル配合顆粒を体重区分別に150mg/60mg(12kg以上20kg未満)、200mg/80mg(20kg以上30kg未満)及び250mg/100mg(30kg以上45kg未満)、1日1回である。
17.3 その他
17.3.1 QT間隔に対する影響
健康成人(48例)を対象に、グレカプレビル錠(600mgまで)及びピブレンタスビル錠(240mgまで)注)のQTc間隔に及ぼす影響をモキシフロキサシン(400mg)陽性対照のTQT試験で検討した。グレカプレビル及びピブレンタスビルはQTc間隔を延長しなかった26)(外国人データ)。
注)本剤の最大承認用量は3歳以上12歳未満の小児に対しグレカプレビル250mg及びピブレンタスビル100mg配合顆粒を1日1回である。
18. 薬効薬理
18.1 作用機序
18.2 抗ウイルス活性
グレカプレビルは、遺伝子組換えHCVジェノタイプ1a、1b、2a、2b、3a、4a、5a及び6aのNS3/4Aプロテアーゼを阻害した(IC50値は3.5〜11.3nmol/L)。グレカプレビルは、HCVジェノタイプ1a、1b、2a、2b、3a、4a及び6aのHCVレプリコン細胞においてRNA複製を阻害した(EC50値は0.85〜4.6nmol/L)。グレカプレビルは臨床分離株由来のHCVジェノタイプ1a、1b、2a、2b、3a、4a、4d及び5aのHCV NS3領域含有HCVレプリコン細胞において、RNA複製を阻害した(EC50値は0.05〜3.8nmol/L)27)29)。
ピブレンタスビルは、HCVジェノタイプ1a、1b、2a、2b、3a、4a、5a、6a及び3bのHCVレプリコン細胞においてRNA複製を阻害した(EC50値は1.4〜4.3及び15.6pmol/L)。ピブレンタスビルは、臨床分離株由来のHCVジェノタイプ1a、1b、2a、2b、3a、4a、4b、4d、5a、6a、6e及び6pのHCV NS5A領域含有HCVレプリコン細胞においてRNA複製を阻害した(EC50値は0.27〜3.5pmol/L)28)29)30)。
グレカプレビル及びピブレンタスビルは、HCVジェノタイプ1a又は1bレプリコン細胞に対して、相加又は相乗的な抗ウイルス活性を示した31)(in vitro)。
18.3 薬剤耐性
NS3/4Aプロテアーゼ阻害剤の抗ウイルス活性に影響するアミノ酸変異を組み込んだHCVレプリコン細胞を用いた検討において、グレカプレビルの抗ウイルス活性が1/5以下となったアミノ酸変異は、HCVジェノタイプ1a、1b、2a、2b、3a及び4aにおける156位の変異、HCVジェノタイプ3aにおける80位の変異、並びにHCVジェノタイプ1a、1b、3a、4a及び6aにおける168位の変異であった。HCVジェノタイプ5におけるグレカプレビルに対する耐性変異については、未検討である。
NS5A阻害剤の抗ウイルス活性に影響するアミノ酸変異を組み込んだHCVレプリコン細胞を用いた検討において、ピブレンタスビルの抗ウイルス活性が1/5以下となったアミノ酸変異は、HCVジェノタイプ1aにおける28位、30位、62位及び93位の変異、及びHCVジェノタイプ1bにおける32位の欠損であった32)(in vitro)。
国内第III相試験でグレカプレビル・ピブレンタスビル配合錠を投与されたDAA未治療のC型慢性肝炎患者又はC型代償性肝硬変患者(HCVジェノタイプ1又は2)において、ウイルス学的治療不成功例はみられなかった。DAA未治療のHCVジェノタイプ3のC型慢性肝炎患者において、ウイルス学的治療不成功例が2例認められ、NS3領域の解析はできなかったが、NS5A領域の解析で、1例は、投与前後にG92E、投与後にL28F及びY93Hが認められ、もう1例は、投与前後にV31M、投与後にY93Hが認められた。DAA既治療のC型慢性肝炎又はC型代償性肝硬変患者(HCVジェノタイプ1b)において、ウイルス学的治療不成功例2例のうち1例は、投与前にNS3領域のY56F及びS122G、投与前後にNS3領域のD168V及びNS5A領域のP32L及びP32欠損、投与後にNS3領域のA156D/A156Vが認められ、もう1例は、投与前後にNS3領域のY56F、Q80L及びV170I並びにNS5A領域のL31F及びP32欠損が認められた33)。
海外試験の併合解析の結果、HCVジェノタイプ3の患者においてNS5A領域のA30Kに関連するSVR12率の低下が認められ、HCVジェノタイプ4、5又は6の患者においては、ウイルス学的治療不成功例はみられなかった34)。
18.4 交差耐性
他のNS3/4Aプロテアーゼ阻害剤と同様にNS3/4領域の80、156又は168位のアミノ酸変異に対して、グレカプレビルの抗ウイルス活性の低下が認められた。他のNS5A阻害剤に耐性を示すNS5A領域の24、28、30、31又は58位のアミノ酸変異に対して、ピブレンタスビルの抗ウイルス活性を保持していた。グレカプレビルは、NS5A阻害剤の耐性に関連したアミノ酸変異及びNS5Bポリメラーゼ阻害剤の耐性に関連したアミノ酸変異に対して、抗ウイルス活性を保持していた。ピブレンタスビルは、NS3/4Aプロテアーゼ阻害剤の耐性に関連したアミノ酸変異及びNS5Bポリメラーゼ阻害剤の耐性に関連したアミノ酸変異に対して、抗ウイルス活性を保持していた35)(in vitro)。
19. 有効成分に関する理化学的知見
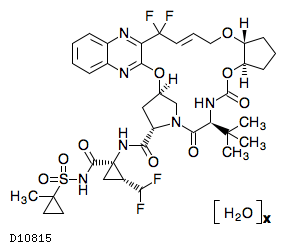
19.1. グレカプレビル水和物
19.2. ピブレンタスビル
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<マヴィレット配合顆粒小児用>
28包[1包×28]
23. 主要文献
- 社内資料:ラット出生前・出生後発達試験(2017年9月27日承認,CTD2.6.6.6)
- 社内資料:マウス出生前・出生後発達試験(2017年9月27日承認,CTD2.6.6.6)
- 社内資料:ラット乳汁分泌及び授乳中,妊娠ラット組織分布試験(2017年9月27日承認,CTD2.6.4.4,2.6.4.6)
- 社内資料:ラット乳汁代謝物プロファイル(2017年9月27日承認,CTD2.6.4.6)
- 社内資料:配合顆粒のバイオアベイラビリティ及び食事の影響
- 社内資料:ジェノタイプ1〜6感染3〜12歳小児被験者(第II/III相試験)の母集団薬物動態解析
- 社内資料:第I相試験食事の影響(外国人)
- 社内資料:グレカプレビル吸収・分布・代謝・排泄試験(2017年9月27日承認,CTD2.7.2.3)
- 社内資料:ピブレンタスビル吸収・分布・代謝・排泄試験(2017年9月27日承認,CTD2.7.2.3)
- 社内資料:薬物動態概要(2017年9月27日承認,CTD2.6.4.5,2.6.4.6)
- 社内資料:肝機能障害患者における試験(2017年9月27日承認,CTD2.7.2.2,2.7.2.3)
- 社内資料:腎機能障害患者における試験(2017年9月27日承認,CTD2.7.2.2,2.7.2.3)
- 社内資料:シクロスポリン(100mg単回投与)との薬物相互作用試験(2017年9月27日承認,CTD2.7.2.2)
- 社内資料:シクロスポリン(400mg単回投与)との薬物相互作用試験(2017年9月27日承認,CTD2.7.2.2)
- 社内資料:リファンピシンとの薬物相互作用試験(2017年9月27日承認,CTD2.7.2.2)
- 社内資料:カルバマゼピンとの薬物相互作用試験(2017年9月27日承認,CTD2.7.2.2)
- 社内資料:アタザナビル(リトナビル併用)との薬物相互作用試験(2017年9月27日承認,CTD2.7.2.2)
- 社内資料:ダルナビル(リトナビル併用)との薬物相互作用試験(2017年9月27日承認,CTD2.7.2.2)
- 社内資料:ロピナビル・リトナビルとの薬物相互作用試験(2017年9月27日承認,CTD2.7.2.2)
- 社内資料:アトルバスタチン,プラバスタチン,ロスバスタチンとの薬物相互作用試験(2017年9月27日承認,CTD2.7.2.2)
- 社内資料:ダビガトランとの薬物相互作用試験(2017年9月27日承認,CTD2.7.2.2)
- 社内資料:ジゴキシンとの薬物相互作用試験(2017年9月27日承認,CTD2.7.2.2)
- 社内資料:シンバスタチン及びlovastatinとの薬物相互作用試験(2017年9月27日承認,CTD2.7.2.2)
- 社内資料:エチニルエストラジオール・norgestimate及びエチニルエストラジオール・レボノルゲストレルとの薬物相互作用試験(2017年9月27日承認,CTD2.7.2.2)
- 社内資料:ジェノタイプ1〜6感染3〜12歳小児被験者での薬物動態・安全性・有効性評価のための国際共同試験(第II/III相試験)
- 社内資料:Thorough QT試験(2017年9月27日承認,CTD2.7.6)
- 社内資料:グレカプレビル作用機序(2017年9月27日承認,CTD2.6.2.1)
- 社内資料:ピブレンタスビル作用機序(2017年9月27日承認,CTD2.6.2.1)
- 社内資料:グレカプレビル及びピブレンタスビルin vitro有効性試験(2017年9月27日承認,CTD2.6.2.2)
- Krishnan P.,et al., Antimicrob.Agents Chemother., 62, e01249-18, (2018) »PubMed
- 社内資料:グレカプレビル・ピブレンタスビルin vitro有効性試験(2017年9月27日承認,CTD2.6.2.2)
- 社内資料:in vitro薬剤耐性試験(2017年9月27日承認,CTD2.6.2.2)
- 社内資料:日本人被験者での有効性・安全性試験(第III相試験)(2017年9月27日承認,CTD2.7.3.5.2)
- 社内資料:ジェノタイプ1〜6感染被験者での海外有効性・安全性試験(第II相試験及び第III相試験)(2017年9月27日承認,CTD2.7.3.5.2)
- 社内資料:in vitro交差耐性試験(2017年9月27日承認,CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
アッヴィ合同会社
くすり相談室
〒108-0023
東京都港区芝浦3-1-21
電話:フリーダイヤル 0120-587-874
製品情報問い合わせ先
アッヴィ合同会社
くすり相談室
〒108-0023
東京都港区芝浦3-1-21
電話:フリーダイヤル 0120-587-874
26. 製造販売業者等
26.1 製造販売元
アッヴィ合同会社
東京都港区芝浦3-1-21