医薬品情報
| 総称名 | フルツロン |
|---|---|
| 一般名 | ドキシフルリジン |
| 欧文一般名 | Doxifluridine |
| 薬効分類名 | 抗悪性腫瘍剤 |
| 薬効分類番号 | 4223 |
| KEGG DRUG |
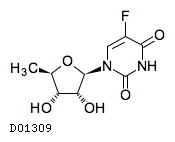
D01309
ドキシフルリジン
|
| KEGG DGROUP |
DG02018
代謝拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年7月 改訂(第1版)

|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| フルツロンカプセル200 | FURTULON Capsules | 太陽ファルマ | 4223004M2023 | 162.9円/カプセル | 劇薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し重篤な過敏症の既往歴のある患者
2.2 テガフール・ギメラシル・オテラシルカリウム配合剤投与中の患者及び投与中止後7日以内の患者[1.、10.1参照]
4. 効能または効果
6. 用法及び用量
通常、1日量としてドキシフルリジン800〜1200mgを3〜4回に分けて経口投与する。なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
8.1 骨髄機能抑制等の重篤な副作用が起こることがあるので、定期的(特に投与初期は頻回)に臨床検査(血液検査、肝機能・腎機能検査等)を行うなど、患者の状態を十分に観察すること。[9.1.1、9.1.2、11.1.3参照]
8.2 感染症・出血傾向の発現又は悪化に十分注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨髄機能抑制のある患者
9.1.2 感染症を合併している患者
9.1.3 心疾患又はその既往歴のある患者
症状が悪化するおそれがある。
9.1.4 消化管潰瘍又は出血のある患者
症状が悪化するおそれがある。
9.1.5 水痘患者
致命的な全身障害があらわれるおそれがある。
9.2 腎機能障害患者
副作用が強くあらわれるおそれがある。
9.3 肝機能障害患者
副作用が強くあらわれるおそれがある。
9.4 生殖能を有する者
小児及び生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。ラットで、胎児に骨格変異、化骨遅延等(50mg/kg/日以上)が報告されている。
9.6 授乳婦
授乳を避けさせること。ラットで乳汁中への移行が報告されている。
9.7 小児等
副作用の発現に特に注意し、慎重に投与すること。小児等を対象とした臨床試験は実施していない。
9.8 高齢者
慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
10.1 併用禁忌
| テガフール・ギメラシル・オテラシルカリウム配合剤 (ティーエスワン)[1.、2.2参照] | 早期に重篤な血液障害や下痢、口内炎等の消化管障害等が発現するおそれがあるので、テガフール・ギメラシル・オテラシルカリウム配合剤投与中及び投与中止後少なくとも7日以内は本剤を投与しないこと。 | ギメラシルがフルオロウラシルの異化代謝を阻害し、血中フルオロウラシル濃度が著しく上昇する。 |
10.2 併用注意
| 他の抗悪性腫瘍剤 | 血液障害、消化管障害等の副作用が増強することがあるので、患者の状態を十分に観察すること。異常が認められた場合には、減量、休薬等の適切な処置を行うこと。 | 副作用が相互に増強される。 |
| フェニトイン | めまい、眼振、運動失調等のフェニトイン中毒があらわれることがある。 | 機序は不明であるが、フェニトインの血中濃度が上昇する。 |
| ワルファリンカリウム | ワルファリンカリウムの作用を増強し出血傾向があらわれることがあるので、凝固能の変動に注意すること。 | 機序は不明である。 |
| トリフルリジン・チピラシル塩酸塩配合剤 | 副作用が増強するおそれがある。 | フッ化ピリミジン系抗悪性腫瘍剤の代謝に影響を及ぼす可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 脱水症状(頻度不明)
激しい下痢(初期症状:腹痛、頻回の軟便等)があらわれ、脱水症状まで至ることがある。このような症状があらわれた場合には投与を中止し、補液等の適切な処置を行うこと。
11.1.2 急性腎不全(頻度不明)
激しい下痢、脱水等が原因の循環不全により、虚血性急性腎不全を起こすことがある。激しい下痢、脱水等があらわれた時は投与を中止し、輸液投与等適切な処置をすること。
11.1.3 骨髄機能抑制、溶血性貧血(いずれも頻度不明)
11.1.4 重篤な腸炎(頻度不明)
出血性腸炎、虚血性腸炎、壊死性腸炎等(初期症状:腹痛、頻回の軟便、下痢等)があらわれることがある。激しい腹痛・下痢等の症状があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.5 重篤な精神神経障害(白質脳症等)
健忘、歩行障害、知覚障害、錐体外路症状、口のもつれ、舌のもつれ、意識障害、麻痺、尿失禁(いずれも頻度不明)が、指南力低下、構音障害(いずれも0.1%未満)等があらわれることがある。また、上記の症状が白質脳症の初期症状としてあらわれることがある。
11.1.6 間質性肺炎(頻度不明)
間質性肺炎(初期症状:咳嗽、息切れ、呼吸困難、発熱等)があらわれることがある。
11.1.7 心不全(頻度不明)
11.1.8 肝障害、黄疸(いずれも頻度不明)
劇症肝炎等の重篤な肝障害、黄疸があらわれることがある。
11.1.9 急性膵炎(頻度不明)
血清アミラーゼ上昇、腹痛等の異常が認められた場合には、投与を中止するなど適切な処置を行うこと。
11.1.10 嗅覚脱失(頻度不明)
嗅覚障害があらわれ、嗅覚脱失まで至ることがある。
11.1.11 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(いずれも頻度不明)
11.1.12 肝硬変(長期投与時)(頻度不明)
11.1.13 安静狭心症、心筋梗塞、不整脈(心室性頻拍等を含む)(いずれも頻度不明)
11.1.14 ネフローゼ症候群(頻度不明)
11.1.15 ショック、アナフィラキシー(いずれも頻度不明)
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 肝臓 | ビリルビンの上昇 | AST、ALT、ALPの上昇 | ||
| 腎臓 | BUN上昇、血尿、蛋白尿 | 頻尿 | ||
| 消化器 | 下痢(25.3%)、食欲不振(11.4%)、悪心・嘔吐(12.6%) | 腹痛 | 麻痺性イレウス、口内炎、腹部膨満感、心窩部痛、口渇、口唇炎、便秘 | 消化管出血、舌炎、口角炎、胃潰瘍、胸やけ |
| 精神神経系 | 倦怠感、ふらつき | 眠気、頭痛、味覚異常、舌しびれ、耳鳴 | ||
| 皮膚 | 色素沈着 | 掻痒感、脱毛 | 皮膚炎、光線過敏症、紅斑、爪異常 | |
| 過敏症 | 発疹 | 湿疹、蕁麻疹 | ||
| 循環器 | 胸部圧迫感 | 心悸亢進、不整脈、心電図異常(ST上昇、QT延長、T波逆転) | ||
| その他 | 発熱、咽頭異和感、眼精疲労 | 女性化乳房、浮腫 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 フルオロウラシル系薬剤と他の抗悪性腫瘍剤を併用した患者に、急性白血病(前白血病相を伴う場合もある)、骨髄異形成症候群(MDS)が発生したとの報告がある。
15.1.2 フルオロウラシルの異化代謝酵素であるジヒドロピリミジンデヒドロゲナーゼ(DPD)欠損等の患者がごくまれに存在し、このような患者にフルオロウラシル系薬剤を投与した場合、投与初期に重篤な副作用(口内炎、下痢、血液障害、神経障害等)が発現するとの報告がある。
15.2 非臨床試験に基づく情報
15.2.1 ドキシフルリジンをイヌに経口投与(10mg/kg以上)した場合、脳実質内に多孔性変化、脳・脊髄に小出血巣が認められたとの報告がある。
16. 薬物動態
16.1 血中濃度
悪性腫瘍患者4例にドキシフルリジンとして800mgを単回経口投与※したとき、未変化体の血清中濃度は1〜2時間後に最高値約1μg/mLに達し、以後速やかに低下した。また、5-FU濃度も1時間後に最高値に達したが、その濃度は未変化体の約1/10と低値であった1)
※承認された用法・用量は1日800〜1200mg、分3〜4である。
図 単回投与後の血清中濃度
16.3 分布
16.4 代謝
ドキシフルリジンは腫瘍組織で高い活性を有する酵素、ピリミジンヌクレオシドホスホリラーゼにより5-FUと5-デオキシ-D-リボース-1-リン酸に分解される6)。
16.5 排泄
悪性腫瘍患者6例にドキシフルリジンとして800mgを単回経口投与※したとき、投与後12時間までの主な尿中排泄物は、未変化体、5-FU及びその代謝物、5-デオキシ-D-リビトールであった7)。
※承認された用法・用量は1日800〜1200mg、分3〜4である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍効果
18.3 免疫機能に及ぼす影響
19. 有効成分に関する理化学的知見
19.1. ドキシフルリジン
22. 包装
フルツロンカプセル200
100カプセル(PTP10カプセル×10)
500カプセル(PTP10カプセル×50)
23. 主要文献
- 原 泰寛,et al., 癌と化学療法, 11, 2261-2266, (1984) »PubMed
- 中尾 功,et al., 癌と化学療法, 12, 2037-2043, (1985) »PubMed
- 前田治伸,et al., 癌と化学療法, 18, 965-969, (1991) »PubMed
- 野田起一郎,et al., 癌と化学療法, 18, 2551-2555, (1991) »PubMed
- 大森弘之,et al., 癌と化学療法, 18, 2307-2314, (1991) »PubMed
- Ishitsuka,H.,et al., Gann., 71, 112-123, (1980) »PubMed
- 小田切脩,et al., 薬理と治療, 15, 3257-3261, (1987)
- 仁井谷久暢,et al., 癌と化学療法, 12, 2044-2051, (1985) »PubMed
- 野田起一郎,et al., 癌と化学療法, 18, 2557-2565, (1991) »PubMed
- 窪田吉信,et al., 癌と化学療法, 18, 2301-2306, (1991) »PubMed
- 三輪昌敬,et al., 癌と化学療法, 14, 2924-2929, (1987) »PubMed
- Kono,A.,et al., Chem.Pharm.Bull., 31, 175-178, (1983) »PubMed
- Bosch,L.,et al., Cancer Res., 18, 335-343, (1958) »PubMed
- Spiegelman,S.,et al., Cancer., 45, 1129-1134, (1980) »PubMed
- Uehara,N.,et al., Jap.J.Cancer Res., 76, 1034-1041, (1985) »PubMed
- 三輪昌敬,et al., 癌と化学療法, 15, 1755-1763, (1988) »PubMed
- 藤田史子,et al., 癌と化学療法, 11, 1635-1643, (1984) »PubMed
- 三輪昌敬,et al., 癌と化学療法, 18, 1579-1586, (1991) »PubMed
- 二宮康行,et al., 癌と化学療法, 15, 1747-1754, (1988) »PubMed
- Bollag,W.,et al., Eur.J.Cancer., 16, 427-432, (1980)
24. 文献請求先及び問い合わせ先
文献請求先
製品情報問い合わせ先
26. 製造販売業者等
26.1 製造販売元
太陽ファルマ株式会社
東京都千代田区丸の内1-6-5