医薬品情報
| 総称名 | オロパタジン塩酸塩 |
|---|---|
| 一般名 | オロパタジン塩酸塩 |
| 欧文一般名 | Olopatadine Hydrochloride |
| 製剤名 | オロパタジン塩酸塩口腔内崩壊錠 |
| 薬効分類名 | アレルギー性疾患治療剤 |
| 薬効分類番号 | 4490 |
| ATCコード | R01AC08 |
| KEGG DRUG |
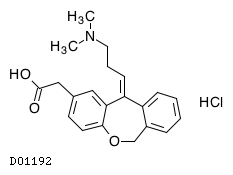
D01192
オロパタジン塩酸塩
|
| KEGG DGROUP |
DG01482
ヒスタミンH1受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年9月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 12.臨床検査結果に及ぼす影響 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オロパタジン塩酸塩OD錠2.5mg「NIG」 (後発品) | Olopatadine Hydrochloride OD Tablets | 日医工岐阜工場 | 4490025F3204 | 10.4円/錠 | |
| オロパタジン塩酸塩OD錠5mg「NIG」 (後発品) | Olopatadine Hydrochloride OD Tablets | 日医工岐阜工場 | 4490025F4200 | 10.4円/錠 |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
成人
通常、成人には1回オロパタジン塩酸塩として5mgを朝及び就寝前の1日2回経口投与する。なお、年齢、症状により適宜増減する。
小児
通常、7歳以上の小児には1回オロパタジン塩酸塩として5mgを朝及び就寝前の1日2回経口投与する。
8. 重要な基本的注意
<効能共通>
8.1 眠気を催すことがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作には従事させないよう十分注意すること。
8.2 効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
<アレルギー性鼻炎>
8.3 季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 長期ステロイド療法を受けている患者
本剤投与によりステロイド減量を図る場合には十分な管理下で徐々に行うこと。
9.2 腎機能障害患者
9.2.1 腎機能低下患者(クレアチニンクリアランス30mL/min未満)
高い血中濃度が持続するおそれがある。[16.6.1参照]
9.3 肝機能障害患者
肝機能障害が悪化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中への移行及び出生児の体重増加抑制が報告されている。
9.7 小児等
低出生体重児、新生児、乳児又は幼児を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 劇症肝炎、肝機能障害、黄疸(いずれも頻度不明)
劇症肝炎、AST、ALT、γ-GTP、LDH、Al-Pの上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 過敏症 | 紅斑等の発疹 | 浮腫(顔面・四肢等)、そう痒、呼吸困難 | ||
| 精神神経系 | 眠気 | 倦怠感、口渇、頭痛・頭重感、めまい | 集中力低下、しびれ感 | 不随意運動(顔面・四肢等) |
| 消化器 | 腹部不快感、腹痛、下痢、嘔気 | 便秘、口内炎・口角炎・舌痛、胸やけ、食欲亢進 | 嘔吐 | |
| 肝臓 | 肝機能異常(ALT,AST,LDH,γ-GTP,Al-P,総ビリルビン上昇) | |||
| 血液 | 白血球増多、好酸球増多、リンパ球減少 | 白血球減少、血小板減少 | ||
| 腎臓・泌尿器 | 尿潜血 | BUN上昇、尿蛋白陽性、血中クレアチニン上昇、頻尿、排尿困難 | ||
| 循環器 | 動悸、血圧上昇 | |||
| その他 | 血清コレステロール上昇 | 尿糖陽性、胸部不快感、味覚異常、体重増加、ほてり | 月経異常、筋肉痛、関節痛 |
12. 臨床検査結果に及ぼす影響
本剤の投与は、アレルゲン皮内反応を抑制し、アレルゲンの確認に支障を来すので、アレルゲン皮内反応検査を実施する前は本剤を投与しないこと。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
14.1.2 本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
15. その他の注意
15.1 臨床使用に基づく情報
因果関係は明らかではないが、オロパタジン塩酸塩錠投与中に心筋梗塞の発症がみられた症例が報告されている。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1)成人
健康成人男性にオロパタジン塩酸塩錠5mg及び10mgを絶食下単回経口投与したときの薬物動態パラメータは以下のとおりであった1)。
| 投与量 | tmax(h) | Cmax(ng/mL) | AUC0-∞(ng・h/mL) | t1/2(h) |
| 5mg(n=6) | 1.00±0.32 | 107.66±22.01 | 326±63a) | 8.75±4.63a) |
| 10mg(n=12) | 0.92±0.47 | 191.78±42.99 | 638±136b) | 7.13±2.21b) |
(2)小児
小児アレルギー患者(10〜16歳、40〜57kg)にオロパタジン塩酸塩錠5mgを単回経口投与したときの薬物動態パラメータは以下のとおりであった2)。
| 投与量 | tmax(h) | Cmax(ng/mL) | AUC0-12(ng・h/mL) |
| 5mg(n=6) | 1.33±0.52 | 81.57±9.91 | 228±20 |
16.1.2 反復投与
健康成人男性(8例)にオロパタジン塩酸塩錠1回10mgを1日2回6日間、7日目に1回の計13回反復経口投与したとき、4日目までに血漿中濃度は定常状態に達し、Cmaxは単回経口投与時の1.14倍であった1)。
16.1.3 生物学的同等性試験
<オロパタジン塩酸塩OD錠5mg「NIG」>
オロパタジン塩酸塩OD錠5mg「NIG」とアレロック錠5をクロスオーバー法により、それぞれ1錠(オロパタジン塩酸塩として5mg)を健康成人男子に空腹時単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された3)。
・水なしで服用
| 判定パラメータ | 参考パラメータ | |||
| AUC0-24(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
| オロパタジン塩酸塩OD錠5mg「NIG」 | 244.66±37.29 | 79.47±25.15 | 1.14±0.59 | 3.91±0.80 |
| アレロック錠5 | 250.28±39.56 | 78.35±21.04 | 1.14±0.64 | 3.97±0.78 |
オロパタジン塩酸塩OD錠5mg「NIG」投与後の血漿中濃度の推移
・水で服用
| 判定パラメータ | 参考パラメータ | |||
| AUC0-24(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
| オロパタジン塩酸塩OD錠5mg「NIG」 | 234.17±40.58 | 73.18±19.86 | 0.82±0.33 | 3.65±0.59 |
| アレロック錠5 | 224.57±30.01 | 79.13±20.41 | 0.91±0.44 | 3.89±0.48 |
オロパタジン塩酸塩OD錠5mg「NIG」投与後の血漿中濃度の推移
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.3.1 体組織への分布
ラットに14C-オロパタジン塩酸塩1mg/kgを経口投与したとき、大部分の組織で投与後30分に最も高い放射能濃度を示した。消化管のほか、肝臓、腎臓及び膀胱の放射能濃度は、血漿中放射能濃度より高かった4)。
16.3.2 血液−脳関門通過性
ラットに14C-オロパタジン塩酸塩1mg/kgを経口投与したとき、脳内放射能濃度は測定した組織中で最も低く、そのCmaxは血漿中放射能濃度のCmaxの約1/25であった4)。
16.3.3 血液−胎盤関門通過性
妊娠ラットに14C-オロパタジン塩酸塩1mg/kgを経口投与したとき、胎児血漿中及び組織内の放射能濃度は、母体血漿中放射能濃度の0.07〜0.38倍であった5)。
16.3.4 母乳中への移行性
授乳期のラットに14C-オロパタジン塩酸塩1mg/kgを経口投与したとき、乳汁中放射能濃度のAUC0-∞は、血漿中放射能濃度のAUC0-∞の約1.5倍であった5)。
16.3.5 蛋白結合率
ヒト血清蛋白結合率は以下のとおりであった6)(in vitro)。
| 添加濃度(ng/mL) | 0.1 | 10 | 1000 |
| 血清蛋白結合率(%) | 54.7±1.7 | 55.2±0.8 | 54.7±5.5 |
16.4 代謝
16.5 排泄
16.5.1 成人
健康成人にオロパタジン塩酸塩錠5mg(6例)及び10mg(12例)を単回経口投与したときの48時間までの未変化体の尿中排泄率は、投与量の63.0〜71.8%であった。
また、健康成人(8例)にオロパタジン塩酸塩錠1回10mgを1日2回6日間、7日目に1回の計13回反復経口投与したときの尿中排泄率は、単回経口投与後と同程度であった1)。
また、健康成人(8例)にオロパタジン塩酸塩錠1回10mgを1日2回6日間、7日目に1回の計13回反復経口投与したときの尿中排泄率は、単回経口投与後と同程度であった1)。
16.5.2 小児
小児アレルギー患者(10〜16歳、40〜57kg、6例)にオロパタジン塩酸塩錠5mgを単回投与したときの12時間までの未変化体の尿中排泄率は、投与量の61.8%であった2)。
16.6 特定の背景を有する患者
16.6.1 腎機能低下患者(血液透析導入前)
16.6.2 高齢者
16.8 その他
<オロパタジン塩酸塩OD錠2.5mg「NIG」>
オロパタジン塩酸塩OD錠2.5mg「NIG」は、「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成18年11月24日付 薬食審査発第1124004号)」に基づき、オロパタジン塩酸塩OD錠5mg「NIG」を標準製剤としたとき、溶出挙動が等しく、生物学的に同等とみなされた。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<アレルギー性鼻炎>
17.1.1 国内第III相比較試験(成人)
通年性アレルギー性鼻炎患者(211例)を対象に、オキサトミドを対照薬とした二重盲検比較試験を実施した。オロパタジン塩酸塩(5mg錠又はプラセボ錠)及びオキサトミド(30mg錠又はプラセボ錠)を1日2回4週間反復経口投与した結果、最終全般改善度の改善率(「改善」以上)はオロパタジン塩酸塩62.4%(53/85例)、オキサトミド56.6%(47/83例)であった。10%上乗せ方式による同等性の検証の結果、同等性が確認された(p=0.018)。概括安全度の安全率(「安全性に問題なし」)はオロパタジン塩酸塩68.0%(70/103例)、オキサトミド61.4%(62/101例)であった。両群間に有意差は認められなかった(p=0.301;U検定、p=0.403;χ2検定)10)。
副作用発現頻度はオロパタジン塩酸塩群29.1%(30/103例)、オキサトミド群30.7%(31/101例)であった。オロパタジン塩酸塩群の主な副作用は、眠気25.2%(26/103例)であった。
副作用発現頻度はオロパタジン塩酸塩群29.1%(30/103例)、オキサトミド群30.7%(31/101例)であった。オロパタジン塩酸塩群の主な副作用は、眠気25.2%(26/103例)であった。
<蕁麻疹>
17.1.2 国内第III相比較試験(成人)
慢性蕁麻疹患者(256例)を対象に、ケトチフェンを対照薬とした二重盲検比較試験を実施した。オロパタジン塩酸塩(5mg錠又はプラセボ錠)及びケトチフェンフマル酸塩(1mgカプセル又はプラセボカプセル)を1日2回2週間反復経口投与した結果、最終全般改善度の改善率(「改善」以上)はオロパタジン塩酸塩77.7%(87/112例)、ケトチフェンフマル酸塩66.9%(81/121例)であった。主たる検定であるU検定において、オロパタジン塩酸塩はケトチフェンフマル酸塩と比べ有意な改善を示した(p=0.019;U検定、p=0.093;χ2検定)。概括安全度の安全率(「安全性に問題なし」)はオロパタジン塩酸塩77.2%(95/123例)、ケトチフェンフマル酸塩53.9%(69/128例)であった。オロパタジン塩酸塩はケトチフェンフマル酸塩と比べ有意に概括安全度が高かった(p=0.0001;U検定、p=0.0001;χ2検定)11)。
副作用発現頻度はオロパタジン塩酸塩群21.1%(26/123例)、ケトチフェン群41.4%(53/128例)であった。オロパタジン塩酸塩群の主な副作用は、眠気19.5%(24/123例)であった。
副作用発現頻度はオロパタジン塩酸塩群21.1%(26/123例)、ケトチフェン群41.4%(53/128例)であった。オロパタジン塩酸塩群の主な副作用は、眠気19.5%(24/123例)であった。
<皮膚疾患に伴うそう痒(湿疹・皮膚炎、痒疹、皮膚そう痒症、尋常性乾癬、多形滲出性紅斑)>
17.1.3 国内第III相一般試験(成人)
皮膚疾患に伴うそう痒の患者(湿疹・皮膚炎152例、痒疹72例、皮膚そう痒症80例、尋常性乾癬70例及び多形滲出性紅斑24例、計398例)を対象に、オロパタジン塩酸塩10mg/日(1回5mg、1日2回)を2週間反復投与した。各皮膚疾患に対する有効率は、湿疹・皮膚炎74.6%(91/122例)、痒疹50.8%(31/61例)、皮膚そう痒症49.3%(33/67例)、尋常性乾癬52.8%(28/53例)、多形滲出性紅斑83.3%(15/18例)であり、全体での有効率は61.7%(198/321例)であった12)。
副作用発現頻度は19.0%(74/390例)であった。主な副作用は、眠気11.3%(44/390例)であった。
副作用発現頻度は19.0%(74/390例)であった。主な副作用は、眠気11.3%(44/390例)であった。
17.1.4 高齢者(65歳以上)における臨床成績
承認時までの高齢者(65歳以上)への使用経験191例(気管支喘息57例、アレルギー性鼻炎3例、蕁麻疹31例、そう痒性皮膚疾患100例)における副作用発現率は22.5%(43/191例)であり、主な副作用は眠気23件(12.0%)、倦怠感7件(3.7%)、腹痛4件(2.1%)、顔面・四肢等の浮腫3件(1.6%)、頭痛・頭重感3件(1.6%)、めまい2件(1.0%)、下痢2件(1.0%)、胸部不快感2件(1.0%)等であった。高齢者における副作用発現率は65歳未満15.3%(238/1,555例)に比べ高かった。また、高齢者に対する有効率は気管支喘息25.5%(12/47例)、アレルギー性鼻炎100%(2/2例)、蕁麻疹80.6%(25/31例)、皮膚疾患に伴うそう痒全体で58.3%(49/84例)であった13)14)。[9.8参照]
<アレルギー性鼻炎>
17.1.5 国内二重盲検比較試験(小児)
小児通年性アレルギー性鼻炎患者(7〜16歳)を対象に、オロパタジン塩酸塩(1回2.5mg、1日2回、もしくは1回5mg、1日2回)注)あるいは、対照薬としてプラセボを2週間投与した。主要評価項目である「鼻の3主徴(くしゃみ、鼻汁、鼻閉)合計スコアの観察期からの変化量」について共分散分析を行った結果、オロパタジン塩酸塩5mg群はプラセボ群に対し有意な改善を示した15)。
| 投与群 | 症例数 | 投与前(mean±S.D.) | 変化量(mean±S.D.) | 解析結果(共分散分析a)) |
| オロパタジン塩酸塩5mg/回 | 100 | 6.14±1.44 | -1.41±1.99 | 最小二乗平均の差 (プラセボ群-5mg群):0.51 95%信頼区間:0.04〜0.98 p値:0.019b) |
| プラセボ | 97 | 5.99±1.17 | -0.84±1.58 | − |
副作用発現頻度はオロパタジン塩酸塩2.5mg群12.6%(13/103例)注)、5mg群16.0%(16/100例)、プラセボ群8.2%(8/98例)であった。オロパタジン塩酸塩5mg群で発現した主な副作用は、ALT増加6.0%(6/100例)、白血球数増加4.0%(4/100例)であった16)。
注)7歳以上の小児における本剤の承認用量は1回5mg、1日2回である。
17.1.6 国内非盲検試験(小児)
小児通年性アレルギー性鼻炎患者(7〜16歳、30kg以上、33例)を対象に、オロパタジン塩酸塩1回5mgを1日2回12週間投与した結果、鼻の3主徴(くしゃみ、鼻汁、鼻閉)合計スコアの観察期からの変化量(mean±S.D.)は投与2週後-2.08±1.73、投与12週後-2.41±2.09であり、効果は投与終了時まで減弱することなく安定していた17)。
副作用発現頻度は15.2%(5/33例)であった。主な副作用は、傾眠9.1%(3/33例)であった。
副作用発現頻度は15.2%(5/33例)であった。主な副作用は、傾眠9.1%(3/33例)であった。
<アトピー性皮膚炎>
17.1.7 国内二重盲検比較試験(小児)
小児アトピー性皮膚炎患者(7〜16歳)を対象に、オロパタジン塩酸塩(1回5mg、1日2回)あるいは、対照薬としてケトチフェンフマル酸塩ドライシロップ(1回1g、1日2回)を2週間投与した。主要評価項目である「そう痒スコアの治験薬投与前からの変化量」について共分散分析を行った結果、ケトチフェンフマル酸塩ドライシロップに対するオロパタジン塩酸塩の非劣性が検証された(95%信頼区間の上限が0.4以下)18)。
| 投与群 | 症例数 | 投与前(mean±S.D.) | 変化量(mean±S.D.) | 解析結果(共分散分析a)) |
| オロパタジン塩酸塩 | 152 | 2.36±0.46 | -0.78±0.84 | 最小二乗平均の差(オロパタジン塩酸塩群-ケトチフェンフマル酸塩群):-0.08 95%信頼区間:-0.25〜0.09 |
| ケトチフェンフマル酸塩ドライシロップ | 153 | 2.38±0.44 | -0.71±0.76 |
副作用発現頻度はオロパタジン塩酸塩群11.8%(18/152例)、ケトチフェンフマル酸塩ドライシロップ群6.5%(10/153例)であった。オロパタジン塩酸塩群で発現した主な副作用は、傾眠5.9%(9/152例)、ALT増加4.6%(7/152例)及びAST増加2.6%(4/152例)であった。
18. 薬効薬理
18.1 作用機序
ヒスタミンH1受容体拮抗作用を主体とし、ケミカルメディエーター(ロイコトリエン、トロンボキサン、PAF等)の産生・遊離抑制作用を現す。さらに、神経伝達物質タキキニン遊離抑制作用も有する19)。
18.2 薬理作用
18.2.1 抗ヒスタミン作用
18.2.2 実験的抗アレルギー作用
18.2.3 化学伝達物質の産生・遊離過程に及ぼす影響
18.2.4 タキキニン遊離抑制作用
19. 有効成分に関する理化学的知見
19.1. オロパタジン塩酸塩
22. 包装
<オロパタジン塩酸塩OD錠2.5mg「NIG」>
100錠[10錠(PTP)×10、乾燥剤入り]
<オロパタジン塩酸塩OD錠5mg「NIG」>
100錠[10錠(PTP)×10、乾燥剤入り]、
500錠[10錠(PTP)×50、乾燥剤入り]
23. 主要文献
- 角尾道夫ほか, 基礎と臨床, 29, 4129-4147, (1995)
- 小児における薬物動態試験(アレロック錠・OD錠;2010年7月23日承認、CTD2.7.6.1)
- 社内資料:生物学的同等性試験
- 大石孝義ほか, 薬物動態, 10, 651-668, (1995) »DOI
- 大石孝義ほか, 薬物動態, 10, 707-721, (1995) »DOI
- 血清蛋白結合率(in vitro)(アレロック錠;2000年12月22日承認、申請資料概要へ-II-2 5.)
- 国内第I相単回投与試験における代謝物の検討(アレロック錠;2000年12月22日承認、申請資料概要へ-III-1 1.)
- 越川昭三ほか, 腎と透析, 42, 107-114, (1997)
- 小林真一ほか, 臨床薬理, 27, 673-681, (1996) »DOI
- 通年性アレルギー性鼻炎に対する臨床評価−Oxatomideを対照薬とした二重盲検比較試験−(アレロック錠;2000年12月22日承認、申請資料概要ト-I-2-3)
- 西山茂夫ほか, 臨床医薬, 17, 237-264, (2001)
- 西山茂夫ほか, 臨床医薬, 12, 1615-1640, (1996)
- 臨床試験における高齢者(65歳以上)の安全性と有効性のまとめ(アレロック錠;2000年12月22日承認、申請資料概要ト-I-5-2)
- 安全性のまとめ(アレロック錠;2000年12月22日承認、申請資料概要ト-II-2)
- Okubo K,et al., Curr Med Res Opin., 26, 1657-1665, (2010) »PubMed
- 小児通年性アレルギー性鼻炎を対象とした二重盲検比較試験(アレロック錠・OD錠;2010年7月23日承認、CTD2.7.6.2)
- 大久保公裕, アレルギー・免疫, 18, 108-116, (2011)
- 川島眞ほか, 西日皮膚, 73, 278-289, (2011) »DOI
- 第十八改正日本薬局方解説書, C-1276-C-1280, (2021), (廣川書店)
- 野中裕美ほか, 薬理と臨床, 5, 1817-1824, (1995)
- 佐々木康夫ほか, 薬理と臨床, 5, 1825-1835, (1995)
- 貝瀬俊彦ほか, アレルギー, 44, 1229-1233, (1995) »DOI
- Kamei C,et al., Arzneim-Forsch/Drug Res., 45, 1005-1008, (1995) »PubMed
- Kaise T,et al., Jpn J Pharmacol., 69, 435-438, (1995) »PubMed
- 石井秀衛ほか, 日薬理誌, 106, 289-298, (1995) »PubMed
- 石井秀衛ほか, 基礎と臨床, 29, 3543-3559, (1995)
- Ohmori K,et al., Int Arch Allergy Immunol., 110, 64-72, (1996) »PubMed
- 佐々木康夫ほか, 日薬理誌, 106, 347-357, (1995) »PubMed
- 佐々木康夫ほか, 薬理と臨床, 5, 1837-1850, (1995)
- Ikemura T,et al., Int Arch Allergy Immunol., 110, 57-63, (1996) »PubMed
- 池村俊秀ほか, アレルギー, 43, 1087, (1994)
- 化学伝達物質の産生・遊離に及ぼす影響(アレロック錠;2000年12月22日承認、申請資料概要ホ-II-2 3)
- Ikemura T,et al., Br J Pharmacol., 117, 967-973, (1996) »PubMed
- タキキニンの遊離に及ぼす影響(アレロック錠;2000年12月22日承認、申請資料概要ホ-II-3)
24. 文献請求先及び問い合わせ先
文献請求先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
製品情報問い合わせ先
日医工株式会社
お客様サポートセンター
〒930-8583
富山市総曲輪1丁目6番21
電話:0120-517-215
FAX:076-442-8948
26. 製造販売業者等
26.1 製造販売元
日医工岐阜工場株式会社
富山市総曲輪1丁目6番21
26.2 発売元
日医工株式会社
富山市総曲輪1丁目6番21
26.3 販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号