医薬品情報
| 総称名 | フルチカゾンフランカルボン酸エステル |
|---|---|
| 一般名 | フルチカゾンフランカルボン酸エステル |
| 欧文一般名 | Fluticasone Furoate |
| 製剤名 | フルチカゾンフランカルボン酸エステル点鼻液 |
| 薬効分類名 | 定量噴霧式アレルギー性鼻炎治療剤 |
| 薬効分類番号 | 1329 |
| ATCコード | R01AD08 R01AD12 |
| KEGG DRUG |
D06315
フルチカゾンフランカルボン酸エステル
|
| KEGG DGROUP |
DG00420
フルチカゾン
DG01955
副腎皮質ステロイド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 作成(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| フルチカゾンフランカルボン酸エステル点鼻液27.5μg「ニットー」56噴霧用 (後発品) | Fluticasone Furoate 27.5μg「NITTO」metered Nasal Spray 56sprays | 日東メディック | 1329711Q3059 | 459.7円/瓶 | 処方箋医薬品注) |
| フルチカゾンフランカルボン酸エステル点鼻液27.5μg「ニットー」120噴霧用 (後発品) | Fluticasone Furoate 27.5μg「NITTO」metered Nasal Spray 120sprays | 日東メディック | 1329711Q4055 | 949.9円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 有効な抗菌剤の存在しない感染症、深在性真菌症の患者[症状を増悪するおそれがある]
2.2 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
成人には、通常1回各鼻腔に2噴霧(1噴霧あたりフルチカゾンフランカルボン酸エステルとして27.5μgを含有)を1日1回投与する。
小児には、通常1回各鼻腔に1噴霧(1噴霧あたりフルチカゾンフランカルボン酸エステルとして27.5μgを含有)を1日1回投与する。
7. 用法及び用量に関連する注意
本剤の十分な臨床効果を得るためには継続的に使用すること。
8. 重要な基本的注意
8.1 本剤の投与期間中に鼻症状の悪化がみられた場合には、抗ヒスタミン剤あるいは、全身性ステロイド剤を短期間併用し、症状の軽減にあわせて併用薬剤を徐々に減量すること。
8.2 全身性ステロイド剤の減量は本剤の投与開始後症状の安定をみて徐々に行う。減量にあたっては一般のステロイド剤の減量法に準ずる。
8.3 全身性ステロイド剤の減量並びに離脱に伴って、気管支喘息、ときに湿疹、蕁麻疹、眩暈、動悸、倦怠感、顔のほてり、結膜炎等の症状が発現・増悪することがあるので、このような症状があらわれた場合には適切な処置を行うこと。
8.4 通年性アレルギー性鼻炎患者において長期に使用する場合、症状の改善状態持続時には、減量につとめること。
8.5 全身性ステロイド剤と比較し可能性は低いが、点鼻ステロイド剤の投与により全身性の作用(クッシング症候群、クッシング様症状、副腎皮質機能抑制、小児の成長遅延、骨密度の低下、白内障、緑内障、中心性漿液性網脈絡膜症を含む)が発現する可能性がある。特に長期間、大量投与の場合には定期的に検査を行い、全身性の作用が認められた場合には適切な処置を行うこと。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 鼻咽喉感染症(有効な抗菌剤の存在しない感染症、深在性真菌症を除く)の患者
症状を増悪するおそれがある。
9.1.2 反復性鼻出血の患者
出血を増悪するおそれがある。
9.1.3 重症な肥厚性鼻炎や鼻茸の患者
本剤の鼻腔内での作用を確実にするため、これらの症状がある程度減少するよう他の療法を併用するとよい。
9.1.4 長期又は大量の全身性ステロイド療法を受けている患者
全身性ステロイド剤の減量中並びに離脱後も副腎皮質機能検査を行い、外傷、手術、重症感染症等の侵襲には十分に注意を払うこと。また、必要があれば一時的に全身性ステロイド剤の増量を行うこと。これらの患者では副腎皮質機能不全となっていることが考えられる。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。グルココルチコイドは実験動物で催奇形性を示すとされているが、本薬を吸入投与したラット(91μg/kg/日まで)及びウサギ(8μg/kg/日まで)において催奇形作用はみられず、ラットの出生前後の発生に影響は認められていない。高用量の吸入曝露により、母動物毒性に関連した胎児の低体重、胸骨の不完全骨化の発現率増加(ラット)、及び流産(ウサギ)が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
9.7.1 全身性ステロイド剤と比較し可能性は低いが、点鼻ステロイド剤を特に長期間、大量に投与する場合に小児の成長遅延をきたすおそれがある。本剤を小児に長期間投与する場合には、定期的に身長等の経過の観察を行うこと。また、使用にあたっては、使用法を正しく指導すること。
9.7.2 低出生体重児、新生児、乳児又は2歳未満の幼児を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に、生理機能が低下している。
10. 相互作用
相互作用序文
本剤は、主としてCYP3A4で代謝される。[16.4参照]
薬物代謝酵素用語
CYP3A4
10.2 併用注意
| CYP3A4阻害作用を有する薬剤 リトナビル等 [16.7.1参照] | 副腎皮質ステロイド剤を全身投与した場合と同様の症状があらわれる可能性がある。なお、類薬であるフルチカゾンプロピオン酸エステル製剤とリトナビルを併用した臨床薬理試験において、血中フルチカゾンプロピオン酸エステル濃度の上昇、また血中コルチゾール値の低下が認められ、全身性のステロイド作用が発現したとの報告がある。 | CYP3A4による代謝が阻害されることにより、本剤の血中濃度が上昇する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
アナフィラキシー反応(頻度不明)
11.2 その他の副作用
| 1.1%未満 | 頻度不明 | |
| 過敏症 | 発疹、血管性浮腫、蕁麻疹 | |
| 鼻腔 | 鼻出血、鼻症状(刺激感、疼痛、乾燥感) | 鼻潰瘍、鼻中隔穿孔 |
| 精神神経系 | 頭痛、睡眠障害 | |
| その他 | 血中コルチゾール減少、白血球数増加 | 眼圧上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 患者には添付の鼻用定量噴霧器の使用説明書を渡し、使用方法を指導すること。
(1)鼻腔内噴霧用にのみ使用すること。
(2)本剤の使用前に容器を上下によく振ること。
(3)新しい噴霧器を使用する際には空噴霧を行い(10回程度)、液が完全に霧状になることを確認した後に使用すること。
15. その他の注意
15.1 臨床使用に基づく情報
レセルピン系製剤、α-メチルドパ製剤等の降圧剤には、副作用として鼻閉がみられることがある。このような降圧剤服用中のアレルギー性鼻炎の患者に、本剤を投与すると、鼻閉症状に対する本剤の効果が隠蔽されるおそれがあるので、臨床的観察を十分に行いながら投与すること。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人
フルチカゾンフランカルボン酸エステル110、220、440μg注)の単回及び1日1回(440μg/日注))7日間反復鼻腔内投与した時の血中濃度は、220μgまでの単回投与では定量下限(10pg/mL)未満であった。440μgでは単回投与で8例中1例、反復投与で8例中3例に定量下限値をわずかに超える値がみられた。定量下限値を超えた単回投与の1例と反復投与の3例の最高血漿中濃度は、10.7〜14.6pg/mLであった1)。
16.1.2 小児通年性アレルギー性鼻炎患者
フルチカゾンフランカルボン酸エステル55μgを1日1回12週間鼻腔内投与した時の最終投与日の投与0.5〜2.0時間後の血中濃度は、大部分の被験者において定量下限(10pg/mL)未満であった。定量下限値を超えた2歳以上6歳未満の2例の血漿中濃度は10.9及び13.1pg/mL、6歳以上15歳未満の3例は14.9〜23.7pg/mLであった2)。
16.1.3 全身曝露量比較試験
健康成人男性36名を対象として、フルチカゾンフランカルボン酸エステル点鼻液27.5μg「ニットー」56噴霧用(本剤)又はアラミスト点鼻液27.5μg 56噴霧用(標準製剤)をクロスオーバー試験法により各鼻腔2噴霧(フルチカゾンフランカルボン酸エステルとして110μg)投与して血漿中フルチカゾンフランカルボン酸エステル濃度を測定した結果、全被験者の全測定時点において血漿中未変化体濃度のCmax平均値及び最大値は、いずれも設定した許容限度(25pg/mL)未満であった3)。
16.3 分布
In vitroでのヒト血漿蛋白結合率は99%以上であった4)。
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 肝障害患者
フルチカゾンフランカルボン酸エステル(FF)の肝障害患者への鼻腔内投与は検討していない。
なお、中等度肝機能障害患者にFF 400μgを単回吸入投与注)した結果、Cmax及びAUCの増加が認められている(外国人データ)8)。
なお、中等度肝機能障害患者にFF 400μgを単回吸入投与注)した結果、Cmax及びAUCの増加が認められている(外国人データ)8)。
16.7 薬物相互作用
16.7.1 CYP3A4阻害作用を有する薬剤
注)本剤の承認用量は、成人には1回各鼻腔に27.5μgを2噴霧(110μg/日)、小児には1回各鼻腔に27.5μgを1噴霧(55μg/日)1日1回投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験(成人)
通年性アレルギー性鼻炎を対象として、フルチカゾンフランカルボン酸エステル(FF)110μg/日、220μg/日注)又はプラセボを1日1回2週間投与する用量反応試験を実施した。くしゃみ発作、鼻汁、鼻閉の3鼻症状の程度をスコア化(各症状0〜3点、合計0〜9点)し、ベースラインと全投与期間(2週間)における、3鼻症状合計スコア平均の差を変化量として評価した。その結果、3鼻症状合計スコア平均の変化量(調整済み平均値)は、FF 110μg群で−1.95、220μg群で−2.14、プラセボ群で−1.16であり、FF群はプラセボ群に比し有意なスコアの減少が認められた(表1)。
FF 110μg群における副作用発現頻度は、8%(6/80例)であった。主な副作用は、血中コルチゾール減少3%(2/80例)であった10)11)。
FF 110μg群における副作用発現頻度は、8%(6/80例)であった。主な副作用は、血中コルチゾール減少3%(2/80例)であった10)11)。
| 投与群 | 症例数 | ベースライン (平均値±SD) | 全投与期間 (平均値±SD) | 変化量 (調整済み平均値注1)±SE) | プラセボ群との差 (調整済み平均値の差) |
| FF110μg群 | 80 | 6.3±1.17 | 4.3±1.48 | −1.95±0.163 | −0.791* |
| FF220μg群 | 81 | 5.8±0.96 | 3.9±1.47 | −2.14±0.160 | −0.985* |
| プラセボ群 | 79 | 6.5±1.07 | 5.2±1.50 | −1.16±0.165 | − |
17.1.2 海外第II相試験(成人)
17.1.3 国内第III相試験(成人)
季節性アレルギー性鼻炎を対象として、フルチカゾンフランカルボン酸エステル(FF、110μg/日、1日1回)、フルチカゾンプロピオン酸エステル(FP、200μg/日、1日2回)又はプラセボを2週間投与する比較試験を実施した。その結果、3鼻症状合計スコア平均の変化量(調整済み平均値)は、FF 110μg群で−1.23、FP 200μg群で−1.06であり、FFのFPに対する非劣性が検証された(表2)。FF 110μg群の効果発現までの日数(プラセボと比較し、有意差が認められた最初の日までの日数)は1日であり、FP 200μg群の効果発現までの日数は2日であったことから、FFではFPより早い効果の発現が確認された。さらに、FF 110μg群とFFプラセボ群の3鼻症状合計スコア平均の変化量を比較した結果、調整済み平均値の差は−1.689であり、FFプラセボ群に比し有意なスコアの減少が認められた(表3)。
FF 110μg群における副作用発現頻度は、6%(9/149例)であった。主な副作用は白血球数増加1%(2/149例)であった14)15)。
FF 110μg群における副作用発現頻度は、6%(9/149例)であった。主な副作用は白血球数増加1%(2/149例)であった14)15)。
| 投与群 | 症例数 | ベースライン (平均値±SD) | 全投与期間 (平均値±SD) | 変化量 (調整済み平均値注1)±SE) | 調整済み平均値の差 (両側95%信頼区間) |
| FF110μg群 | 147 | 5.8±1.33 | 4.4±1.73 | −1.23±0.140 | −0.173 (−0.51、0.17注2)) |
| FP200μg群 | 144 | 5.9±1.43 | 4.6±1.55 | −1.06±0.142 |
| 投与群 | 症例数 | ベースライン (平均値±SD) | 全投与期間 (平均値±SD) | 変化量 (調整済み平均値±SE) | 調整済み平均値の差 |
| FF110μg群 | 147 | 5.8±1.33 | 4.4±1.73 | −1.27±0.151 | −1.689* |
| FFプラセボ群 | 70 | 5.9±1.28 | 6.1±1.62 | 0.42±0.201 |
17.1.4 国内第III相試験(小児)
6歳以上15歳未満の通年性アレルギー性鼻炎を対象として、フルチカゾンフランカルボン酸エステル(FF、55μg/日、1日1回)又はプラセボを2週間投与する二重盲検比較試験を実施した。その結果、全投与期間における3鼻症状合計スコア平均の変化量(調整済み平均値)は、FF 55μg群で−1.98、プラセボ群で−0.89、変化量の差は−1.089であり、FFのプラセボに対する優越性が検証された(表4)。
FF 55μg群における副作用発現頻度は1%未満(1/131例)であり、鼻部不快感1例であった16)17)。
FF 55μg群における副作用発現頻度は1%未満(1/131例)であり、鼻部不快感1例であった16)17)。
| 投与群 | 症例数 | ベースライン (平均値±SD) | 全投与期間 (平均値±SD) | 変化量 (調整済み平均値注1)±SE) | 調整済み平均値の差 (両側95%信頼区間) |
| FF55μg群 | 131 | 5.0±0.94 | 3.1±1.53 | −1.98±0.12 | −1.089* (−1.41、−0.76) |
| プラセボ群 | 130 | 5.2±1.06 | 4.2±1.55 | −0.89±0.12 |
17.3 その他
17.3.1 視床下部−下垂体−副腎皮質系機能に対する影響(海外第III相試験、成人)
通年性アレルギー性鼻炎を対象とした臨床試験において、フルチカゾンフランカルボン酸エステル110μgを1日1回6週間投与した場合、視床下部−下垂体−副腎皮質系機能への影響は認められなかった18)。
17.3.2 成長への影響(海外第III/IV相試験、小児)
思春期前の小児の通年性アレルギー性鼻炎を対象として、フルチカゾンフランカルボン酸エステル(FF、110μg/日注)、1日1回)の成長に対する影響を検討することを目的とした二重盲検比較試験を実施した(投与期間:52週間)。投与52週後における成長速度(cm/年)のベースラインからの変化量は、FF 110μg注)群で−0.534、プラセボ群で−0.287、群間差[95%信頼区間]は−0.270[−0.48,−0.06]であり、群間差の95%信頼区間は、事前に規定した値(0.5cm)の範囲内であった19)。
注)本剤の承認用量は、成人には1回各鼻腔に27.5μgを2噴霧(110μg/日)、小児には1回各鼻腔に27.5μgを1噴霧(55μg/日)1日1回投与である。
17.3.3 生物学的同等性試験
スギ花粉症患者(成人)を対象に、フルチカゾンフランカルボン酸エステル点鼻液27.5μg「ニットー」56噴霧用(本剤)又はアラミスト点鼻液27.5μg 56噴霧用(標準製剤)を、2群2期クロスオーバー法により、各鼻腔に1回2噴霧(フルチカゾンフランカルボン酸エステルとして110μg)を1日1回(就寝前)14日間反復投与し、スギ花粉曝露により誘発される鼻汁、くしゃみ、鼻閉及び鼻そう痒感の4症状の合計スコア(TNSS)の時間経過から台形法を用いてTNSS AUC0-3hrを算出した。薬剤投与前TNSS AUC0-3hrと薬剤投与後TNSS AUC0-3hrの差により得られた薬力学的パラメータ(TNSS ΔAUC0-3hr)について分散分析を行った結果、95%信頼区間は同等の許容域±2.2271の範囲内であり、両剤の生物学的同等性が確認された。
本剤の副作用発現頻度は6.3%(3/48例)であり、コルチゾール減少が3例であった20)。
本剤の副作用発現頻度は6.3%(3/48例)であり、コルチゾール減少が3例であった20)。
| 症例数 | TNSS ΔAUC0-3hr(平均値±SD) | |
| 本剤 | 46 | 10.6603±4.6416 |
| 標準製剤 | 44 | 10.4659±5.1062 |
| 製剤間差 | 95%信頼区間 |
| −0.2056 | −1.3058〜0.8946 |
18. 薬効薬理
18.1 作用機序
フルチカゾンフランカルボン酸エステルは合成副腎皮質ステロイドであり、グルココルチコイド受容体を刺激することにより、アレルギー性鼻炎抑制作用、好酸球浸潤抑制作用及び抗炎症作用を示す21)。
18.2 アレルギー性鼻炎抑制作用
ラットのアレルギー性鼻炎モデルにおいて、鼻腔内投与により鼻症状(くしゃみ、鼻掻き行動)を抑制し、その効力はフルチカゾンプロピオン酸エステルと同程度である。また、作用の持続時間は、鼻掻き行動に対してはフルチカゾンプロピオン酸エステルと同程度であり、くしゃみに対してはフルチカゾンプロピオン酸エステルよりも長い22)。
18.3 好酸球浸潤抑制作用
能動感作ラットにおいて、気管内投与により気管内への抗原誘発好酸球浸潤を抑制し、その効力はフルチカゾンプロピオン酸エステルと同程度である23)。
18.4 抗炎症作用
ラット及びマウスの遅延型過敏症モデルにおいて、耳介塗布により抗原誘発耳介浮腫を抑制し、その効力はフルチカゾンプロピオン酸エステルと同程度である24)。
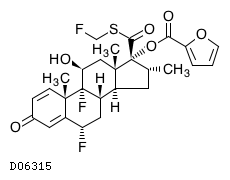
19. 有効成分に関する理化学的知見
19.1. フルチカゾンフランカルボン酸エステル
22. 包装
<フルチカゾンフランカルボン酸エステル点鼻液27.5μg「ニットー」56噴霧用>
6g[1瓶]×5
<フルチカゾンフランカルボン酸エステル点鼻液27.5μg「ニットー」120噴霧用>
10g[1瓶]×5
23. 主要文献
- 大久保公裕ほか, アレルギー・免疫, 16 (9), 1442-1453, (2009)
- Okubo K,et al., Allergol Int., 64 (1), 60-65, (2015) »PubMed
- 社内資料:全身曝露量比較試験
- 血漿蛋白結合(アラミスト点鼻液27.5μg 56噴霧用:2009年4月22日承認、申請資料概要2.6.4.4)
- 代謝に関わるCYP分子種の同定(アラミスト点鼻液27.5μg 56噴霧用:2009年4月22日承認、申請資料概要2.7.2.2)
- Hughes SC,et al., Drug Metab Dispos., 36 (11), 2337-2344, (2008) »PubMed
- 放射性標識体を投与した時の薬物動態プロファイル(FFR10008試験)(アラミスト点鼻液27.5μg 56噴霧用:2009年4月22日承認、申請資料概要2.7.2.2)
- 肝機能障害患者に対する影響(吸入投与)(FFA10013試験)(アラミスト点鼻液27.5μg 56噴霧用:2009年4月22日承認、申請資料概要2.7.2.2)
- ケトコナゾールとの相互作用の検討(FFR10013試験)(アラミスト点鼻液27.5μg 56噴霧用:2009年4月22日承認、申請資料概要2.7.2.2)
- Okubo K,et al., Curr Med Res Opin., 24, 3393-3403, (2008) »PubMed
- 通年性アレルギー性鼻炎に対する臨床評価−二重盲検比較試験による用量反応試験−(アラミスト点鼻液27.5μg 56噴霧用:2009年4月22日承認、申請資料概要2.7.6.4)
- Martin BG,et al., Allergy Asthma Proc., 28, 216-225, (2007) »PubMed
- 季節性アレルギー性鼻炎を対象とした有効性および安全性を評価する多施設共同、無作為化、プラセボ対照、二重盲検、並行群間比較試験(アラミスト点鼻液27.5μg 56噴霧用:2009年4月22日承認、申請資料概要2.7.6.4)
- Okubo K,et al., Allergy Asthma Proc., 30, 84-94, (2009) »PubMed
- 季節性アレルギー性鼻炎に対する臨床評価−プラセボを対照とした二重盲検法を用いたプロピオン酸フルチカゾンに対する非劣性の検討−(アラミスト点鼻液27.5μg 56噴霧用:2009年4月22日承認、申請資料概要2.7.6.4)
- Okubo K,et al., Allergol Int., 63 (4), 543-551, (2014) »PubMed
- 国内第III相試験(アラミスト点鼻液27.5μg 56噴霧用:2014年3月17日承認、審査報告書)
- Patel D,et al., Ann Allergy Asthma Immunol., 100, 490-496, (2008) »PubMed
- 通年性アレルギー性鼻炎を有する思春期前の小児患者を対象としたフルチカゾンフランカルボン酸エステル点鼻液110μg 1日1回鼻腔内投与の影響を評価する1年間の無作為化、二重盲検、プラセボ対照、並行群間比較、多施設共同試験(アラミスト点鼻液27.5μg 56噴霧用:2014年3月17日承認、申請資料概要2.7.6)
- 社内資料:生物学的同等性試験
- 薬理試験の概要(アラミスト点鼻液27.5μg 56噴霧用:2009年4月22日承認、申請資料概要2.6.2.1)
- 中野祥行ほか, 薬理と治療, 36, 1119-1122, (2008)
- ラットにおける抗原誘発好酸球浸潤の抑制作用(アラミスト点鼻液27.5μg 56噴霧用:2009年4月22日承認、申請資料概要2.6.2.2)
- 遅延型過敏症モデルにおける抗炎症作用(アラミスト点鼻液27.5μg 56噴霧用:2009年4月22日承認、申請資料概要2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
日東メディック株式会社
おくすり相談窓口
〒104-0031
東京都中央区京橋1-10-7
電話:03-3523-0345
FAX:03-6264-4086
製品情報問い合わせ先
日東メディック株式会社
おくすり相談窓口
〒104-0031
東京都中央区京橋1-10-7
電話:03-3523-0345
FAX:03-6264-4086
26. 製造販売業者等
26.1 製造販売元
日東メディック株式会社
富山県富山市八尾町保内1-14-1