医薬品情報
| 総称名 | セレコキシブ |
|---|---|
| 一般名 | セレコキシブ |
| 欧文一般名 | Celecoxib |
| 製剤名 | セレコキシブ錠 |
| 薬効分類名 | 非ステロイド性消炎・鎮痛剤(COX-2選択的阻害剤) |
| 薬効分類番号 | 1149 |
| ATCコード | M01AH01 |
| KEGG DRUG |
D00567
セレコキシブ
|
| KEGG DGROUP |
DG01504
非ステロイド性抗炎症薬 (NSAID)
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年12月 改訂(第3版)

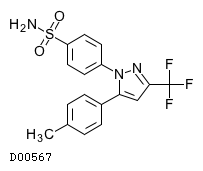
|
1.警告 2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| セレコキシブ錠100mg「ダイト」 (後発品) | Celecoxib Tablets"DAITO" | ダイト | 1149037F1232 | 6.1円/錠 | 劇薬, 処方箋医薬品注) |
| セレコキシブ錠200mg「ダイト」 (後発品) | Celecoxib Tablets"DAITO" | ダイト | 1149037F2239 | 7.9円/錠 | 劇薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分又はスルホンアミドに対し過敏症の既往歴のある患者
2.2 アスピリン喘息(非ステロイド性消炎・鎮痛剤等による喘息発作の誘発)又はその既往歴のある患者[重症喘息発作を誘発するおそれがある。][9.1.6参照]
2.3 消化性潰瘍のある患者[消化性潰瘍を悪化させるおそれがある。][9.1.4参照]
2.4 重篤な肝障害のある患者[9.3.1参照]
2.5 重篤な腎障害のある患者[9.2.1参照]
2.6 重篤な心機能不全のある患者[プロスタグランジン合成阻害作用に基づくナトリウム・水分貯留傾向があるため心機能を悪化させるおそれがある。][9.1.2参照]
2.7 冠動脈バイパス再建術の周術期患者[外国において、類薬で心筋梗塞及び脳卒中の発現が増加するとの報告がある。][9.1.1参照]
2.8 妊娠末期の女性[9.5.1参照]
4. 効能または効果
6. 用法及び用量
<関節リウマチ>
通常、成人にはセレコキシブとして1回100〜200mgを1日2回、朝・夕食後に経口投与する。
<変形性関節症、腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎>
通常、成人にはセレコキシブとして1回100mgを1日2回、朝・夕食後に経口投与する。
<手術後、外傷後並びに抜歯後の消炎・鎮痛>
通常、成人にはセレコキシブとして初回のみ400mg、2回目以降は1回200mgとして1日2回経口投与する。なお、投与間隔は6時間以上あけること。
頓用の場合は、初回のみ400mg、必要に応じて以降は200mgを6時間以上あけて経口投与する。ただし、1日2回までとする。
頓用の場合は、初回のみ400mg、必要に応じて以降は200mgを6時間以上あけて経口投与する。ただし、1日2回までとする。
7. 用法及び用量に関連する注意
7.1 慢性疾患(関節リウマチ、変形性関節症等)に対する使用において、本剤の投与開始後2〜4週間を経過しても治療効果に改善が認められない場合は、他の治療法の選択について考慮すること。
7.2 本剤の1年を超える長期投与時の安全性は確立されておらず、外国において、本剤の長期投与により、心筋梗塞、脳卒中等の重篤で場合によっては致命的な心血管系血栓塞栓性事象の発現を増加させるとの報告がある。[1.参照]
7.3 他の消炎・鎮痛剤(心血管系疾患予防の目的で使用するアスピリンを除く)との併用は避けることが望ましい。
8. 重要な基本的注意
8.1 本剤を使用する場合は、有効最小量を可能な限り短期間投与することに留め、長期にわたり漫然と投与しないこと。[1.参照]
8.2 本剤の投与により、心筋梗塞、脳卒中等の重篤で場合によっては致命的な心血管系血栓塞栓性事象が発現するおそれがあるので、観察を十分に行い、これらの徴候及び症状の発現には十分に注意すること。[1.、9.1.1参照]
8.3 本剤には血小板に対する作用がないので、心血管系疾患予防の目的でアスピリンの代替薬として使用しないこと。抗血小板療法を行っている患者については、本剤投与に伴い、その治療を中止してはならない。
8.4 国内で患者を対象に実施した臨床試験ではCOX-2に対して選択性の高い本剤と選択性の低い非ステロイド性消炎・鎮痛剤による消化管の副作用発現率に差は認められなかった。特に、消化管障害発生のリスクファクターの高い患者への投与に際しては副作用の発現に十分な観察を行うこと。[17.1.2、18.3参照]
8.5 肝不全、肝炎、AST、ALT、ビリルビン等の上昇、黄疸の発現が報告されているので、定期的に肝機能検査を行うなど観察を十分に行うこと。[11.1.5参照]
8.6 急性腎障害、間質性腎炎等の重篤な腎障害の発現が報告されているので、定期的に腎機能検査を行うなど観察を十分に行うこと。[11.1.7参照]
8.7 本剤の投与により、中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)等の重篤で場合によっては致命的な皮膚症状が発現するおそれがあり、多くの場合、これらの事象は投与開始後1カ月以内に発現しているので、治療初期には特に注意すること。[11.1.8参照]
8.8 慢性疾患(関節リウマチ、変形性関節症等)に対し本剤を用いる場合には、次の事項を考慮すること。
・定期的あるいは必要に応じて臨床検査(尿検査、血液検査、腎機能検査、肝機能検査、心電図検査及び便潜血検査等)を行うこと。
・消炎・鎮痛剤による治療は原因療法ではなく、対症療法であることに留意すること。また、薬物療法以外の療法も考慮すること。
8.9 急性疾患(手術後、外傷後並びに抜歯後の消炎・鎮痛)に対し本剤を用いる場合には、次の事項を考慮すること。
・急性炎症及び疼痛の程度を考慮し、投与すること。
・原則として長期投与を避けること。
・原因療法があればこれを行い、本剤を漫然と投与しないこと。
・初回の投与量が2回目以降と異なることに留意し、患者に対し服用方法について十分説明すること。
8.10 本剤で報告されている薬理作用により、感染症を不顕性化するおそれがあるので、感染症の発現に十分に注意し慎重に投与すること。
8.11 浮動性めまい、回転性めまい、傾眠等が起こることがあるので、自動車の運転等危険を伴う作業に従事する場合には注意させること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.2 心機能障害のある患者(重篤な心機能不全のある患者を除く)
水、ナトリウムの貯留が起こる可能性があり、心機能障害を悪化させるおそれがある。[2.6参照]
9.1.3 高血圧症のある患者
水、ナトリウムの貯留が起こる可能性があり、血圧を上昇させるおそれがある。
9.1.4 消化性潰瘍の既往歴のある患者
消化性潰瘍を再発させるおそれがある。[2.3参照]
9.1.5 非ステロイド性消炎・鎮痛剤の長期投与による消化性潰瘍のある患者で、本剤の長期投与が必要であり、かつミソプロストールによる治療が行われている患者
本剤を継続投与する場合には、十分経過を観察し、慎重に投与すること。ミソプロストールは非ステロイド性消炎・鎮痛剤により生じた消化性潰瘍を効能又は効果としているが、ミソプロストールによる治療に抵抗性を示す消化性潰瘍もある。
9.1.6 気管支喘息のある患者(アスピリン喘息又はその既往歴のある患者を除く)
喘息発作を誘発するおそれがある。[2.2参照]
9.2 腎機能障害患者
9.2.1 重篤な腎障害のある患者
投与しないこと。腎障害を悪化させるおそれがある。[2.5参照]
9.2.2 腎障害又はその既往歴のある患者(重篤な腎障害のある患者を除く)
腎血流量低下及び水、ナトリウムの貯留が起こる可能性があり、腎障害を悪化又は再発させるおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。肝障害を悪化させるおそれがある。[2.4参照]
9.3.2 肝障害又はその既往歴のある患者(重篤な肝障害のある患者を除く)
用量を減らすなど慎重に投与すること。血中濃度が高くなるとの報告がある。[16.6.2参照]
9.5 妊婦
9.5.1 妊娠末期の女性
9.5.2 妊婦(妊娠末期を除く)又は妊娠している可能性のある女性
治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。投与する際には、必要最小限にとどめ、羊水量、胎児の動脈管収縮を疑う所見を妊娠週数や投与日数を考慮して適宜確認するなど慎重に投与すること。シクロオキシゲナーゼ阻害剤(経口剤、坐剤)を妊婦に使用し、胎児の腎機能障害及び尿量減少、それに伴う羊水過少症が起きたとの報告がある。シクロオキシゲナーゼ阻害剤(全身作用を期待する製剤)を妊娠中期の妊婦に使用し、胎児の動脈管収縮が起きたとの報告がある。培養細胞を用いた染色体異常試験において、細胞毒性が認められる濃度で染色体の数的異常(核内倍加細胞の増加)が、生殖発生毒性試験で着床後死亡数や死産の増加、横隔膜ヘルニア、胎児体重減少等が認められている。またラットにおいて本剤が胎児に移行することが報告されている。
9.6 授乳婦
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら、慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
相互作用序文
本剤は、主として薬物代謝酵素CYP2C9で代謝される。また、本剤はCYP2D6の基質ではないが、CYP2D6の阻害作用を有する。[16.4参照]
薬物代謝酵素用語
CYP2C9
薬物代謝酵素用語
CYP2D6
10.2 併用注意
| ACE阻害剤 エナラプリルマレイン酸塩 イミダプリル塩酸塩 テモカプリル塩酸塩 等 アンジオテンシンII受容体拮抗剤 カンデサルタンシレキセチル バルサルタン ロサルタンカリウム 等 | 非ステロイド性消炎・鎮痛剤(NSAID)はアンジオテンシン変換酵素(ACE)阻害剤の降圧効果を減弱させる可能性があるとの報告がある。本剤とACE阻害剤又はアンジオテンシンII受容体拮抗剤との相互作用は明らかではないが、併用する場合は相互作用の起こる可能性を考慮すること。(なお、リシノプリルを併用した臨床試験では、顕著な血圧変化は認められなかったとの報告がある) | 他のNSAIDでは、腎臓におけるプロスタグランジン合成阻害によると考えられている。 |
| フロセミド チアジド系利尿剤 トリクロルメチアジド ヒドロクロロチアジド 等 | 患者によっては他のNSAIDがフロセミド及びチアジド系利尿剤のナトリウム排泄作用を低下させることが示されている。本剤と、フロセミド又はチアジド系利尿剤との相互作用は明らかではないが、併用する場合は相互作用の起こる可能性を考慮すること。 | 他のNSAIDでは、腎臓におけるプロスタグランジン合成阻害によると考えられている。 |
| アスピリン | 本剤と低用量アスピリン(1日325mg以下)を併用した場合、本剤のみを服用したときに比べて消化性潰瘍・消化管出血等の発生率が高くなることが報告されている。 | アスピリンの併用によりNSAIDの消化性潰瘍・消化管出血等を助長させると考えられている。 |
| 抗血小板薬 クロピドグレル 等 | 本剤と抗血小板薬を併用した場合、本剤のみを服用したときに比べて消化管出血の発生率が高くなることが報告されている。 | これらの薬剤は血小板凝集抑制作用を有するため、NSAIDの消化管出血を助長させると考えられている。 |
| リチウム [16.7.1参照] | リチウムの血漿中濃度が上昇し、リチウムの作用が増強するおそれがある。リチウムを使用中の患者に本剤の投与を開始又は中止するときには十分に患者をモニターすること。 | 機序は明らかではないが、腎排泄を阻害するためと考えられている。 |
| フルコナゾール [16.7.2参照] | 本剤の血漿中濃度が上昇し、本剤の作用が増強するおそれがある。フルコナゾールを使用中の患者には本剤の投与を低用量から開始すること。 | CYP2C9による本剤の代謝を阻害すると考えられている。 |
| フルバスタチン [16.7.3参照] | 本剤及びフルバスタチンの血漿中濃度が上昇し、本剤及びフルバスタチンの作用が増強するおそれがある。 | CYP2C9による本剤の代謝を阻害するため、また本剤と同じCYP2C9で代謝されるためと考えられている。 |
| クマリン系抗凝血剤 ワルファリン [16.7.4参照] | プロトロンビン時間が延長するおそれがある。海外で特に高齢者において、重篤で場合によっては致命的な出血が報告されている。ワルファリンを使用中の患者に本剤の投与を開始あるいは用法を変更する際には十分注意して観察すること。 | CYP2C9を介する代謝の競合阻害によると考えられている。 |
| パロキセチン [16.7.5参照] | 本剤の血漿中濃度が低下し、パロキセチンの血漿中濃度が上昇した。本剤の作用が減弱し、パロキセチンの作用が増強するおそれがある。 | CYP2D6の阻害作用によると考えられている。 |
| デキストロメトルファン [16.7.6参照] | デキストロメトルファンの血漿中濃度が上昇し、デキストロメトルファンの作用が増強するおそれがある。 | CYP2D6の阻害作用によると考えられている。 |
| 制酸剤 アルミニウム製剤 マグネシウム製剤 等 [16.7.7参照] | 本剤の血漿中濃度が低下し、本剤の作用が減弱するおそれがある。 | 機序は明らかでない。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー、呼吸困難、血管浮腫、血管炎、気管支痙攣等の重篤な過敏症の発現が報告されている。
11.1.2 消化性潰瘍(0.2%)、消化管出血(0.1%未満)、消化管穿孔(頻度不明)
吐血、下血(メレナ)等の症状が認められた場合は投与を中止し、適切な処置を行うこと。
11.1.3 心筋梗塞、脳卒中(いずれも頻度不明)
心筋梗塞、脳卒中等の重篤で場合によっては致命的な心血管系血栓塞栓性事象が報告されている。[1.参照]
11.1.4 心不全、うっ血性心不全(いずれも頻度不明)
11.1.5 肝不全、肝炎(いずれも頻度不明)、肝機能障害(0.1%未満)、黄疸(頻度不明)
肝不全、肝炎、AST、ALT、ビリルビン等の上昇、黄疸の発現が報告されている。[8.5参照]
11.1.6 再生不良性貧血、汎血球減少症、無顆粒球症(いずれも頻度不明)
再生不良性貧血、汎血球減少症、無顆粒球症、白血球減少症、血小板減少症の発現が報告されている。
11.1.7 急性腎障害、間質性腎炎(いずれも頻度不明)
急性腎障害、間質性腎炎等の重篤な腎障害の発現が報告されている。[8.6参照]
11.1.8 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、多形紅斑、急性汎発性発疹性膿疱症、剥脱性皮膚炎(いずれも頻度不明)
中毒性表皮壊死融解症、皮膚粘膜眼症候群、多形紅斑、急性汎発性発疹性膿疱症、剥脱性皮膚炎等の重篤で場合によっては致命的な皮膚症状の発現が報告されているので、発疹、粘膜障害もしくは他の過敏症に関連する徴候が認められた場合は直ちに投与を中止し、適切な処置を行うこと。[8.7参照]
11.1.9 間質性肺炎(頻度不明)
咳嗽、呼吸困難、発熱、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施すること。間質性肺炎が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 0.1〜1%未満 | 0.1%未満 | 頻度不明 | |
| 全身 | 倦怠感、口渇、末梢性浮腫 | 悪寒、全身浮腫、疲労、ほてり、体重増加 | インフルエンザ様疾患 | ||
| 精神神経系 | 傾眠 | 頭痛、浮動性めまい、味覚異常 | 酩酊感、体位性めまい、感覚鈍麻、意識レベルの低下 | 不眠症、睡眠障害、錯乱状態、不安、幻覚、筋緊張亢進、無嗅覚 | |
| 肝胆道系 | ALT増加 | AST増加、γ-GTP増加、Al-P増加、血中ビリルビン増加、尿ウロビリノーゲン陽性 | |||
| 代謝・栄養 | BUN増加 | CK増加、食欲不振、LDH増加、尿糖陽性 | 糖尿病 | 血中カリウム増加、血中ナトリウム増加 | |
| 消化器 | 腹痛、口内炎、下痢、便潜血陽性 | 悪心、鼓腸、消化不良、便秘、胃炎、口内乾燥、舌障害、嘔吐、口角びらん、腹部膨満、上腹部痛、胃不快感 | 胃腸障害、舌炎、口腔内痛、食道炎、口の感覚鈍麻、アフタ性口内炎、口腔粘膜水疱形成、心窩部不快感、胃腸炎 | 歯の脱落、口腔内潰瘍、嚥下障害、胃食道逆流性疾患、膵炎、憩室、過敏性腸症候群、痔出血、排便回数増加 | |
| 泌尿器 | β2-マイクログロブリン増加 | NAG増加、尿潜血陽性 | 尿蛋白陽性 | 多尿、尿閉、頻尿、腎機能障害 | 腎結石症、良性前立腺肥大症、前立腺炎、PSA増加、血中クレアチニン増加 |
| 循環器 | 高血圧、潮紅、動悸 | 高血圧増悪、循環虚脱 | 不整脈、頻脈、洞性徐脈、狭心症、不安定狭心症、大動脈弁閉鎖不全症、冠動脈硬化症、心室肥大、深部静脈血栓症、血腫 | ||
| 呼吸器 | 咽頭炎、鼻出血、鼻咽頭炎 | 気管支炎、咳嗽、鼻炎、副鼻腔炎、呼吸困難、発声障害 | |||
| 皮膚 | 発疹 | そう痒症、顔面浮腫、紅斑性皮疹、湿疹、蕁麻疹、薬疹 | 点状出血、斑状丘疹状皮疹、皮膚乾燥、頭部粃糠疹、多汗、皮膚炎、紅斑 | 斑状出血、光線過敏性反応、脱毛症、水疱性皮膚炎 | |
| 感覚器 | 耳鳴、回転性めまい | 耳痛、霧視、眼そう痒症 | 硝子体浮遊物、結膜出血、聴力低下 | ||
| その他 | 背部痛、筋硬直、関節痛、四肢痛、不正子宮出血、月経障害、ウイルス感染、細菌性腸炎、頚部痛 | 貧血、ヘマトクリット減少、ヘモグロビン増加、真菌感染、細菌感染、ヘリコバクター感染、尿路感染、上気道感染、耳感染、帯状疱疹、丹毒、創傷感染、歯肉感染、迷路炎、アレルギー増悪、無菌性髄膜炎、筋痙縮、脂肪腫、ガングリオン、膣出血、乳房圧痛、卵巣のう胞、閉経期症状、血中テストステロン減少、上顆炎、腱断裂、骨折、損傷 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
外国におけるクロスオーバー二重盲検比較試験において、本剤非投与時に比べて本剤投与時に排卵障害の割合が増加したとの報告がある。また、他の非ステロイド性消炎・鎮痛剤を長期間投与されている女性において、一時的な不妊が認められたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人における薬物動態
健康成人男女36例にセレコキシブ50〜400mg注)を空腹下単回投与したときの血漿中濃度は投与約2時間後に最高血漿中濃度(Cmax)に達した後、約5〜9時間の半減期(t1/2)で消失し、Cmax及び血漿中濃度−時間曲線下面積(AUC)は高用量で用量比より低い比率で上昇した5)。
| 用量(例数) | Tmax(h) | Cmax(ng/mL) | t1/2(h) | AUCinf(ng・h/mL) |
| 50mg(36例) | 2±1.3 | 287±100.4 | 5±2.4 | 1631±540.2 |
| 100mg(34例) | 2±1.4 | 553±212.2 | 7±3.2 | 3429±1149.8 |
| 200mg(34例) | 2±0.9 | 815±303.0 | 8±3.5 | 5832±1674.5 |
| 400mg(34例) | 2±0.9 | 1296±457.7 | 9±4.1 | 10789±3793.4 |
16.1.2 患者における薬物動態
関節リウマチ患者及び変形性膝関節症患者609例にセレコキシブ25〜300mg注)を1日2回、食後反復投与したときの血漿中濃度値1,160点を用いた母集団薬物動態解析の結果、定常状態における経口クリアランス(CL/F)及びみかけの分布容積(Vd/F)の母集団平均(個体間変動)はそれぞれ21.2L/h(約42%)及び335L(約77%)と推定された。また、年齢及び体重はCL/Fの、血清アルブミン濃度はVd/Fの変動要因であると推察された8)。
16.1.3 生物学的同等性試験
<セレコキシブ錠100mg「ダイト」>
健康成人男性にセレコキシブ錠100mg「ダイト」とセレコックス錠100mgのそれぞれ1錠(セレコキシブとして100mg)を、絶食時単回経口投与して血漿中セレコキシブ濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された(クロスオーバー法)9)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-48(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) | |
| セレコキシブ錠100mg「ダイト」 | 4305.23±1298.08 | 686.41±255.83 | 2.3±1.1 | 6.7±2.4 |
| セレコックス錠100mg | 4306.24±1272.53 | 728.18±255.65 | 2.1±1.0 | 6.0±1.9 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<セレコキシブ錠200mg「ダイト」>
健康成人男性にセレコキシブ錠200mg「ダイト」とセレコックス錠200mgのそれぞれ1錠(セレコキシブとして200mg)を、絶食時単回経口投与して血漿中セレコキシブ濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された(クロスオーバー法)10)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-48(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | t1/2(hr) | |
| セレコキシブ錠200mg「ダイト」 | 9712.10±2335.21 | 1247.41±430.53 | 2.2±1.0 | 7.8±2.2 |
| セレコックス錠200mg | 9335.50±2191.89 | 1217.70±403.79 | 2.8±1.3 | 8.5±2.9 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.3 分布
16.3.1 蛋白結合率
In vitro及びex vivoによる検討の結果、セレコキシブの血漿蛋白結合率は約97%であり、主としてアルブミンに、ついでα1-酸性糖蛋白質に結合することが示された11)。
16.4 代謝
In vitro12)及びin vivo13)試験の結果から、セレコキシブは主として薬物代謝酵素CYP2C9を介して代謝されることが明らかとなっている。
CYP2C9には遺伝多型が存在し、Ile359→Leu359のアミノ酸置換により薬剤によっては代謝速度が低下する場合がある。日本人218例を対象としたCYP2C9の研究では、Ile359→Leu359のホモ接合体(CYP2C9*3/*3)は存在しなかったが、Leu359のヘテロ接合体(CYP2C9*1/*3)は218例中9例(4.1%)存在したとの報告がある14)。
CYP2C9の遺伝多型(CYP2C9*3)の影響として、セレコキシブを単回又は反復投与したとき、CYP2C9のヘテロ接合体(Ile359→Leu359、CYP2C9*1/*3)を有する健康成人15例のAUCは野生型(CYP2C9*1/*1)の健康成人137例に比べて約1.6倍と高値を示した15)。
健康成人にセレコキシブ100mgを単回投与注)したとき、CYP2C9*1/*1(4例)と比較し、CYP2C9*3/*3(3例)のAUCは約3倍高値を示し16)(外国人データ)、健康成人にセレコキシブ200mgを1日1回注)7日間反復投与したとき、CYP2C9*1/*1(7例)と比較し、CYP2C9*3/*3(3例)のCmaxは約4倍、AUCは約7倍高値を示すことが報告されている17)(外国人データ)。[10.参照]
CYP2C9には遺伝多型が存在し、Ile359→Leu359のアミノ酸置換により薬剤によっては代謝速度が低下する場合がある。日本人218例を対象としたCYP2C9の研究では、Ile359→Leu359のホモ接合体(CYP2C9*3/*3)は存在しなかったが、Leu359のヘテロ接合体(CYP2C9*1/*3)は218例中9例(4.1%)存在したとの報告がある14)。
CYP2C9の遺伝多型(CYP2C9*3)の影響として、セレコキシブを単回又は反復投与したとき、CYP2C9のヘテロ接合体(Ile359→Leu359、CYP2C9*1/*3)を有する健康成人15例のAUCは野生型(CYP2C9*1/*1)の健康成人137例に比べて約1.6倍と高値を示した15)。
健康成人にセレコキシブ100mgを単回投与注)したとき、CYP2C9*1/*1(4例)と比較し、CYP2C9*3/*3(3例)のAUCは約3倍高値を示し16)(外国人データ)、健康成人にセレコキシブ200mgを1日1回注)7日間反復投与したとき、CYP2C9*1/*1(7例)と比較し、CYP2C9*3/*3(3例)のCmaxは約4倍、AUCは約7倍高値を示すことが報告されている17)(外国人データ)。[10.参照]
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎障害患者
慢性腎障害患者(糸球体濾過率35〜60mL/分)22例にセレコキシブ200mgを1日2回、食後7日間反復投与したときのAUC0-72hは健康成人における値と大差なかった20)(外国人データ)。
16.6.2 肝障害患者
16.6.3 高齢者
健康高齢男女(66〜83歳)24例及び非高齢男女(19〜48歳)24例にセレコキシブ200mgを1日2回、8日間反復投与したとき、定常状態における空腹下投与時の高齢男女のCmax及びAUC0-12h(Cmax:1808ng/mL、AUC0-12h:11852ng・h/mL)は非高齢男女(Cmax:973ng/mL、AUC0-12h:5871ng・h/mL)と比較して高値を示した。また、高齢女性のCmax及びAUC0-12h(Cmax:2362ng/mL、AUC0-12h:15466ng・h/mL)は高齢男性(Cmax:1254ng/mL、AUC0-12h:8238ng・h/mL)より高値を示した22)(外国人データ)。
16.7 薬物相互作用
16.7.1 リチウム
16.7.2 フルコナゾール
16.7.3 フルバスタチン
16.7.4 ワルファリン
16.7.5 パロキセチン
16.7.6 デキストロメトルファン
16.7.7 制酸剤
注)本剤の承認された用法及び用量は関節リウマチ:100〜200mgを1日2回、変形性関節症、腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎:100mgを1日2回、手術後、外傷後、抜歯後の消炎・鎮痛:初回のみ400mg、2回目以降は1回200mgとして1日2回経口投与する。なお、投与間隔は6時間以上あけること。頓用の場合は、初回のみ400mg、必要に応じて以降は200mgを6時間以上あけて経口投与する。ただし、1日2回までとする。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 有効性の主要な成績(国内臨床試験)
国内で関節リウマチ、変形性関節症、腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎、手術後、外傷後及び抜歯後患者を対象に実施された臨床試験における有効性の主要な成績は以下のとおりであった。
| 疾患名 | 関節リウマチ | 変形性関節症 | ||||||
| 試験名 | 後期第II相試験33) | 第III相試験34) | 後期第II相試験35) | 第III相試験36) | ||||
| 薬剤 用法・用量 | プラセボ | セレコキシブ100mg 1日2回 | セレコキシブ200mg 1日2回 | セレコキシブ200mg 1日2回 | プラセボ | セレコキシブ100mg 1日2回 | プラセボ | セレコキシブ100mg 1日2回 |
| 投与期間 | 4週 | 12週 | 4週 | 4週 | ||||
| 有効性解析症例数a) | 74 | 72 | 79 | 318 | 90 | 84 | 151 | 295 |
| 患者の疼痛評価(VAS)平均変化量(mm) | 3.4±17.39 | −7.4±20.09 | −11.4±19.01 | −9.4±21.15 | −19.8±21.23 | −26.4±24.77 | −21.6f) | −30.6f) |
| 患者の疾患活動性全般評価(VAS)b)平均変化量(mm) | 2.5±19.82 | −7.5±17.03 | −9.3±18.07 | −9.3±20.26 | −20.2±20.69 | −25.1±24.07 | −20.0f) | −27.3f) |
| 医師の疾患活動性全般評価(VAS)c)平均変化量(mm) | −2.3±14.60 | −8.8±15.81 | −11.9±16.17 | −9.6±19.85 | −18.6±19.32 | −24.9±21.66 | −22.2f) | −30.2f) |
| ACR(変法)による改善率d) | 5/67(7.5%) | 12/72(16.7%) | 19/79(24.1%) | 68/318(21.4%) | / | |||
| 最終全般改善度判定による改善率e) | 17/73(23.3%) | 23/72(31.9%) | 25/79(31.6%) | 84/318(26.4%) | 45/90(50.0%) | 57/84(67.9%) | 74/151(49.0%) | 200/286(69.9%) |
| 疾患名 | 腰痛症 | 肩関節周囲炎 | 頸肩腕症候群 | 腱・腱鞘炎 |
| 試験名 | 第III相試験37) | 一般臨床試験38)39)40) | ||
| 薬剤 用法・用量 | セレコキシブ100mg 1日2回 | セレコキシブ100mg 1日2回 | ||
| 投与期間 | 4週 | 4週 | 4週 | 2週 |
| 有効性解析症例数g) | 414 | 74 | 80 | 79 |
| 患者の疼痛評価(VAS)平均変化量(mm) | −29.4f) | −33.2±20.57 | −34.3±21.28 | −31.5±19.80 |
| 患者の全般評価(VAS)平均変化量(mm) | −25.0f) | −32.4±23.56 | −36.0±21.77 | −28.1±20.41 |
| 医師の全般評価(VAS)平均変化量(mm) | −27.1f) | −39.9±22.72 | −37.3±17.38 | −33.5±19.75 |
| 患者の改善度評価改善率h) | / | 36/74(48.6%) | 43/80(53.8%) | 41/79(51.9%) |
| RDQi)平均変化量(スコア) | −3.6f) | / | ||
| 最終全般改善度 判定による改善率e) | 261/401(65.1%) | 48/74(64.9%) | 56/80(70.0%) | 53/79(67.1%) |
a)PPS(Per Protocol Set):治験実施計画書に適合した対象集団
b)変形性関節症では、患者の全般評価
c)変形性関節症では、医師の全般評価
d)ACR改善基準(変法)による改善率(以下の1)及び2)を満たす場合「改善」とする。1)疼痛関節数及び腫脹関節数がいずれも20%以上改善、2)患者の疼痛評価(Visual Analogue Scale:VAS)、患者の疾患活動性全般評価(VAS)、医師の疾患活動性全般評価(VAS)、患者の身体機能評価(mHAQ)の4項目のうち3項目以上において20%以上改善)
e)全般改善度判定の最終評価時における改善率又は最終全般改善度判定における改善率(「中等度改善」以上の割合)
f)共分散分析による調整済み平均値であるため、標準偏差については記載せず
g)FAS(Full Analysis Set):薬剤を1回以上服用し、投与後に有効性評価項目が評価されている対象集団
h)患者の改善度評価が「良くなった」以上の割合
i)RDQ(Roland-Morris Disability Questionnaire):生活行動の障害に関する24項目の質問
| 疾患名 | 抜歯後疼痛 | 抜歯後疼痛 | ||||||
| 試験名 | 第II相試験43)単回投与 | 第II相試験44)追加投与f) | ||||||
| 薬剤 用法・用量 | プラセボ | セレコキシブ | プラセボ | セレコキシブ200mg | ||||
| 25mg単回 | 50mg単回 | 100mg単回 | 200mg単回 | 400mg単回 | ||||
| 投与期間 | 1日(単回) | 1日(2回) | ||||||
| 有効性解析症例数a) | 53 | 58 | 54 | 54 | 53 | 58 | 58 | 64 |
| 患者の印象による有効率b) | 13/53(24.5%) | 28/58(48.3%) | 27/54(50.0%) | 39/54(72.2%) | 39/53(73.6%) | 47/58(81.0%) | 15/58(25.9%) | 41/64(64.1%) |
| 疼痛強度差(VAS)(mm)c) | / | 12.3±19.5 | 33.4±24.2 | |||||
a)FAS(Full Analysis Set)又はITT(Intention To Treat):薬剤を1回以上服用し、投与後に有効性評価項目が評価されている対象集団
b)患者の印象による有効率(「効いた」又は「よく効いた」と評価した患者の割合)
c)疼痛強度差(VAS)(患者による評価、ベースライン時−最終評価時)
d)初回セレコキシブ400mg投与後、同日にセレコキシブ200mgを投与し、翌日はセレコキシブ200mgを1日2回投与した
e)初回セレコキシブ400mg投与後、同日にセレコキシブ200mgを投与し、翌日以降はセレコキシブ200mgを1日2回投与した
f)セレコキシブ400mg投与後に、更に鎮痛薬を必要とした患者を対象に追加投与を行い、追加投与の有効性を評価した
17.1.2 消化管に対する影響(国内臨床試験)
関節リウマチ患者(投与期間:12週間)、変形性関節症患者(投与期間:4週間)を対象とする実薬対照試験2試験の被験者データを集計した結果、消化管障害(症状)全体での副作用発現率はセレコキシブ100〜200mg1日2回投与で12.6%(96/759)、対照薬(COX-2に対して選択性の低い非ステロイド性消炎・鎮痛剤)で13.4%(103/769)であった34)36)。腰痛症患者(投与期間:4週間)を対象とする実薬対照試験の結果では、消化管障害(臨床検査値異常変動を含む)全体での副作用発現率はセレコキシブ100〜200mg1日2回投与で21.4%(91/425)、対照薬(COX-2に対して選択性の低い非ステロイド性消炎・鎮痛剤)で24.5%(103/421)であった45)。[8.4参照]
17.1.3 心血管系に対する影響(国内臨床試験)
国内で実施した関節リウマチ患者(投与期間:12週間)、変形性関節症患者(投与期間:4週間)を対象とする実薬対照試験2試験の被験者データを集計した結果、重篤な心血管事象の発現率は、セレコキシブ100〜200mg1日2回投与で0%(0/759)、対照薬(COX-2に対して選択性の低い非ステロイド性消炎・鎮痛剤)で0.3%(2/769)であった34)36)。また、関節リウマチ患者(投与期間:4週間)及び変形性関節症患者(投与期間:4週間)を対象とするプラセボ対照二重盲検比較試験3試験における重篤な心血管事象の発現率はセレコキシブ100〜200mg1日2回投与で0%(0/675)、プラセボで0.2%(1/412)であった46)。なお、2007年の承認時までに実施された最長1年までの投与期間で安全性を評価した国内全臨床試験12試験(関節リウマチ、変形性関節症、腰痛症、肩関節周囲炎、頸肩腕症候群及び腱・腱鞘炎患者を対象とした臨床試験)の被験者データにおける重篤な心血管事象の発現率は、セレコキシブ25〜400mg1日2回投与注)で0.1%(2/2,398)であった46)47)48)。さらに、腰痛症、肩関節周囲炎、頸肩腕症候群(いずれも投与期間:4週間)及び腱・腱鞘炎患者(投与期間:2週間)を対象とした試験8試験の被験者データの集計では、重篤な心血管事象の発現率はセレコキシブ100〜200mg1日2回投与で0%(0/1,304)、プラセボで0.2%(1/411)、対照薬(COX-2に対して選択性の低い非ステロイド性消炎・鎮痛剤)で0.1%(1/831)であった49)。手術後(投与期間:2日間)、外傷後(投与期間:8日間)、抜歯後(投与期間:1回又は2回)の患者を対象とした試験4試験では、重篤な心血管事象の発現はセレコキシブ、プラセボ及び対照薬(非ステロイド性消炎・鎮痛剤)のいずれの投与後にも認められなかった50)。
17.2 製造販売後調査等
17.2.1 国内製造販売後臨床試験(健康成人の上部消化管粘膜に及ぼす影響の検討)
健康成人(投与期間:2週間)を対象とする実薬対照試験の結果、胃・十二指腸の潰瘍発現率(内視鏡所見※)はセレコキシブ100mg1日2回投与で1.4%(1/74)、対照薬(COX-2に対して選択性の低い非ステロイド性消炎・鎮痛剤)で27.6%(21/76)、プラセボで2.7%(1/37)であった51)。
セレコキシブ群の胃・十二指腸の潰瘍以外で2例以上の副作用の発現率は、びらん性胃炎10.5%(8/76)、腹部不快感2.6%(2/76)、上腹部痛2.6%(2/76)、胃炎2.6%(2/76)、口内炎2.6%(2/76)であった。
セレコキシブ群の胃・十二指腸の潰瘍以外で2例以上の副作用の発現率は、びらん性胃炎10.5%(8/76)、腹部不快感2.6%(2/76)、上腹部痛2.6%(2/76)、胃炎2.6%(2/76)、口内炎2.6%(2/76)であった。
※内視鏡データモニタリング委員会による判定
17.3 その他
17.3.1 長期予防投与試験(プラセボ比較大腸ポリープ再発予防試験)
外国において、セレコキシブの大腸ポリープ再発予防注)(本剤の効能又は効果ではない)の検討を目的とする2試験が実施され、このうちAPC試験(散発性大腸腺腫再発予防試験)では、3年間の治療期間中にプラセボと比較し、セレコキシブ投与での複合評価項目(心血管事象による死亡、心筋梗塞又は脳卒中)の発現率に用量相関的な増加が認められた。複合評価項目のプラセボに対するセレコキシブの相対リスクは400mg1日2回投与で3.4(95%CI:1.4-8.5)、200mg1日2回投与で2.8(95%CI:1.1-7.2)であった。3年間の複合評価項目の累積発現率では、プラセボでは0.9%(6/679)、セレコキシブ400mg1日2回投与で3.0%(20/671)、200mg1日2回投与で2.5%(17/685)であった。一方、PreSAP試験(大腸腺腫性ポリープ再発予防試験)では、複合評価項目についてプラセボと比較した相対リスクは400mg1日1回投与で1.2(95%CI:0.6-2.4)で有意なリスクの増大は認められなかった。3年間の複合評価項目の累積発現率では、プラセボでは1.9%(12/628)、セレコキシブ400mg1日1回投与で2.3%(21/933)であった52)53)54)(外国人データ)。[1.参照]
注)本剤の承認された用法及び用量は関節リウマチ:100〜200mgを1日2回、変形性関節症、腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎:100mgを1日2回、手術後、外傷後、抜歯後の消炎・鎮痛:初回のみ400mg、2回目以降は1回200mgとして1日2回経口投与する。なお、投与間隔は6時間以上あけること。頓用の場合は、初回のみ400mg、必要に応じて以降は200mgを6時間以上あけて経口投与する。ただし、1日2回までとする。
18. 薬効薬理
18.1 作用機序
18.2 抗炎症及び鎮痛作用
18.3 消化管に対する作用
18.4 血小板凝集に対する作用
セレコキシブは、ヒト末梢血血小板においてアラキドン酸惹起血小板凝集を抑制しなかった。一方、ロキソプロフェン、インドメタシン、ジクロフェナク及びイブプロフェンは濃度依存的に血小板凝集を抑制した56)(in vitro試験)。
18.5 ニューキノロン系抗菌薬との併用
19. 有効成分に関する理化学的知見
19.1. セレコキシブ
22. 包装
<セレコキシブ錠100mg「ダイト」>
100錠[10錠(PTP)×10]
<セレコキシブ錠200mg「ダイト」>
100錠[10錠(PTP)×10]
23. 主要文献
- Sakai M,et al., Mol.Hum.Reprod., 7 (6), 595-602, (2001) »PubMed
- Takahashi Y,et al., Am.J.Physiol.Regul.Integr.Comp.Physiol., 278 (6), R1496-R1505, (2000)
- Knoppert DC,et al., Pharmacotherapy., 23 (1), 97-100, (2003) »PubMed
- Hale TW,et al., J.Hum.Lact., 20 (4), 397-403, (2004) »PubMed
- 藤田雅己他, Prog.Med., 26 (Suppl.3), 2960-2969, (2006)
- 松岡治他, Prog.Med., 26 (Suppl.3), 2970-2976, (2006)
- 松岡治他, Prog.Med., 26 (Suppl.3), 2977-2987, (2006)
- 関節リウマチ及び変形性膝関節症患者・薬物動態(セレコックス錠:2007年1月26日承認、申請資料概要2.7.2.3)
- 社内資料:生物学的同等性試験(セレコキシブ錠100mg「ダイト」)
- 社内資料:生物学的同等性試験(セレコキシブ錠200mg「ダイト」)
- Paulson SK,et al., Biopharm.Drug Dispos., 20 (6), 293-299, (1999) »PubMed
- Tang C,et al., J.Pharmacol.Exp.Ther., 293 (2), 453-459, (2000) »PubMed
- 海外健康成人・代謝及び薬物相互作用(セレコックス錠:2007年1月26日承認、申請資料概要2.7.2.2、2.7.2.5)
- Nasu K,et al., Pharmacogenetics., 7 (5), 405-409, (1997) »PubMed
- CYP2C9*3の影響(セレコックス錠:2007年1月26日承認、申請資料概要2.7.2.3)
- Kirchheiner J,et al., Pharmacogenetics., 13 (8), 473-480, (2003) »PubMed
- Lundblad MS,et al., Clin.Pharmacol.Ther., 79 (3), 287-288, (2006) »PubMed
- Paulson SK,et al., Drug Metab.Dispos., 28 (3), 308-314, (2000) »PubMed
- マスバランス試験(セレコックス錠:2007年1月26日承認、申請資料概要2.7.1.2)
- 慢性腎障害患者における薬物動態試験(外国)(セレコックス錠:2007年1月26日承認、申請資料概要2.7.6.17)
- 肝障害患者における薬物動態試験(外国)(セレコックス錠:2007年1月26日承認、申請資料概要2.7.2.2)
- 健常高齢者及び健常非高齢者における薬物動態試験(外国)(セレコックス錠:2007年1月26日承認、申請資料概要2.7.6.15)
- リチウムとの薬物相互作用試験(セレコックス錠:2007年1月26日承認、申請資料概要2.7.6.20)
- 海外健康成人・代謝及び薬物相互作用(セレコックス錠:2007年1月26日承認、申請資料概要2.7.6.18)
- フルバスタチンとの薬物相互作用試験(セレコックス錠:2007年1月26日承認、申請資料概要2.7.6.27)
- 薬物相互作用試験の要約(セレコックス錠:2007年1月26日承認、申請資料概要2.7.2.5)
- Karim A,et al., J.Clin.Pharmacol., 40 (6), 655-663, (2000) »PubMed
- パロキセチンとの薬物相互作用(外国,パロキセチンの影響)(セレコックス錠:2007年1月26日承認、申請資料概要2.7.6.30)
- パロキセチンとの相互作用試験(外国,セレコキシブの影響)(セレコックス錠:2007年1月26日承認、申請資料概要2.7.6.31)
- デキストロメトルファンとの薬物相互作用試験(外国)(セレコックス錠:2007年1月26日承認、申請資料概要2.7.6.28)
- 食事及び制酸剤の影響試験(外国)(セレコックス錠:2007年1月26日承認、申請資料概要2.7.6.25)
- 食事及び制酸剤の影響試験(外国)(セレコックス錠:2007年1月26日承認、申請資料概要2.7.2.2)
- 安倍達他, Prog.Med., 26 (Suppl.3), 2788-2819, (2006)
- 安倍達他, Prog.Med., 26 (Suppl.3), 2820-2845, (2006)
- 青木虎吉他, Prog.Med., 26 (Suppl.3), 2869-2910, (2006)
- 菅原幸子, Prog.Med., 26 (Suppl.3), 2911-2931, (2006)
- 菊地臣一他, Prog.Med., 29 (Suppl.2), 2853-2872, (2009)
- 高岸憲二他, Prog.Med., 29 (Suppl.2), 2893-2917, (2009)
- 高岸憲二他, Prog.Med., 29 (Suppl.2), 2918-2940, (2009)
- 荻野利彦他, Prog.Med., 29 (Suppl.2), 2941-2963, (2009)
- 手術後疼痛試験(セレコックス錠:2011年12月22日承認、審査報告書)
- 太田博嘉他, Prog.Med., 30 (12), 3117-3130, (2010)
- 代田達夫他, 歯科薬物療法, 20 (3), 154-172, (2001) »DOI
- 抜歯後疼痛追加投与試験(セレコックス錠:2011年12月22日承認、審査報告書)
- 腰痛症患者・国内臨床試験(セレコックス錠:2007年1月26日承認、申請資料概要2.7.6.37)
- 重篤な心血管系事象(セレコックス錠:2007年1月26日承認、申請資料概要2.7.4.2)
- RAに対する長期投与試験(セレコックス錠:2007年1月26日承認、申請資料概要2.7.6.43)
- OAに対する長期投与試験(セレコックス錠:2007年1月26日承認、申請資料概要2.7.6.44)
- 臨床に関する資料(セレコックス錠:2009年6月17日承認、審査報告書)
- 臨床に関する資料(セレコックス錠:2011年12月22日承認、審査報告書)
- 製造販売後臨床試験(セレコックス錠:2020年3月18日承認、再審査報告書)
- Bertagnolli MM,et al., N.Engl.J.Med., 355 (9), 873-884, (2006) »PubMed
- Arber N,et al., N.Engl.J.Med., 355 (9), 885-895, (2006) »PubMed
- Solomon SD,et al., Circulation., 114 (10), 1028-1035, (2006) »PubMed
- Penning TD,et al., J.Med.Chem., 40 (9), 1347-1365, (1997) »PubMed
- Yoshino T,et al., Arzneimittel-Forschung/Drug Res., 55 (7), 394-402, (2005)
- Noguchi M,et al., Eur.J.Pharmacol., 513 (3), 229-235, (2005) »PubMed
- 抗炎症作用(セレコックス錠:2007年1月26日承認、申請資料概要2.6.2.2)
- 鎮痛作用(セレコックス錠:2007年1月26日承認、申請資料概要2.6.2.2)
- 消化管粘膜に対する作用(セレコックス錠:2007年1月26日承認、申請資料概要2.6.2.2)
- 厚生省薬務局:医薬品副作用情報No.98, (1989)
- Yoshino T,et al., Eur.J.Pharmacol., 507 (1-3), 69-76, (2005) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
共創未来ファーマ株式会社
お客様相談室
〒155-8655
東京都世田谷区代沢4-43-11
電話:050-3383-3846
製品情報問い合わせ先
共創未来ファーマ株式会社
お客様相談室
〒155-8655
東京都世田谷区代沢4-43-11
電話:050-3383-3846
26. 製造販売業者等
26.1 製造販売元
ダイト株式会社
富山県富山市八日町326番地
26.2 販売元
共創未来ファーマ株式会社
東京都品川区広町1-4-4