医薬品情報
| 総称名 | タルチレリン |
|---|---|
| 一般名 | タルチレリン水和物 |
| 欧文一般名 | Taltirelin Hydrate |
| 薬効分類名 | 経口脊髄小脳変性症治療剤 |
| 薬効分類番号 | 1190 |
| KEGG DRUG |
D01925
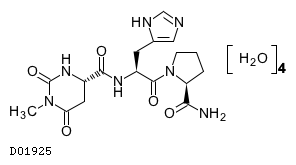
タルチレリン水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年3月 改訂(第1版)

|
4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| タルチレリン錠5mg「サワイ」 (後発品) | TALTIRELIN Tablets[SAWAI] | 沢井製薬 | 1190014F1068 | 200.4円/錠 | 処方箋医薬品注) |
| タルチレリンOD錠5mg「サワイ」 (後発品) | TALTIRELIN OD Tablets[SAWAI] | 沢井製薬 | 1190014F2064 | 200.4円/錠 | 処方箋医薬品注) |
4. 効能または効果
脊髄小脳変性症における運動失調の改善
5. 効能または効果に関連する注意
5.1 運動失調を呈する類似疾患が他にも知られていることから、病歴の聴取及び全身の理学的所見に基づいた確定診断のうえ投与を行うこと。
6. 用法及び用量
通常、成人にはタルチレリン水和物として1回5mg、1日2回(朝、夕)食後に経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 内分泌異常のある患者
臨床症状を観察し、必要に応じて血中ホルモン濃度(TSH、プロラクチン等)を測定することが望ましい。
9.2 腎機能障害患者
重度の腎機能障害患者1例で血漿中濃度が約4.2倍上昇した。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)で乳汁への移行が認められている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
用量に注意して投与すること。本剤は主として腎臓から排泄されるが、高齢者では腎機能が低下していることが多いため、高い血中濃度が持続するおそれがある。
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 痙攣(1%未満)
11.1.2 悪性症候群(1%未満)
発熱、無動緘黙、筋強剛、脱力、頻脈、血圧の変動等があらわれることがあるので、このような症状があらわれた場合には投与を中止し、体冷却、水分補給などの適切な処置を行うこと。また、本症発症時には、白血球の増加や血清CKの上昇があらわれることが多く、また、ミオグロビン尿を伴う腎機能の低下があらわれることがある。
11.1.3 肝機能障害、黄疸(いずれも1%未満)
AST、ALT、ALP、LDH、γ-GTPの上昇等を伴う肝機能障害や黄疸があらわれることがある。
11.1.4 ショック様症状(頻度不明)
一過性の血圧低下、意識喪失等のショック様症状があらわれることがある。
11.1.5 血小板減少(頻度不明)
注)発現頻度は、製造販売後調査の結果を含む。
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | |
| 血液 | 赤血球減少、ヘモグロビン減少 | |
| 循環器 | 血圧及び脈拍数の変動、動悸 | |
| 消化器 | 悪心、嘔吐、下痢、食欲不振、胃部不快感、胃炎、腹痛、口渇、便秘 | 舌炎 |
| 肝臓 | AST、ALT、γ-GTP、ALP、LDH、トリグリセリド、総コレステロールの上昇 | |
| 腎臓 | BUNの上昇 | |
| 精神神経系 | 頭痛、めまい、ふらつき、振戦 | しびれ、眠気、頭がボーっとする、不眠 |
| 過敏症 | 発疹、そう痒 | |
| 内分泌 | TSHの変動、甲状腺ホルモン(T3、T4)、プロラクチンの上昇 | 女性化乳房 |
| その他 | CKの上昇、血糖上昇、熱感、倦怠感、頻尿 | 脱毛 |
14. 適用上の注意
14.1 薬剤交付時の注意
<製剤共通>
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
<OD錠>
14.1.2 本剤は舌の上にのせて唾液を浸潤させると崩壊するため、水なしで服用可能である。また、水で服用することもできる。
14.1.3 寝たままの状態では、水なしで服用しないこと。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子6例にタルチレリン水和物錠0.5〜40mgを単回経口投与注)した時の血漿中タルチレリン濃度は投与約3時間後で最高濃度(0.15〜10.81ng/mL)に達し、消失半減期はおよそ2時間であった。Cmax及びAUCは用量に比例して増加し、Tmax及びt1/2は投与量にかかわらずほぼ一定値を示した1)。
16.1.2 反復投与
健康成人男子6例に対するタルチレリン水和物錠2.5mg1日2回あるいは5mg1日1回2週間反復経口投与注)によっても蓄積性は認められず、投与初日と14日目の血漿中濃度推移に差はみられなかった2)。
16.1.3 生物学的同等性試験
<タルチレリン錠5mg「サワイ」>
タルチレリン錠5mg「サワイ」とセレジスト錠5mgを健康成人男子にそれぞれ1錠(タルチレリン水和物として5mg)空腹時単回経口投与(クロスオーバー法)し、血漿中タルチレリン濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された3)。
| Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-12hr(ng・hr/mL) | |
| タルチレリン錠5mg「サワイ」 | 3.28±3.38 | 3.6±1.2 | 2.2±0.4 | 18.71±16.52 |
| セレジスト錠5mg | 2.99±1.88 | 4.2±1.7 | 2.6±1.0 | 17.68±7.22 |
<タルチレリンOD錠5mg「サワイ」>
タルチレリンOD錠5mg「サワイ」とセレジストOD錠5mgを健康成人男子にそれぞれ1錠(タルチレリン水和物として5mg)空腹時単回経口投与(クロスオーバー法)し、血漿中タルチレリン濃度を測定した。得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された4)。
| Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0-12hr(ng・hr/mL) | ||
| 水なし | タルチレリンOD錠5mg「サワイ」 | 2.93±1.07 | 3.6±1.3 | 2.1±0.3 | 17.16±5.64 |
| セレジストOD錠5mg | 2.71±1.08 | 3.5±1.0 | 2.2±0.4 | 16.49±6.25 | |
| 水あり | タルチレリンOD錠5mg「サワイ」 | 2.26±0.60 | 3.5±1.1 | 2.1±0.4 | 13.57±3.60 |
| セレジストOD錠5mg | 2.44±0.66 | 3.3±1.2 | 2.3±0.6 | 14.09±3.64 |
<水なしで服用時の血中濃度曲線>
<水で服用時の血中濃度曲線>
血漿中濃度ならびにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
健康成人男子にタルチレリン水和物錠5mgを空腹時及び食後に単回投与した時の血漿中タルチレリン濃度のCmaxは食後で空腹時のおよそ77%、AUCは食後で空腹時のおよそ75%と低下がみられた5)。
16.3 分布
健康成人男子にタルチレリン水和物錠5mgを単回経口投与した場合、投与3及び6時間後の血漿蛋白へのタルチレリンの結合は認められなかった6)。
16.4 代謝
16.5 排泄
健康成人にタルチレリン水和物錠5mgを単回経口投与した場合、投与24時間後までの未変化体と代謝物アシド体の尿中排泄量はともに投与量の1〜2%であった1)。
注)本剤の承認された用法及び用量は、通常、1回5mg1日2回である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
脊髄小脳変性症427例を対象に、プラセボを対照としたタルチレリン水和物錠1日10mg1日2回経口投与の最長1年間投与の二重盲検群間比較試験の結果、投与28週後の種々の運動失調検査では明確な差を認めていないが、主たる評価項目である全般改善度及び運動失調検査概括改善度で、タルチレリン水和物錠は有意にプラセボに優れることが示された。また、28週後のKaplan-Meier法による累積悪化率はタルチレリン水和物錠投与群27.7%、プラセボ投与群41.7%であり、その差は有意であった。なお、投与1年後までの全般改善度(悪化率)のlog-rank検定では、プラセボとの差を認めなかった。
副作用は199例中28例(14.1%)に40件認められ、主な副作用は、めまい・ふらつき5件、胃部不快感4件、悪心及び食欲不振がいずれも3件であった8)9)。
副作用は199例中28例(14.1%)に40件認められ、主な副作用は、めまい・ふらつき5件、胃部不快感4件、悪心及び食欲不振がいずれも3件であった8)9)。
18. 薬効薬理
18.1 作用機序
18.1.1 種々の受容体及びイオンチャンネルに対するタルチレリン水和物の親和性の検討では、TRH受容体に対してのみ親和性を示した10)。
18.2 運動失調改善作用
18.2.1 遺伝性運動失調マウスであるRolling Mouse Nagoyaに対してタルチレリン水和物(1mg/kg、経口投与)は、転倒指数(転倒回数/自発運動量)を改善するとともに、脳幹腹側被蓋野の低下していた脳グルコース代謝率を正常レベルへ上昇させた(3mg/kg、腹腔内投与)13)14)。
18.2.2 3-アセチルピリジンによる運動失調ラットに対してタルチレリン水和物(3mg/kg、経口投与)は、運動失調(歩行速度、歩長、歩角)を改善した。なお、この効果は興奮性アミノ酸拮抗薬により消失した13)15)。
18.2.3 ラットを用いた毒性試験では、1.5mg/kg、経口投与以上で薬効に基づくと思われる一過性の運動亢進、身震い等が発現した16)。
18.3 神経栄養因子様作用
18.4 下垂体-甲状腺ホルモン刺激作用
19. 有効成分に関する理化学的知見
19.1. タルチレリン水和物
20. 取扱い上の注意
アルミピロー包装開封後は、湿気を避けて保存すること。
22. 包装
<タルチレリン錠5mg「サワイ」>
PTP
28錠(14錠×2)
<タルチレリンOD錠5mg「サワイ」>
PTP
28錠(14錠×2)
23. 主要文献
- 甲斐沼正他, 臨床医薬, 13 (10), 2501-2516, (1997)
- 甲斐沼正他, 臨床医薬, 13 (10), 2517-2532, (1997)
- 陶易王他, 診療と新薬, 49 (3), 319-326, (2012)
- たか野和彦他, 新薬と臨床, 65 (4), 461-471, (2016)
- 藤田雅巳他, 臨床医薬, 13 (13), 3359-3369, (1997)
- 分布(セレジスト錠:2000年7月3日承認、申請資料概要ヘ.II.2.(5))
- 代謝(セレジスト錠:2000年7月3日承認、申請資料概要ヘ.III.1.(1))
- 金澤一郎他, 臨床医薬, 13 (16), 4169-4224, (1997)
- 国内第III相試験(セレジスト錠:2000年7月3日承認、申請資料概要ト.I.3)
- 作用機序(セレジスト錠:2000年7月3日承認、申請資料概要ホ.IV)
- Kinoshita,K.et al., Jpn.J.Pharmacol., 71 (2), 139-145, (1996) »PubMed
- Fukuchi,I.et al., Arzneimittelforschung, 48 (4), 353-359, (1998) »PubMed
- Kinoshita,K.et al., Eur.J.Pharmacol., 274 (1-3), 65-72, (1995) »PubMed
- Kinoshita,K.et al., Br.J.Pharmacol., 116 (8), 3274-3278, (1995) »PubMed
- Kinoshita,K.et al., Eur.J.Pharmacol., 343 (2-3), 129-133, (1998) »PubMed
- 運動失調改善作用(セレジスト錠:2000年7月3日承認、申請資料概要ニ.III.1)
- Iwasaki,Y.et al., J.Neurol.Sci., 112 (1-2), 147-151, (1992) »PubMed
- Iwasaki,Y.et al., Neurol.Res., 19 (6), 613-616, (1997) »PubMed
- 森安眞津子他, 日薬理誌, 107 (6), 285-297, (1996) »PubMed
- 下垂体-甲状腺ホルモン刺激作用(セレジスト錠:2000年7月3日承認、申請資料概要ホ.II.8)
24. 文献請求先及び問い合わせ先
文献請求先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
製品情報問い合わせ先
沢井製薬株式会社
医薬品情報センター
〒532-0003
大阪市淀川区宮原5丁目2-30
電話:0120-381-999
FAX:06-7708-8966
26. 製造販売業者等
26.1 製造販売元
沢井製薬株式会社
大阪市淀川区宮原5丁目2-30