医薬品情報
| 総称名 | ロラタジン |
|---|---|
| 一般名 | ロラタジン |
| 欧文一般名 | Loratadine |
| 製剤名 | ロラタジン錠、ロラタジン口腔内崩壊錠 |
| 薬効分類名 | 持続性選択H1受容体拮抗・アレルギー性疾患治療剤 |
| 薬効分類番号 | 4490 |
| ATCコード | R06AX13 |
| KEGG DRUG |
D00364
ロラタジン
|
| KEGG DGROUP |
DG01482
ヒスタミンH1受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年5月 作成(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 12.臨床検査結果に及ぼす影響 13.過量投与 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ロラタジン錠10mg「フェルゼン」 (後発品) | Loratadine Tablets 10mg「FELDSENF」 | フェルゼンファーマ | 4490027F1227 | 14.8円/錠 | |
| ロラタジンOD錠10mg「フェルゼン」 (後発品) | Loratadine OD Tablets 10mg「FELDSENF」 | フェルゼンファーマ | 4490027F2282 | 14.8円/錠 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
成人
通常、ロラタジンとして1回10mgを1日1回、食後に経口投与する。なお、年齢・症状により適宜増減する。
小児
通常、7歳以上の小児にはロラタジンとして1回10mgを1日1回、食後に経口投与する。
8. 重要な基本的注意
<効能共通>
8.1 効果が認められない場合には、漫然と長期にわたり投与しないように注意すること。
<アレルギー性鼻炎>
8.2 季節性の患者に投与する場合は、好発季節を考えて、その直前から投与を開始し、好発季節終了時まで続けることが望ましい。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 てんかんの既往のある患者
十分な問診を行うこと。発作があらわれたとの報告がある。[11.1.2参照]
9.2 腎機能障害患者
ロラタジン及び活性代謝物descarboethoxyloratadine(DCL)の血漿中濃度が上昇するおそれがある。[16.6.1参照]
9.3 肝機能障害患者
ロラタジンの血漿中濃度が上昇するおそれがある。[16.6.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、投与しないことが望ましい。動物試験(ラット、ウサギ)で催奇形性は認められていないが、ラットで胎児への移行が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒト母乳中への移行が報告されている。[16.5参照]
9.7 小児等
9.7.1 3歳以上7歳未満の小児に対しては、ロラタジンドライシロップ1%を投与すること。
9.7.2 低出生体重児、新生児、乳児又は3歳未満の幼児を対象とした臨床試験は実施していない。
9.8 高齢者
高い血中濃度が持続するおそれがある。一般に生理機能(肝、腎等)が低下している。[16.6.4参照]
10. 相互作用
相互作用序文
ロラタジンからDCLへの代謝にはCYP3A4及びCYP2D6の関与が確認されている。[16.4参照]
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2D6
10.2 併用注意
| エリスロマイシン、シメチジン [16.7参照] | ロラタジン及びDCLの血漿中濃度の上昇が認められるので、患者の状態を十分に観察するなど注意すること。 | 薬物代謝酵素(CYP3A4、CYP2D6)阻害作用を有する医薬品との併用により、ロラタジンからDCLへの代謝が阻害され、ロラタジンの血漿中濃度が上昇する。[DCLの血漿中濃度が上昇する機序は不明] |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
チアノーゼ、呼吸困難、血圧低下、血管浮腫等があらわれた場合には投与を中止し、適切な処置を行うこと。
11.1.2 てんかん(頻度不明)[9.1.1参照]
11.1.3 痙攣(頻度不明)
11.1.4 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTP、Al-P、LDH、ビリルビン等の著しい上昇を伴う肝機能障害、黄疸があらわれることがある。
11.2 その他の副作用
| 1%以上 | 0.1〜1%未満 | 0.1%未満 | 頻度不明 | |
| 精神神経系 | 眠気、倦怠感 | めまい、頭痛 | ||
| 呼吸器 | 鼻の乾燥感、咽頭痛 | |||
| 消化器 | 腹痛、口渇、嘔気・嘔吐、下痢、便秘、口内炎 | 口唇乾燥 | 胃炎 | |
| 過敏症 | 発疹 | じん麻疹 | 発赤、紅斑、そう痒 | |
| 皮膚 | 脱毛 | |||
| 肝臓 | ALT上昇、AST上昇、ビリルビン値上昇、γ-GTP上昇、Al-P上昇 | |||
| 腎臓 | BUN上昇、タンパク尿 | 尿閉 | ||
| 循環器 | 動悸 | 頻脈 | ||
| 血液 | 好酸球増多、白血球減少、好中球減少、単球増多、リンパ球減少、白血球増多、リンパ球増多、ヘマトクリット減少、ヘモグロビン減少、好塩基球増多、血小板減少、好中球増多 | |||
| その他 | 尿糖、眼球乾燥、耳鳴、ほてり | 味覚障害、月経不順、胸部不快感 | 不正子宮出血、胸痛、難聴、浮腫(顔面・四肢) |
12. 臨床検査結果に及ぼす影響
アレルゲン皮内反応を抑制するため、アレルゲン皮内反応検査を実施する3〜5日前より本剤の投与を中止すること。
13. 過量投与
14. 適用上の注意
14.1 薬剤交付時の注意
<製剤共通>
14.1.1 PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
<OD錠>
14.1.2 本剤は口腔内で速やかに崩壊することから唾液のみ(水なし)でも服用可能であるが、口腔粘膜から吸収されることはないため、水なしで服用した場合は唾液で飲み込むこと。
14.1.3 本剤は寝たままの状態では水なしで服用しないこと。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性(6例)にロラタジン錠10、20注)、40mg注)を空腹時に単回経口投与したとき、DCLの血漿中濃度について線形性が認められた1)。
16.1.2 反復投与
健康成人男性(5例)にロラタジン錠10mgを1日1回5日間、空腹時に反復経口投与したとき、血漿中ロラタジン濃度は連投開始後4日までに定常状態に到達し、AUC(0-24hr)について算出した累積係数は1.3であった。
健康成人男性(6例)にロラタジン錠20mg注)を1日1回5日間、空腹時に反復経口投与したとき、血漿中ロラタジン及びDCL濃度は連投開始後4日までに定常状態に到達し、AUC(0-24hr)について算出した累積係数はともに1.3であった2)。
健康成人男性(6例)にロラタジン錠20mg注)を1日1回5日間、空腹時に反復経口投与したとき、血漿中ロラタジン及びDCL濃度は連投開始後4日までに定常状態に到達し、AUC(0-24hr)について算出した累積係数はともに1.3であった2)。
16.1.3 生物学的同等性試験
<ロラタジン錠10mg「フェルゼン」>
ロラタジン錠10mg「フェルゼン」とクラリチン錠10mgを、クロスオーバー法によりそれぞれ1錠(ロラタジンとして10mg)健康成人男性に絶食単回経口投与して血漿中ロラタジン活性代謝物濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された3)。
| 判定パラメータ | 参考パラメータ | |||
| AUC(0-72)(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
| ロラタジン錠10mg「フェルゼン」 | 89.48±27.76 | 10.17±3.42 | 1.5±0.5 | 18.8±4.0 |
| クラリチン錠10mg | 83.16±23.21 | 9.04±3.34 | 1.3±0.4 | 23.0±3.6 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
<ロラタジンOD錠10mg「フェルゼン」>
ロラタジンOD錠10mg「フェルゼン」とクラリチンレディタブ錠10mgを、クロスオーバー法によりそれぞれ1錠(ロラタジンとして10mg)健康成人男性に絶食単回経口投与(水で服用及び水なしで服用)して血漿中ロラタジン活性代謝物濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両剤の生物学的同等性が確認された3)。
(1)水で服用
| 判定パラメータ | 参考パラメータ | |||
| AUC(0-72)(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
| ロラタジンOD錠10mg「フェルゼン」 | 94.22±36.53 | 9.68±4.37 | 1.5±0.5 | 23.8±5.8 |
| クラリチンレディタブ錠10mg | 108.07±44.61 | 10.78±4.51 | 1.5±0.4 | 22.7±6.7 |
(2)水なしで服用
| 判定パラメータ | 参考パラメータ | |||
| AUC(0-72)(ng・hr/mL) | Cmax(ng/mL) | tmax(hr) | t1/2(hr) | |
| ロラタジンOD錠10mg「フェルゼン」 | 68.82±25.44 | 6.13±1.95 | 1.5±0.5 | 19.7±7.1 |
| クラリチンレディタブ錠10mg | 65.30±35.39 | 5.53±2.11 | 1.9±0.5 | 22.4±10.3 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 食事の影響(錠10mg)
健康成人男性(12例)にロラタジン錠10mgを食後又は空腹時に単回経口投与したときのロラタジン及びDCLの薬物動態パラメータは、以下のとおりであった4)※。
※:成人又は小児を対象とした二重盲検比較試験はすべて食後投与の条件で実施されたため、用法・用量では食後投与を規定した。
| Cmax(ng/mL) | tmax(hr) | AUC(0-∞)(ng・hr/mL) | t1/2(hr) | ||
| ロラタジン | 食後 | 7.73±6.81 | 1.6±0.4 | 31.2±36.3 | 14.3±7.8 |
| 空腹時 | 4.46±4.98 | 1.2±0.3 | 15.4±20.5 | 11.2±8.4 | |
| DCL | 食後 | 3.52±0.78 | 2.3±0.6 | 41.1±11.8 | 14.5±3.3 |
| 空腹時 | 3.34±0.70 | 1.7±0.3 | 34.9±6.4 | 12.5±4.7 | |
16.3 分布
16.3.1 血漿タンパク結合
ヒト血漿に添加したときのタンパク結合率は、ロラタジン96.8〜97.9%、DCL73.3〜75.6%であった(測定法:平衡透析法)5)(in vitro)。
16.3.2 組織中放射能濃度(ラット)
ラット(n=3)に14C-ロラタジンを反復経口投与したとき、組織中放射能は大部分の組織で血漿より高く、特に下垂体、甲状腺、副腎、肝臓、涙腺、肺に高濃度の分布が認められた。また、脳内濃度は血漿より低かった。組織中放射能の生物学的半減期は、いずれの組織とも血漿より長かった。甲状腺では14日間反復投与でも定常状態に到達せず、蓄積性が示唆された6)。
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
(1)薬物動態パラメータ
(2)血液透析患者
16.6.2 肝機能障害患者
16.6.3 小児
健康小児(13例、8〜12歳)にロラタジンシロップ10mg(非売品)を食後に単回経口投与したときのロラタジン及びDCLの薬物動態パラメータは、以下のとおりであった12)(外国人データ)。
| Cmax(ng/mL) | tmax(hr) | AUC(0-t)(ng・hr/mL) | t1/2(hr) | |
| ロラタジン | 4.38±3.13 | 1.00±0.00 | 8.98±6.21 | − |
| DCL | 3.79±0.98 | 1.69±0.95 | 51.7±25.3 | 13.8±3.1 |
小児及び成人の通年性アレルギー性鼻炎患者を対象とした国内製造販売後臨床薬理試験において、小児患者(104例、7〜15歳)及び成人患者(104例、16〜64歳)にそれぞれロラタジン錠10mgを1日1回28日間反復投与したときのロラタジン及びDCLによる全身曝露は、互いに類似していた13)。
16.6.4 高齢者
16.7 薬物相互作用
健康成人男性にロラタジン錠10mg及びエリスロマイシン(CYP3A4の阻害剤)又はシメチジン(CYP3A4及びCYP2D6の阻害剤)を空腹時に10日間経口投与したときの血漿中ロラタジン及びDCL濃度の変化率は下表に示すとおりであったが、QTc間隔を含め心電図への影響は認められなかった15)16)。健康成人男性にロラタジン錠10mg及びケトコナゾール(国内では外用剤のみ発売)を空腹時に10日間経口投与したとき、血漿中ロラタジン及びDCL濃度の変化率は下表に示すとおりであったが、QTc間隔を含め心電図への影響は認められなかった16)(外国人データ)。[10.2参照]
| 併用薬 | n | ロラタジン | DCL | ||
| Cmax | AUC | Cmax | AUC | ||
| エリスロマイシン (500mg1日3回) | 22 | +53% | +40% | +61% | +46% |
| シメチジン (300mg1日4回) | 24 | +121% | +103% | +6% | +6% |
| ケトコナゾール (200mg1日2回) | 24 | +223% | +307% | +67% | +73% |
16.8 その他
DCLの効力比は未変化体(ロラタジン)の7.9倍であり、ヒトに経口投与したときの主たる薬効に寄与しているのはDCLである17)。
注)本剤の成人における承認用量は、「通常、ロラタジンとして1回10mgを1日1回、食後に経口投与する。」である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<アレルギー性鼻炎>
17.1.1 国内長期投与試験(成人)
通年性アレルギー性鼻炎に対してロラタジン錠10mgを1日1回9週間投与したときの最終全般改善率(中等度改善以上)は65.3%(32/49)であった。
副作用は53例中8例(15.1%)に認められた。副作用は、眠気6例(11.3%)、倦怠感、嘔気及び発疹が各1例(1.9%)であった18)。
副作用は53例中8例(15.1%)に認められた。副作用は、眠気6例(11.3%)、倦怠感、嘔気及び発疹が各1例(1.9%)であった18)。
17.1.2 国内第III相比較試験(メキタジンを対照とした比較試験)(成人)
通年性アレルギー性鼻炎を対象とした二重盲検比較試験において、ロラタジン錠10mg(1日1回)あるいはメキタジン3mg(1日2回)を1週間投与したときの最終全般改善率(中等度改善以上)はそれぞれ49.4%(39/79)と45.8%(38/83)であった。
副作用は100例中7例(7.0%)に認められた。副作用は、眠気4例(4.0%)、倦怠感2例(2.0%)、胃部不快感、嘔気及び発疹が各1例(1.0%)であった19)。
副作用は100例中7例(7.0%)に認められた。副作用は、眠気4例(4.0%)、倦怠感2例(2.0%)、胃部不快感、嘔気及び発疹が各1例(1.0%)であった19)。
17.1.3 国内第III相比較試験(プラセボ及びケトチフェンフマル酸塩を対照とした比較試験)(成人)
通年性アレルギー性鼻炎を対象とした二重盲検比較試験において、ロラタジン錠(10mg/日)、ケトチフェンフマル酸塩(ケトチフェンとして2mg/日)あるいはプラセボを2週間投与したときの最終全般改善率(中等度改善以上)はロラタジン群54.9%(56/102)、ケトチフェンフマル酸塩群55.1%(59/107)、プラセボ群39.1%(27/69)であった。また、5鼻症状スコア※1(くしゃみ発作、鼻汁、鼻閉、鼻内そう痒感、後鼻漏)の投与前値及び投与2週後(又は中止時)の変化量を下表に示した。
| 投与群 | n | 投与前(標準誤差) | 変化量 | 比較※2 |
| ロラタジン | 102 | 8.23(0.22) | −2.84 | ロラタジンvsケトチフェン 95%CI:−0.62〜0.69 |
| ケトチフェン | 107 | 7.41(0.22) | −2.48 | |
| プラセボ | 69 | 7.90(0.25) | −1.77 |
※1:各症状の程度を+++:3、++:2、+:1、−:0にスコア化して合計したスコア。
※2:投与前値を共変量とした共分散分析により、変化量の差(ロラタジン−ケトチフェン)の95%両側信頼区間(95%CI)を算出した。
副作用は103例中26例(25.2%)に認められた。主な副作用は、眠気14例(13.6%)、口渇感3例(2.9%)、咽頭痛、鼻の乾燥感及び倦怠感が各2例(1.9%)等であった20)。
17.1.4 国内第III相比較試験(ケトチフェンフマル酸塩を対照とした比較試験)(小児)
通年性アレルギー性鼻炎を対象とした二重盲検比較試験において、ロラタジンシロップ(3〜6歳:ロラタジンとして5mg/日、7〜15歳:ロラタジンとして10mg/日、非売品)あるいはケトチフェンフマル酸塩(3〜6歳:ケトチフェンとして1.2mg/日、7〜15歳:ケトチフェンとして2mg/日)を2週間投与した。4鼻症状スコア※1(くしゃみ発作、鼻汁、鼻閉、鼻内そう痒感)の投与前値及び投与2週後(又は中止時)の変化量を下表に示した。
| 投与群 | n | 投与前(標準誤差) | 変化量(標準誤差) | 比較※2 |
| ロラタジン | 96 | 7.08(0.19) | −2.53(0.25) | 差の点推定値 −0.39 95%CI:−1.04〜0.25 |
| ケトチフェン | 91 | 6.36(0.22) | −1.74(0.26) |
※1:各症状の程度を+++:3、++:2、+:1、−:0にスコア化して合計したスコア。
※2:投与前値及び年齢層を共変量とした共分散分析により、変化量の差(ロラタジン−ケトチフェン)とその95%両側信頼区間(95%CI)を算出した。
副作用は96例中12例(12.5%)に認められた。主な副作用は、傾眠6例(6.3%)、腹痛2例(2.1%)等であった21)。
<蕁麻疹、皮膚疾患(湿疹・皮膚炎、皮膚そう痒症)に伴うそう痒>
17.1.5 国内長期投与試験(成人)
慢性じん麻疹に対してロラタジン錠10mgを1日1回8週間投与したときの最終治療効果(有効以上)は87.4%(76/87)であった。
副作用は92例中10例(10.9%)に認められた。副作用は、眠気6例(6.5%)、倦怠感3例(3.3%)、心窩部不快感、腹部膨満感、下痢及び生理遅延が各1例(1.1%)であった22)。
副作用は92例中10例(10.9%)に認められた。副作用は、眠気6例(6.5%)、倦怠感3例(3.3%)、心窩部不快感、腹部膨満感、下痢及び生理遅延が各1例(1.1%)であった22)。
17.1.6 国内第III相比較試験(メキタジンを対照とした比較試験)(成人)
慢性じん麻疹を対象とした二重盲検比較試験において、ロラタジン錠10mg(1日1回)あるいはメキタジン3mg(1日2回)を7日間投与したときの最終全般改善率(中等度改善以上)はそれぞれ71.3%(82/115)と66.7%(78/117)であった。
副作用は119例中12例(10.1%)に認められた。副作用は、眠気8例(6.7%)、口渇2例(1.7%)、倦怠感、食欲亢進、腹部不快感及び舌のびらん・疼痛が各1例(0.8%)であった23)。
副作用は119例中12例(10.1%)に認められた。副作用は、眠気8例(6.7%)、口渇2例(1.7%)、倦怠感、食欲亢進、腹部不快感及び舌のびらん・疼痛が各1例(0.8%)であった23)。
17.1.7 国内第III相比較試験(シュードプラセボ及びケトチフェンフマル酸塩を対照とした比較試験)(成人)
慢性じん麻疹を対象とした二重盲検比較試験において、ロラタジン錠(10mg/日)、ケトチフェンフマル酸塩(ケトチフェンとして2mg/日)あるいはシュードプラセボ(ロラタジンとして1mg/日)を2週間投与したところ、投与2週後(又は中止時)の全般改善率(中等度改善以上)は、それぞれ80.5%、62.1%、43.8%であった(ロラタジンとケトチフェンの改善率の差の点推定値18.4%、95%両側信頼区間7.4%〜29.3%)。また、皮膚症状スコア※の投与前値及び投与2週後(又は中止時)の変化量を下表に示した。
| 投与群 | n | 投与前(標準誤差) | 変化量 |
| ロラタジン | 128 | 1.98(0.06) | −1.48 |
| ケトチフェン | 124 | 1.97(0.06) | −1.20 |
| シュードプラセボ | 80 | 2.08(0.07) | −0.79 |
| 投与群 | n | 投与前(標準誤差) | 変化量 |
| ロラタジン | 128 | 1.95(0.06) | −1.41 |
| ケトチフェン | 124 | 1.87(0.06) | −1.11 |
| シュードプラセボ | 80 | 1.91(0.07) | −0.82 |
※:そう痒、発斑の程度をそれぞれ+++:3、++:2、+:1、±:0.5、−:0にスコア化した。
副作用は128例中27例(21.1%)に認められた。主な副作用は、眠気17例(13.3%)、めまい・立ちくらみ・ふらつき感、口渇感及び胃痛が各2例(1.6%)等であった24)。
17.1.8 国内一般臨床試験(成人)
湿疹・皮膚炎、皮膚そう痒症に対してロラタジン錠10mgを1日1回7日間投与したときの最終治療効果(有効以上)は61.0%(161/264)であった。
副作用は284例中22例(7.7%)に認められた。副作用は、眠気15例(5.3%)、倦怠感4例(1.4%)、口渇3例(1.1%)、頭痛、肩こり、胃部不快感及び食欲不振が各1例(0.4%)であった25)。
副作用は284例中22例(7.7%)に認められた。副作用は、眠気15例(5.3%)、倦怠感4例(1.4%)、口渇3例(1.1%)、頭痛、肩こり、胃部不快感及び食欲不振が各1例(0.4%)であった25)。
17.1.9 国内第III相比較試験(ケトチフェンフマル酸塩を対照とした比較試験)(小児)
代表的なそう痒性皮膚疾患であるアトピー性皮膚炎を対象とした二重盲検比較試験において、ロラタジンドライシロップ(3〜6歳:ロラタジンとして5mg/日、7〜15歳:ロラタジンとして10mg/日)あるいはケトチフェンフマル酸塩(3〜6歳:ケトチフェンとして1.2mg/日、7〜15歳:ケトチフェンとして2mg/日)を2週間投与した。主要そう痒スコア※1の投与前値及び投与2週後(又は中止時)の変化量を下表に示した。
| 投与群 | n | 投与前(標準誤差) | 変化量(標準誤差) | 比較※2 |
| ロラタジン | 101 | 2.50(0.06) | −0.51(0.08) | 差の点推定値 0.03 95%CI:−0.18〜0.25 |
| ケトチフェン | 100 | 2.56(0.06) | −0.58(0.08) |
※1:そう痒の程度を++++:4、+++:3、++:2、+:1、−:0にスコア化し、日中は夜間の高い方を主要そう痒スコアとした。
※2:投与前値及び年齢層を共変量とした共分散分析により、変化量の差(ロラタジン−ケトチフェン)とその95%両側信頼区間(95%CI)を算出した。
副作用は101例中4例(4.0%)に認められた。副作用は、ALT増加及びAST増加が各2例(2.0%)、γ-GTP増加、肝機能検査値異常及び傾眠が各1例(1.0%)であった26)。
17.3 その他
17.3.1 眠気及び運転・機械操作能力に対する影響
ロラタジン服用後の諸動作はプラセボ服用時と類似し、ロラタジンの運転・機械操作能力に対する影響は認められなかった。
(1)健康成人男女(20例)を対象にパソコンでの数字入力作業による精神運動機能に及ぼす影響を検討したとき、ロラタジン10mg及び20mg注)投与時の正入力数はプラセボ投与時と有意差がなく、精神運動機能に影響を与えなかった27)。
(2)通年性アレルギー性鼻炎に対する二重盲検比較試験の結果、ロラタジン10mg(103例)の眠気の発現頻度は、プラセボ(70例)と同程度であった20)。
(3)健康成人男女(16例)を対象に入眠までの時間を比較したとき、ロラタジン10mg投与時の平均入眠時間はプラセボ投与時と有意差がなかった28)(外国人データ)。
(4)健康成人男性(20例)を対象にサーキット上での自動車運転能力に及ぼす影響を検討したとき、ロラタジン10mg及び20mg注)投与時の運転能力はプラセボ投与時と有意差がなく、運転能力に影響を与えなかった29)(外国人データ)。
(5)空軍パイロット及び民間航空会社パイロット(40例)を対象にフライトシミュレーション試験を実施した結果、ロラタジン10mgは、プラセボと比較してパイロットの航空機操作能力に影響を与えなかった30)(外国人データ)。
17.3.2 心血管系に及ぼす影響
健康成人男性(50例)にロラタジン40mg注)を1日1回13週間投与したとき、プラセボ(20例)と比較してQTc間隔を含む心電図及び心拍数への影響は認められなかった31)(外国人データ)。
注)本剤の成人における承認用量は、「通常、ロラタジンとして1回10mgを1日1回、食後に経口投与する。」である。
18. 薬効薬理
18.1 作用機序
ロラタジン及びDCLは、ヒスタミンH1受容体拮抗作用を示す。また、ヒスタミン、ロイコトリエンC4の遊離抑制作用を示す32)。
18.2 ヒスタミンH1受容体拮抗作用
18.3 ヒスタミン及びロイコトリエンC4遊離抑制作用
18.4 抗原誘発反応に対する作用
18.5 作用の持続性
19. 有効成分に関する理化学的知見
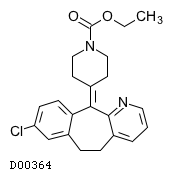
19.1. ロラタジン
22. 包装
<ロラタジン錠10mg「フェルゼン」>
100錠[10錠(PTP)×10]
<ロラタジンOD錠10mg「フェルゼン」>
100錠[10錠(PTP)×10]
23. 主要文献
- 第I相臨床試験(単回投与)(クラリチン錠:2002年7月5日承認、申請資料概要ヘ.4.2.1)
- 第I相臨床試験(反復投与)(クラリチン錠:2002年7月5日承認、申請資料概要ヘ.4.2.2)
- 社内資料:生物学的同等試験
- 食事の影響(クラリチン錠:2002年7月5日承認、申請資料概要ヘ.4.3)
- 血漿タンパク結合(クラリチン錠:2002年7月5日承認、申請資料概要ヘ.3.2.4)
- ラットの組織中濃度(クラリチン錠:2002年7月5日承認、申請資料概要ヘ.3.2.1)
- ヒトにおける薬物動態試験(代謝、排泄)(クラリチン錠:2002年7月5日承認、申請資料概要ヘ.3.3.1、ヘ.4.1)
- Yumibe N,et al., Biochem Pharmacol., 51, 165-172, (1996) »PubMed
- Hilbert J,et al., J Clin Pharmacol., 28, 234-239, (1988) »PubMed
- 腎機能障害患者における薬物動態(クラリチン錠:2002年7月5日承認、申請資料概要ヘ.4.6)
- 肝機能障害患者における薬物動態(クラリチン錠:2002年7月5日承認、申請資料概要ヘ.4.5)
- 小児における薬物動態(クラリチン錠/レディタブ錠/ドライシロップ:2007年10月19日承認、申請資料概要2.7.6.4)
- 小児及び成人患者における国内製造販売後臨床薬理試験(クラリチン錠/レディタブ錠/ドライシロップ:2015年9月17日承認、再審査報告書)
- 高齢者における薬物動態(クラリチン錠:2002年7月5日承認、申請資料概要ヘ.4.4)
- Brannan MD,et al., Clin Pharmacol Ther., 58, 269-278, (1995) »PubMed
- Kosoglou T,et al., Br J Clin Pharmacol., 50, 581-589, (2000) »PubMed
- ロラタジン及びその代謝物の作用(クラリチン錠:2002年7月5日承認、申請資料概要ホ.1.5.3)
- 奥田稔他, 耳展, 35 (補1), 13-26, (1992)
- 奥田稔他, 耳展, 35 (補4), 327-345, (1992)
- プラセボ及びケトチフェンフマル酸塩を対照とした比較試験(クラリチン錠:2002年7月5日承認、申請資料概要ト.1.1.3.3)
- 石川哮他, 臨床医薬, 23, 965-990, (2007)
- 久木田淳他, 臨床医薬, 6, 2457-2468, (1990)
- 久木田淳他, 臨床医薬, 6, 2689-2705, (1990)
- シュードプラセボ及びケトチフェンフマル酸塩を対照とした比較試験(クラリチン錠:2002年7月5日承認、申請資料概要ト.1.1.2.3)
- 久木田淳他, 臨床医薬, 6, 2443-2456, (1990)
- 川島眞他, 臨床医薬, 23, 991-1016, (2007)
- Nakano S,et al., 臨床薬理, 38, 401-407, (2007) »DOI
- Roth T,et al., J Allergy Clin Immunol., 80, 94-98, (1987) »PubMed
- 運転操作に対する影響(クラリチン錠:2002年7月5日承認、申請資料概要ト.1.2.3)
- Neves-Pinto RM,et al., American J Rhinology., 6, 23-27, (1992)
- 心電図に及ぼす影響の検討(クラリチン錠:2002年7月5日承認、申請資料概要ト.1.2.4)
- 効力を裏付ける試験(クラリチン錠:2002年7月5日承認、申請資料概要ホ.1)
- モルモットのH1受容体親和性(クラリチン錠:2002年7月5日承認、申請資料概要ホ.1.4.1)
- モルモットのヒスタミン誘発収縮に対する作用(クラリチン錠:2002年7月5日承認、申請資料概要ホ.1.4.1)
- Anthes JC,et al., Eur J Pharmacol., 449, 229-237, (2002) »PubMed
- ラットのヒスタミン誘発皮膚血管透過性亢進に対する作用(クラリチン錠:2002年7月5日承認、申請資料概要ホ.1.2.1)
- Barnett A,et al., Agents Actions., 14, 590-597, (1984) »PubMed
- Kreutner W,et al., Allergy., 42, 57-63, (1987) »PubMed
- 亀井千晃他, 薬理と治療, 24, 49-52, (1996)
- アレルギー性皮膚炎モデルにおける作用(クラリチン錠:2002年7月5日承認、申請資料概要ホ.1.1.1)
- アレルギー性鼻炎モデルにおける作用(クラリチン錠:2002年7月5日承認、申請資料概要ホ.1.1.2)
- 中島光好他, 臨床医薬, 6, 1537-1549, (1990)
24. 文献請求先及び問い合わせ先
文献請求先
株式会社フェルゼンファーマ
安全管理部
〒105-0001
東京都港区虎ノ門1丁目1番18号
電話:03-6368-5160
FAX:03-3580-1522
製品情報問い合わせ先
株式会社フェルゼンファーマ
安全管理部
〒105-0001
東京都港区虎ノ門1丁目1番18号
電話:03-6368-5160
FAX:03-3580-1522
26. 製造販売業者等
26.1 製造販売元
株式会社フェルゼンファーマ
札幌市中央区北10条西24丁目3番地