医薬品情報
| 総称名 | ビルダグリプチン |
|---|---|
| 一般名 | ビルダグリプチン |
| 欧文一般名 | Vildagliptin |
| 製剤名 | ビルダグリプチン錠 |
| 薬効分類名 | 選択的DPP-4阻害薬 2型糖尿病治療薬 |
| 薬効分類番号 | 3969 |
| ATCコード | A10BH02 |
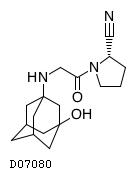
| KEGG DRUG |
D07080
ビルダグリプチン
|
| KEGG DGROUP |
DG01601
DPP-4阻害薬
DG02044
血糖降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第4版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ビルダグリプチン錠50mg「フェルゼン」 (後発品) | Vildagliptin Tablets「FELDSENF」 | ダイト | 3969011F1110 | 18.4円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 糖尿病性ケトアシドーシス、糖尿病性昏睡、1型糖尿病の患者[インスリンの適用である。]
2.3 重度の肝機能障害のある患者[9.3.1参照]
2.4 重症感染症、手術前後、重篤な外傷のある患者[インスリンの適用である。]
4. 効能または効果
5. 効能または効果に関連する注意
本剤の適用はあらかじめ糖尿病治療の基本である食事療法、運動療法を十分に行った上で効果が不十分な場合に限り考慮すること。
6. 用法及び用量
通常、成人には、ビルダグリプチンとして50mgを1日2回朝、夕に経口投与する。なお、患者の状態に応じて50mgを1日1回朝に投与することができる。
7. 用法及び用量に関連する注意
8. 重要な基本的注意
8.2 肝機能障害(肝炎を含む)があらわれることがあるので、本剤投与開始前、投与開始後1年間は少なくとも3ヵ月毎に、その後も定期的に肝機能検査を行うこと。[11.1.1参照]
8.3 急性膵炎があらわれることがあるので、持続的な激しい腹痛、嘔吐等の初期症状があらわれた場合には、速やかに医師の診察を受けるよう患者に指導すること。[11.1.5参照]
8.4 本剤投与中は、血糖、尿糖を定期的に検査し、薬剤の効果を確かめ、本剤を3ヵ月投与しても効果が不十分な場合には他の治療法への変更を考慮すること。
8.5 低血糖及び低血糖症状を起こすおそれがあるので、高所作業、自動車の運転等に従事している患者に投与するときには注意すること。[11.1.3参照]
8.6 本剤とGLP-1受容体作動薬はいずれもGLP-1受容体を介した血糖降下作用を有している。両剤を併用した際の臨床試験成績はなく、有効性及び安全性は確認されていない。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心不全(NYHA分類III〜IV)のある患者
使用経験がなく安全性が確立していない。
9.1.2 低血糖を起こすおそれのある以下の患者又は状態
9.1.3 腹部手術の既往又はイレウスの既往のある患者
腸閉塞を含むイレウスを起こすおそれがある。[11.1.6参照]
9.2 腎機能障害患者
9.2.1 中等度以上の腎機能障害のある患者又は透析中の末期腎不全患者
用法及び用量の調節を行うこと。[7.、16.6.1参照]
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者
投与しないこと。肝機能障害が悪化するおそれがある。[2.3参照]
9.3.2 肝機能障害のある患者(重度の肝機能障害のある患者を除く)
肝機能障害が悪化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。動物実験(ラット及びウサギ)で、胎児への移行が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で、乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
副作用発現に留意し、経過を十分に観察しながら慎重に投与すること。一般に生理機能が低下している。
10. 相互作用
相互作用序文
本剤は主に代謝により消失し、未変化体の尿中排泄率は23%であった。[16.5.1参照]
10.2 併用注意
| 血糖降下作用を増強する薬剤 糖尿病用剤 スルホニルアミド系及びスルホニルウレア系薬剤 ビグアナイド系薬剤 インスリン製剤 チアゾリジン系薬剤 α-グルコシダーゼ阻害剤 速効型インスリン分泌促進剤 GLP-1受容体作動薬 SGLT2阻害剤 イメグリミン等 β-遮断剤 サリチル酸剤 MAO阻害剤 フィブラート系薬剤等 [11.1.3参照] | 低血糖症状が起こるおそれがある。血糖値、その他患者の状態を十分に観察しながら投与すること。特に、スルホニルウレア剤又はインスリン製剤と併用する場合、低血糖のリスクが増加するため、これらの薬剤の減量を検討すること。 | 血糖降下作用の増強による。 |
| 血糖降下作用を減弱する薬剤 アドレナリン 副腎皮質ホルモン 甲状腺ホルモン等 | 血糖値が上昇してコントロール不良になるおそれがある。血糖値、その他患者の状態を十分に観察しながら投与すること。 | 血糖降下作用の減弱による。 |
| アンジオテンシン変換酵素阻害剤 [11.1.2参照] | アンジオテンシン変換酵素阻害剤を併用している患者では、併用していない患者に比べて血管性浮腫の発現頻度が高かったとの報告がある。 | 機序は不明である。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝炎、肝機能障害(いずれも頻度不明)
ALT又はASTの上昇等を伴う肝炎又は肝機能障害があらわれることがある。ALT又はAST等の肝機能検査値の異常を認めた場合には、本剤の投与を中止するなど適切な処置を行うこと。黄疸や肝機能障害を示唆するその他の症状があらわれた場合には、本剤の投与を中止し、その後回復した場合でも再投与しないこと。[8.2参照]
11.1.2 血管性浮腫(頻度不明)
アンジオテンシン変換酵素阻害剤を併用している患者では、併用していない患者に比べて血管性浮腫の発現頻度が高かったとの報告がある。[10.2参照]
11.1.3 低血糖(頻度不明)
11.1.4 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇を特徴とする横紋筋融解症があらわれることがある。
11.1.5 急性膵炎(頻度不明)
持続的な激しい腹痛、嘔吐等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[8.3参照]
11.1.6 イレウス(頻度不明)
腸閉塞を含むイレウスを起こすおそれがある。高度の便秘、腹部膨満、持続する腹痛、嘔吐等の異常が認められた場合には投与を中止し、適切な処置を行うこと。[9.1.3参照]
11.1.7 間質性肺炎(頻度不明)
咳嗽、呼吸困難、発熱、肺音の異常(捻髪音)等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施すること。間質性肺炎が疑われた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.8 類天疱瘡(頻度不明)
水疱、びらん等があらわれた場合には、皮膚科医と相談し、投与を中止するなど適切な処置を行うこと。
11.2 その他の副作用
| 1〜5%未満 | 1%未満 | 頻度不明 | |
| 血液及びリンパ系障害 | − | 血小板数減少 | − |
| 神経系障害 | めまい、振戦 | 頭痛 | − |
| 心臓障害 | 動悸 | − | − |
| 血管障害 | − | 高血圧 | − |
| 胃腸障害 | 便秘、腹部膨満、血中アミラーゼ増加、リパーゼ増加 | 鼓腸、上腹部痛、腹部不快感、胃炎、悪心、下痢、消化不良、胃食道逆流性疾患 | − |
| 肝胆道系障害 | − | ALT増加、AST増加、γ-GTP増加、ALP増加 | 胆嚢炎 |
| 筋骨格系障害 | − | 関節痛 | − |
| 皮膚障害 | 多汗症 | 湿疹、発疹、そう痒症、蕁麻疹 | 皮膚剥脱、水疱、皮膚血管炎 |
| その他 | 空腹、無力症、血中CK増加、血中CK-MB増加 | CRP増加、末梢性浮腫、体重増加、悪寒 | − |
13. 過量投与
13.1 処置
本剤は血液透析により除去されない。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
15.2.1 マウスを用いた104週間反復経口投与がん原性試験において、1,000mg/kg/日(50mg1日2回用量でのヒト曝露量(AUC)の199倍)群の雌で乳腺腺癌の発生例数が増加し、1,000mg/kg/日群の雌及び250mg/kg/日以上群の雄で血管肉腫の発生例数が増加した。
15.2.2 カニクイザルの13週間経口投与毒性試験において、50mg1日2回用量でのヒト曝露量(AUC)に相当する5mg/kg/日以上の用量で、四肢、耳及び尾部等の皮膚病変(5mg/kg/日で投与期間中に消失した一過性の水疱、20mg/kg/日以上で落屑、痂皮等、80mg/kg/日以上で壊死等)が報告されている。
また、カニクイザルの他の経口投与毒性試験において、20mg/kg/日以上の用量で、個体により初回投与後に急性毒性徴候として、骨格筋壊死、血液生化学的パラメータ(LDH、CK、ALT及びAST)の上昇、体温低下、血圧低下又は頻脈を伴う体の先端部分の浮腫が報告されている。40mg/kg/日以上の用量で、一部の個体で瀕死もしくは死亡が認められた一方で、生存例では症状は一過性で投与期間中に回復した。
なお、同様の毒性所見は他の動物種(マウス、ラット、イヌ及びウサギ)及びヒトでは報告されていない。
また、カニクイザルの他の経口投与毒性試験において、20mg/kg/日以上の用量で、個体により初回投与後に急性毒性徴候として、骨格筋壊死、血液生化学的パラメータ(LDH、CK、ALT及びAST)の上昇、体温低下、血圧低下又は頻脈を伴う体の先端部分の浮腫が報告されている。40mg/kg/日以上の用量で、一部の個体で瀕死もしくは死亡が認められた一方で、生存例では症状は一過性で投与期間中に回復した。
なお、同様の毒性所見は他の動物種(マウス、ラット、イヌ及びウサギ)及びヒトでは報告されていない。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子にビルダグリプチン25、50、100、200及び400mgを単回経口投与したとき、ビルダグリプチンは速やかに吸収され、血漿中の未変化体は投与後1.33〜2.75時間で最高血漿中濃度に到達した。また、Cmax及びAUCは投与量の増加に比例して増大し、消失半減期は200mgまで約2時間であった1)。(本剤の用法及び用量は50mgを1日2回又は1回である。)
| Cmax(ng/mL) | Tmax(hr) | AUC0-t(ng・hr/mL) | T1/2(hr) |
| 272±77 | 2.00±1.26 | 1,139±80 | 1.77±0.23 |
16.1.2 反復投与
2型糖尿病患者(16例)にビルダグリプチン50mgを1日2回7日間反復経口投与したときの、投与1日目及び7日目の薬物動態パラメータを以下に示す。
血漿中トラフ濃度より算出した累積率はおよそ1であり、ビルダグリプチン50mgを1日2回7日間反復投与したとき血漿中への累積は認められなかった2)3)。
血漿中トラフ濃度より算出した累積率はおよそ1であり、ビルダグリプチン50mgを1日2回7日間反復投与したとき血漿中への累積は認められなかった2)3)。
| 投与日 | Cmax(ng/mL) | Tmax(hr) | AUC0-12hr(ng・hr/mL) | T1/2(hr) | Rac |
| 1 | 524±186 | ※1.0(0.5、2.0) | 1,480±312 | 1.78±0.31 | − |
| 7 | 415±105 | ※1.0(0.5、2.0) | 1,490±344 | 2.41±0.77 | 1.01±0.11 |
16.1.3 生物学的同等性試験
ビルダグリプチン錠50mg「フェルゼン」とエクア錠50mgを、クロスオーバー法によりそれぞれ1錠(ビルダグリプチンとして50mg)健康成人男性に絶食時単回経口投与して血漿中未変化体濃度を測定し、得られた薬物動態パラメータ(AUC、Cmax)について90%信頼区間法にて統計解析を行った結果、log(0.80)〜log(1.25)の範囲内であり、両製剤の生物学的同等性が確認された4)。
| 判定パラメータ | 参考パラメータ | |||
| AUC0-12(ng・hr/mL) | Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | |
| ビルダグリプチン錠50mg「フェルゼン」 | 1121.805±222.134 | 269.602±84.643 | 1.6±0.8 | 1.8±0.3 |
| エクア錠50mg | 1111.369±206.175 | 291.075±76.421 | 1.7±0.8 | 1.8±0.2 |
血漿中濃度並びにAUC、Cmax等のパラメータは、被験者の選択、体液の採取回数・時間等の試験条件によって異なる可能性がある。
16.2 吸収
16.2.1 食事の影響
健康成人(24例)にビルダグリプチン100mgを食後に単回経口投与したとき、Cmaxは空腹時投与に比べ19%低下した。Tmaxは、ビルダグリプチン投与前に食事を摂取することにより1.75時間から2.5時間に延長された5)(外国人のデータ)。(本剤の用法及び用量は50mgを1日2回又は1回である。)
| 投与日 | Cmax(ng/mL) | Tmax(hr) | AUC0-t(ng・hr/mL) |
| 空腹時 | 538±149 | ※1.75(0.75、4.0) | 2,500±564 |
| 食後 | 431±95 | ※2.5(0.5、6.0) | 2,215±403 |
16.2.2 生物学的利用率
健康成人(12例)にビルダグリプチン50mgを経口投与したときのバイオアベイラビリティは約85%であった6)(外国人のデータ)。
16.3 分布
ビルダグリプチンのin vitro血漿蛋白結合率は9.3%であった7)。
16.4 代謝
16.4.1 ビルダグリプチンはCYP2A6、2B6、2C8、2C9、2C19、2E1、2J2、3A4では代謝されなかった。また、CYP1A2、2B6、2C8、2C9、2C19、2D6、2E1、3A4/5を阻害せず、CYP1A2、2C8、2B6、2C9、2C19、3Aを誘導しなかった8)9)10)(in vitro)。
16.4.2 健康成人男子(4例)に14C標識したビルダグリプチン100mgを単回経口投与したとき、血漿中には主として未変化体(血漿中全活性の25.7%)及びシアノ基が加水分解された不活性代謝物(M20.7、55.5%)が存在し、その他グルクロン酸抱合体(9.5%)及びアミド結合の加水分解代謝物(8.1%)が認められた。尿及び糞中の主な代謝物は、M20.7(56.5%)であり、その他にグルクロン酸抱合体(4.4%)、アミド結合の加水分解代謝物(3.7%)が認められた。グルクロン酸抱合体はビルダグリプチンと同等のジペプチジルペプチダーゼ-4(DPP-4)阻害活性を示すが、M20.7の阻害活性は極めて弱く、アミド結合加水分解代謝物は阻害活性を示さなかった11)12)13)14)15)(外国人のデータ)。(本剤の用法及び用量は50mgを1日2回又は1回である。)
16.5 排泄
16.5.1 健康成人男子(6例)にビルダグリプチン50mgを単回経口投与した場合、投与後36時間までに未変化体として22.7%が尿中に排泄され、腎クリアランスは9.83L/hr(164mL/min)であった。ビルダグリプチンの尿中への排泄は、能動的な尿細管分泌の関与が示唆される1)16)。[10.参照]
16.5.2 健康成人男子(4例)に14C標識したビルダグリプチン100mgを単回経口投与したとき、168時間以内に投与した放射能の85%が尿中に、15%が糞中に排泄された。尿及び糞中に排泄された未変化体の割合はそれぞれ投与量の23%及び5%であった11)(外国人のデータ)。(本剤の用法及び用量は50mgを1日2回又は1回である。)
16.5.3 ビルダグリプチンは基底膜側の有機アニオントランスポーター、有機カチオントランスポーター等によって輸送されない。また、P糖蛋白の輸送基質であることが示されている(みかけのKm値が0.5mM以上)17)(in vitro)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
軽度から重度の腎機能障害患者(24例)にビルダグリプチン100mgを単回経口投与したとき、ビルダグリプチンのAUC0-tは健康被験者に比べて軽度、中等度、重度の腎機能障害患者及び血液透析が必要な患者でそれぞれ2.01倍、1.31倍、2.33倍、1.42倍高く、Cmaxはそれぞれ1.66倍、1.08倍、1.56倍、1.24倍高かった。M20.7のAUC0-24hrは、軽度、中等度、重度の腎機能障害患者及び血液透析が必要な患者で健康被験者よりそれぞれ1.7倍、2.6倍、6.1倍、6.7倍高く、Cmaxはそれぞれ1.6倍、2.4倍、5.4倍、8.1倍高かった。透析によってビルダグリプチンは投与量の約3%が除去された。M20.7は透析によって血漿中濃度が透析前の50%以下に低下した18)。
軽度から重度の腎機能障害患者(48例)にビルダグリプチン50mgを1日1回14日間経口投与したとき、ビルダグリプチンのAUC0-24hrは健康被験者に比べて軽度、中等度、及び重度の腎機能障害患者でそれぞれ1.40倍、1.71倍、2.00倍高く、Cmaxはそれぞれ1.37倍、1.32倍、1.36倍高かった。M20.7のAUC0-24hrは、軽度、中等度、及び重度の腎機能障害患者で健康被験者よりそれぞれ1.66倍、3.20倍、7.30倍高く、Cmaxはそれぞれ1.57倍、2.56倍、5.55倍高かった。グルクロン酸抱合体のAUC0-24hrは、軽度、中等度、及び重度の腎機能障害患者で健康被験者よりそれぞれ1.35倍、2.69倍、7.25倍高く、Cmaxはそれぞれ1.13倍、1.60倍、3.00倍高かった19)(外国人のデータ)。(本剤の用法及び用量は50mgを1日2回又は1回である。)[7.、9.2.1参照]
軽度から重度の腎機能障害患者(48例)にビルダグリプチン50mgを1日1回14日間経口投与したとき、ビルダグリプチンのAUC0-24hrは健康被験者に比べて軽度、中等度、及び重度の腎機能障害患者でそれぞれ1.40倍、1.71倍、2.00倍高く、Cmaxはそれぞれ1.37倍、1.32倍、1.36倍高かった。M20.7のAUC0-24hrは、軽度、中等度、及び重度の腎機能障害患者で健康被験者よりそれぞれ1.66倍、3.20倍、7.30倍高く、Cmaxはそれぞれ1.57倍、2.56倍、5.55倍高かった。グルクロン酸抱合体のAUC0-24hrは、軽度、中等度、及び重度の腎機能障害患者で健康被験者よりそれぞれ1.35倍、2.69倍、7.25倍高く、Cmaxはそれぞれ1.13倍、1.60倍、3.00倍高かった19)(外国人のデータ)。(本剤の用法及び用量は50mgを1日2回又は1回である。)[7.、9.2.1参照]
| 投与群 (腎機能障害の程度) | Cmax(ng/mL) | Tmax(hr) | AUC0-t(ng・hr/mL) | T1/2(hr) | CLR(L/hr) |
| 健康被験者 n=24 | 477±114 | ※1.00(0.50、2.00) | 1,872±461 | 3.95±1.82 | 12.36±3.36 |
| 軽度 n=6 | 792±229 | ※1.50(1.50、2.00) | 3,764±967 | 2.83±0.76 | 6.06±2.71 |
| 中等度 n=6 | 514±279 | ※1.25(0.50、2.00) | 2,451±1,343 | 3.89±1.64 | 5.98±4.21 |
| 重度 n=6 | 745±235 | ※1.00(0.50、4.00) | 4,363±2,069 | 3.55±0.35 | 1.44±0.75 |
| 血液透析の必要な患者 n=6 | 591±166 | ※1.50(1.50、3.00) | 2,656±532 | 8.05±6.26 | − |
16.6.2 肝機能障害患者
軽度から重度の肝機能障害患者(16例)にビルダグリプチン100mgを単回経口投与したとき、軽度及び中等度の肝機能障害患者におけるビルダグリプチンのAUC0-tは、それぞれ20%及び8%低下したが、重度の肝機能障害患者では22%上昇した。軽度、中等度の肝機能障害患者のCmaxは健康被験者と比べて約25%低かったが、重度の肝機能障害患者では健康被験者と同程度であった。軽度、中等度、重度の肝機能障害患者のM20.7のAUC0-tは、健康被験者と比べてそれぞれ27%、49%、92%高く、同様にCmaxはそれぞれ23%、46%、65%高かった20)21)(外国人のデータ)。(本剤の用法及び用量は50mgを1日2回又は1回である。)
| 投与群 (肝機能障害の程度) | Cmax(ng/mL) | Tmax(hr) | AUC0-t(ng・hr/mL) | T1/2(hr) |
| 健康被験者 n=6 | 675±263 | ※1.25(1.00、3.00) | 2,567±428 | 2.01±0.50 |
| 軽度 n=6 | 497±229 | ※1.25(1.00、2.00) | 2,076±514 | 4.92±4.86 |
| 中等度 n=6 | 512±166 | ※1.00(0.50、3.00) | 2,411±740 | 3.08±1.59 |
| 重度 n=4 | 632±247 | ※2.04(1.00、4.00) | 3,322±1,472 | 2.40±0.25 |
16.6.3 高齢者
70歳以上の高齢者(20例)にビルダグリプチン100mgを単回経口投与したときのAUC及びCmaxは、非高齢者(18〜40歳)に比較してそれぞれ1.32倍及び1.18倍高かった22)(外国人のデータ)。(本剤の用法及び用量は50mgを1日2回又は1回である。)
16.7 薬物相互作用
日本人2型糖尿病患者(24例)を対象にビルダグリプチン50mgを1日2回及びボグリボース0.2mgを1日3回3日間併用投与したとき、投与3日目のビルダグリプチンのCmax及びAUC0-12hrは単独投与時と比べそれぞれ34%及び23%低下したが、DPP-4阻害への影響は認められなかったことから、ボグリボースとの併用時にビルダグリプチンの用量調節は必要ないと考えられた23)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験
食事療法、運動療法のみで血糖コントロールが十分に得られていない2型糖尿病患者(291例)を対象に、ビルダグリプチン10、25、50mg又はプラセボを1日2回12週間経口投与し、プラセボ対照、二重盲検、比較試験を実施した。主要評価項目をHbA1c(JDS)値の投与前からの変化量として実施した。低血糖症の発現割合はビルダグリプチン10、25、50mg及びプラセボが、それぞれ4.2%(71例中3例)、0%(72例中0例)、2.6%(76例中2例)及び1.4%(72例中1例)であった30)31)。(本剤の用法及び用量は50mgを1日2回又は1回である。)
| HbA1c(JDS)(%) | ||
| 投与前からの変化量 | プラセボとの差 | |
| プラセボ | 0.28 | − |
| ビルダグリプチン 10mg 1日2回 | −0.53 | −0.82# |
| ビルダグリプチン 25mg 1日2回 | −0.67 | −0.95# |
| ビルダグリプチン 50mg 1日2回 | −0.92 | −1.20# |
17.1.2 国内第III相試験
食事療法、運動療法のみで血糖コントロールが十分に得られていない2型糖尿病患者(239例)を対象に、ビルダグリプチン50mg1日1回、50mg1日2回、100mg1日1回又はプラセボを12週間経口投与し、プラセボ対照、二重盲検、比較試験を実施した。主要評価項目をHbA1c(JDS)値の投与前からの変化量として実施した。投与12週のHbA1c(JDS)値の変化量(50mg1日1回、50mg1日2回、100mg1日1回、プラセボ)は、それぞれ−0.78%、−0.86%、−0.86%、0.13%であり、ビルダグリプチンはプラセボに対し、いずれも有意な低下を示し(p<0.001、有意水準5%(Hochbergのステップアップ法))、血糖コントロールを改善させた。また、低血糖症はいずれの投与群でも認められなかった32)。(本剤の用法及び用量は50mgを1日2回又は1回である。)
17.1.3 国内第III相試験
食事療法、運動療法のみで血糖コントロールが十分に得られていない2型糖尿病患者(380例)を対象に、ビルダグリプチン50mg1日2回又はボグリボース0.2mg1日3回を12週間経口投与し、実薬対照、二重盲検、比較試験を実施した。主要評価項目をHbA1c(JDS)値の投与前からの変化量として実施した。低血糖症の発現割合はビルダグリプチンが0%(188例中0例)、ボグリボースが0.5%(192例中1例)であった33)34)。
| HbA1c(JDS)(%) | 空腹時血糖(mg/dL) | 食後血糖2時間値(mg/dL) | ||||
| 投与前からの変化量 | ボグリボースとの差 | 投与前からの変化量 | ボグリボースとの差 | 投与前からの変化量 | ボグリボースとの差 | |
| ボグリボース | −0.38 | − | −7.81 | − | −19.79 | − |
| ビルダグリプチン | −0.95 | −0.57※ | −24.06 | −16.25※ | −51.50 | −31.71※ |
17.1.4 国内第III相試験
食事療法、運動療法に加えスルホニルウレア剤単独で血糖コントロールが十分に得られていない2型糖尿病患者(202例)を対象に、ビルダグリプチン50mg1日2回又はプラセボをスルホニルウレア剤に加え12週間経口投与し、プラセボ対照、二重盲検、比較試験を実施した。主要評価項目をHbA1c(JDS)値の投与前からの変化量として実施した。投与12週のHbA1c(JDS)値の変化量はビルダグリプチンが−1.00%、プラセボが−0.06%であり、ビルダグリプチンはプラセボに対し、有意(p<0.001)な低下を示し、血糖コントロールを改善させた。また、低血糖症の発現割合はビルダグリプチンが2.0%(102例中2例)、プラセボが1.0%(100例中1例)であった35)36)。
17.1.5 国内第III相試験
食事療法、運動療法のみで血糖コントロールが十分に得られていない2型糖尿病患者(103例)、もしくは、食事療法、運動療法に加えスルホニルウレア剤単独で血糖コントロールが十分に得られていない2型糖尿病患者(53例)を対象に、ビルダグリプチン50mg1日2回もしくはスルホニルウレア剤に加えビルダグリプチン50mg1日2回を52週間経口投与し、長期投与試験を実施した。主要評価項目は長期投与時の安全性を確認することとした。いずれも投与開始初期から血糖コントロールを改善し、52週にわたって安定した血糖コントロールが得られた。最終評価時のHbA1c(JDS)値の変化量はそれぞれ−0.80%、−0.64%であった。また、低血糖症の発現割合はビルダグリプチン単剤投与が0%(103例中0例)、スルホニルウレア剤との併用療法が3.8%(53例中2例)であった37)。
17.1.6 国内第III相試験
食事療法、運動療法に加えメトホルミン、チアゾリジン剤、α-グルコシダーゼ阻害剤又は速効型インスリン分泌促進剤(グリニド)単独で血糖コントロールが十分に得られていない2型糖尿病患者(58例、62例、62例、63例)を対象に、各薬剤に加えビルダグリプチン50mg1日2回を52週間経口投与し、長期投与試験を実施した。主要評価項目は長期併用投与時の安全性を確認することとした。いずれも投与開始初期から血糖コントロールを改善し、52週にわたって安定した血糖コントロールが得られた。最終評価時のHbA1c(JDS)値の変化量はメトホルミンとの併用では−0.75%、チアゾリジン剤との併用では−0.92%、α-グルコシダーゼ阻害剤との併用では−0.94%、グリニドとの併用では−0.64%であった。また、低血糖症の発現割合はメトホルミンとの併用では1.7%(58例中1例)であった。チアゾリジン剤、α-グルコシダーゼ阻害剤、グリニドとの併用では低血糖症は認められなかった38)。
[11.1.3参照]
17.2 製造販売後調査等
17.2.1 国内製造販売後臨床試験
食事療法、運動療法に加えインスリン製剤単独又はインスリン製剤に加えメトホルミン併用で血糖コントロールが十分に得られていない2型糖尿病患者(156例)を対象に、ビルダグリプチン50mg1日2回又はプラセボをインスリン製剤併用下で12週間経口投与し、プラセボ対照、二重盲検、比較試験を実施した。主要評価項目はHbA1c(NGSP)値の投与前からの変化量とした。投与12週のHbA1c(NGSP)値の変化量はビルダグリプチンが−1.01%、プラセボが−0.11%であり、ビルダグリプチンはプラセボに対し、有意(p<0.001)な低下を示し、血糖コントロールを改善させた。また、低血糖症の発現割合はビルダグリプチンが6.4%(78例中5例)、プラセボが1.3%(78例中1例)であった39)。
18. 薬効薬理
18.1 作用機序
18.2 DPP-4阻害作用
18.3 血漿GLP-1に対する作用
2型糖尿病患者にビルダグリプチン50mgを1日2回7日間反復経口投与すると、血漿GLP-1濃度が上昇した2)。
18.4 インスリン抵抗性に対する作用
18.5 血糖降下作用及び耐糖能改善作用
19. 有効成分に関する理化学的知見
19.1. ビルダグリプチン
22. 包装
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
23. 主要文献
- 健康成人を対象とした単回投与試験(エクア錠:2010年1月20日承認、申請資料概要2.7.6-2.1.1)
- He Y.-L,et al., Int.J.Clin.Pharmacol.Ther., 48 (9), 582-595, (2010) »PubMed
- 2型糖尿病患者を対象とした反復投与試験(エクア錠:2010年1月20日承認、申請資料概要2.7.6-3.2.2)
- 社内資料:生物学的同等性試験 (ビルダグリプチン錠50mg「フェルゼン」)
- 健康成人を対象とした食事による薬物動態への影響(エクア錠:2010年1月20日承認、申請資料概要2.7.6-1.1.2)
- He Y.-L,et al., Clin.Pharmacokinet., 46 (9), 787-802, (2007) »PubMed
- 蛋白結合に関する検討(in vitro)(エクア錠:2010年1月20日承認、申請資料概要2.6.4-4.2)
- CYP代謝に関する検討(in vitro)(エクア錠:2010年1月20日承認、申請資料概要2.6.4-7.2.2、2.6.5.10)
- CYP阻害に関する検討(in vitro)(エクア錠:2010年1月20日承認、申請資料概要2.6.4-7.2.1)
- CYP誘導に関する検討(in vitro)(エクア錠:2010年1月20日承認、申請資料概要2.6.4-7.2.3)
- He H,et al., Drug Metab.Dispos., 37 (3), 536-544, (2009) »PubMed
- 健康成人を対象とした単回投与試験(エクア錠:2010年1月20日承認、申請資料概要2.7.6-2.1.6)
- 代謝(エクア錠:2010年1月20日承認、審査報告書)
- ヒトでの主要代謝物のin vitroにおける活性(エクア錠:2010年1月20日承認、申請資料概要2.6.2-3.1.2)
- in vivo代謝(エクア錠:2010年1月20日承認、申請資料概要2.6.4-5.1)
- in vivoトランスポーターに関する検討(エクア錠:2010年1月20日承認、申請資料概要2.6.4-7.1.2)
- in vitroトランスポーターに関する検討(エクア錠:2010年1月20日承認、申請資料概要2.6.4-7.1.1)
- 腎機能障害患者における薬物動態の検討(エクア錠:2010年1月20日承認、申請資料概要2.7.6-2.3.3)
- He Y.-L,et al., Int.J.Clin.Pharmacol.Ther., 51 (9), 693-703, (2013) »PubMed
- He Y.-L,et al., Eur.J.Clin.Pharmacol., 63 (7), 677-686, (2007) »PubMed
- 肝機能障害患者(エクア錠:2010年1月20日承認、申請資料概要2.7.6-2.3.2)
- He Y.-L,et al., Br.J.Clin.Pharmacol., 65 (3), 338-346, (2008) »PubMed
- Yamaguchi M,et al., Int.J.Clin.Pharmacol.Ther., 51 (8), 641-651, (2013) »PubMed
- He Y.-L,et al., J.Clin.Pharmacol., 48 (1), 85-95, (2008) »PubMed
- Ayalasomayajula SP,et al., Curr.Med.Res.Opin., 23 (12), 2913-2920, (2007) »PubMed
- He Y.-L,et al., Curr.Med.Res.Opin., 23 (5), 1131-1138, (2007) »PubMed
- He Y.-L,et al., J.Clin.Pharmacol., 47 (8), 998-1004, (2007) »PubMed
- Serra D,et al., Int.J.Clin.Pharmacol.Ther., 46 (7), 349-364, (2008) »PubMed
- He Y.-L,et al., Curr.Med.Res.Opin., 25 (5), 1265-1272, (2009) »PubMed
- Kikuchi M,et al., Diabetes Res.Clin.Pract., 83 (2), 233-240, (2009) »PubMed
- 国内第II相試験(エクア錠:2010年1月20日承認、申請資料概要2.7.6-4.1.1)
- 菊池方利ほか, 新薬と臨牀, 59 (2), 121-136, (2010)
- Iwamoto Y,et al., Diabetes Obes.Metab., 12 (8), 700-708, (2010) »PubMed
- 国内第III相試験(エクア錠:2010年1月20日承認、申請資料概要2.7.6-4.1.3)
- Kikuchi M,et al., Diabetes Res.Clin.Pract., 89 (3), 216-223, (2010) »PubMed
- 国内第III相試験(エクア錠:2010年1月20日承認、申請資料概要2.7.6-4.1.4)
- 菊池方利ほか, 新薬と臨牀, 59 (2), 137-154, (2010)
- 小田原雅人ほか, 新薬と臨牀, 61 (12), 2593-2611, (2012)
- Hirose T,et al., Diabetes Ther., 6 (4), 559-571, (2015) »PubMed
- 各種DPPに対する阻害作用の検討(エクア錠:2010年1月20日承認、申請資料概要2.6.2-2.1.2.2)
- DPP-4に対する阻害様式の検討(エクア錠:2010年1月20日承認、申請資料概要2.6.2-2.1.1.3)
- Ahren Bo, Best Pract.Res.Clin.Endocrinol.Metab., 21 (4), 517-533, (2007) »PubMed
- DPP-4に対する阻害活性の検討(エクア錠:2010年1月20日承認、申請資料概要2.6.2-2.1.1.1)
- Azuma K,et al., J.Clin.Endocrinol.Metab., 93 (2), 459-464, (2008) »PubMed
- インスリン抵抗性に対する作用(エクア錠:2010年1月20日承認、申請資料概要2.5-3.2.2.6)
- 前糖尿病期及び2型糖尿病カニクイザルのHbA1cに対する検討(エクア錠:2010年1月20日承認、申請資料概要2.6.2-2.2.4.2.4)
24. 文献請求先及び問い合わせ先
文献請求先
株式会社フェルゼンファーマ
安全管理部
〒105-0001
東京都港区虎ノ門1-1-18 ヒューリック虎ノ門ビル
電話:03-6368-5160
FAX:03-3580-1522
製品情報問い合わせ先
株式会社フェルゼンファーマ
安全管理部
〒105-0001
東京都港区虎ノ門1-1-18 ヒューリック虎ノ門ビル
電話:03-6368-5160
FAX:03-3580-1522
26. 製造販売業者等
26.1 製造販売元
ダイト株式会社
富山県富山市八日町326番地
26.2 販売元
株式会社フェルゼンファーマ
札幌市中央区北10条西24丁目3番地