医薬品情報
| 総称名 | タフルプロスト |
|---|---|
| 一般名 | タフルプロスト |
| 欧文一般名 | Tafluprost |
| 製剤名 | タフルプロスト点眼液 |
| 薬効分類名 | プロスタグランジンF2α誘導体 緑内障・高眼圧症治療剤 |
| 薬効分類番号 | 1319 |
| ATCコード | S01EE05 |
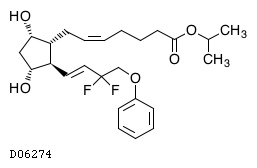
| KEGG DRUG |
D06274
タフルプロスト
|
| KEGG DGROUP |
DG03201
眼圧降下薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年12月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| タフルプロスト点眼液0.0015%「わかもと」 (後発品) | TAFLUPROST OPHTHALMIC SOLUTION「WAKAMOTO」 | わかもと製薬 | 1319756Q1073 | 308円/mL | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 オミデネパグ イソプロピルを投与中の患者[10.1参照]
4. 効能または効果
緑内障、高眼圧症
6. 用法及び用量
1回1滴、1日1回点眼する。
7. 用法及び用量に関連する注意
頻回投与により眼圧下降作用が減弱する可能性があるので、1日1回を超えて投与しないこと。
8. 重要な基本的注意
8.1 本剤の投与により、虹彩や眼瞼への色素沈着(メラニンの増加)による色調変化、あるいは眼周囲の多毛化があらわれることがある。これらは投与の継続によって徐々に進行し、投与中止により停止する。眼瞼色調変化及び眼周囲の多毛化については、投与中止後徐々に消失、あるいは軽減する可能性があるが、虹彩色調変化については投与中止後も消失しないことが報告されている。混合色虹彩の患者では虹彩の色調変化は明確に認められるが、暗褐色の単色虹彩の患者(日本人に多い)においても変化が認められている。特に片眼投与の場合、左右眼で虹彩の色調に差が生じる可能性がある。これらの症状については、長期的な情報が十分に得られていないので、患者を定期的に診察し、十分観察すること。投与に際しては、これらの症状について患者に十分説明し、また、眼瞼色調変化、眼周囲の多毛化の予防あるいは軽減のため、投与の際に液が眼瞼皮膚等についた場合には、よくふき取るか、洗顔するよう患者を指導すること。[11.1.1、14.1参照]
8.2 角膜上皮障害(点状表層角膜炎、糸状角膜炎、角膜びらん)があらわれることがあるので、しみる、そう痒感、眼痛等の自覚症状が持続する場合には、直ちに受診するよう患者に指導すること。
8.3 本剤の点眼後、一時的に霧視があらわれることがあるため、その症状が回復するまで機械類の操作や自動車等の運転には従事させないよう注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 無水晶体眼又は眼内レンズ挿入眼の患者
嚢胞様黄斑浮腫を含む黄斑浮腫、及びそれに伴う視力低下を起こすとの報告がある。
9.1.2 気管支喘息又はその既往歴のある患者
喘息発作を悪化又は誘発するおそれがある。
9.1.3 眼内炎(虹彩炎、ぶどう膜炎)のある患者
類薬で眼圧上昇がみられたとの報告がある。
9.1.4 閉塞隅角緑内障の患者
使用経験がない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験では妊娠ラットに静脈内投与した場合、30μg/kg/日(臨床用量注)の2000倍)では催奇形性及び着床後胚死亡率の増加がみられ、10μg/kg/日(臨床用量注)の約670倍)では胎児の発育に対する影響(胎児体重の低値及び胸骨未骨化)が認められた。妊娠ウサギに静脈内投与した場合、0.1μg/kg/日(臨床用量注)の約6.7倍)では流産、着床後死亡率の増加、黄体数・着床数の減少等が観察され、0.03μg/kg/日(臨床用量注)の2倍)では催奇形性が認められた。妊娠・授乳ラットに静脈内投与した場合、1μg/kg/日(臨床用量注)の約67倍)では母動物の哺育不良及び出生児の4日生存率の低値が認められた。また、摘出ラット子宮を用いた実験では、臨床用量注)点眼投与時の推定血漿中濃度(30pg/mL未満)の約3.3倍、タンパク結合率にて換算した推定血漿中非結合型薬物濃度(0.24pg/mL未満)の約420倍で、子宮収縮への作用が認められている。
注)本剤0.0015%を60kgの患者の両眼に1回1滴(30μL)を点眼投与したときの投与量(0.015μg/kg/日)
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット:点眼投与)で乳汁中への移行が報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
10.1 併用禁忌
| オミデネパグ イソプロピル エイベリス点眼液 [2.2参照] | 中等度以上の羞明、虹彩炎等の眼炎症が高頻度に認められている。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 虹彩色素沈着(8.1%)[8.1参照]
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | 頻度不明 | |
| 眼 | 結膜充血(31.3%)、睫毛の異常(睫毛が長く、太く、多くなる等)、眼のそう痒感、眼刺激、眼の異物感、眼瞼色素沈着、点状表層角膜炎等の角膜上皮障害、眼の異常感(違和感、ねばつき感、乾燥感等) | 眼痛、眼瞼部多毛、眼脂、羞明、眼重感、流涙増加、霧視、結膜浮腫、眼瞼炎 | 結膜下出血、乾性角結膜炎、結膜炎、虹彩炎 | 上眼瞼溝深化、黄斑浮腫 |
| 精神神経系 | 頭痛 | めまい | ||
| 皮膚 | 紅斑 | 発疹 | ||
| その他 | AST上昇、尿蛋白陽性、血清カリウム上昇 | ALT上昇、γ-GTP上昇、尿糖陽性、好酸球増加、白血球数減少、尿酸上昇 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜嚢内に点眼し、1〜5分間閉瞼して涙嚢部を圧迫させた後、開瞼すること。
・点眼したときに液が眼瞼皮膚等についた場合には、すぐにふき取るか、洗顔すること。[8.1参照]
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
・本剤に含まれているベンザルコニウム塩化物はソフトコンタクトレンズに吸着されることがあるので、ソフトコンタクトレンズを装用している場合には、点眼前にレンズを外し、点眼後少なくとも5〜10分間の間隔をあけて再装用すること。
16. 薬物動態
16.1 血中濃度
0.0025%もしくは0.005%タフルプロスト点眼液注)を健康成人各7例の両眼に1回1滴、1日1回7日間反復点眼したとき、タフルプロスト及び活性代謝物であるタフルプロストカルボン酸体の血漿中濃度は、0.0025%群の1例で1日目の点眼15分後にタフルプロストカルボン酸体が0.144ng/mL検出された以外、すべての測定時点で定量下限(タフルプロスト:0.2ng/mL、タフルプロストカルボン酸体:0.1ng/mL)未満であった1)。
注)本剤の承認されている濃度は0.0015%である。
16.3 分布
16.4 代謝
・主として角膜に存在するカルボキシエステラーゼにより、活性代謝物であるタフルプロストカルボン酸体に速やかに加水分解される4)(in vitro)。
・ヒト肝細胞を用いた3H-タフルプロストのin vitro代謝試験では、タフルプロストカルボン酸体とそのグルクロン酸抱合体、dinorタフルプロストカルボン酸体とその水酸化体及びグルクロン酸抱合体、tetranorタフルプロストカルボン酸体とその水酸化体及びグルクロン酸抱合体が検出された5)。
16.8 その他
本剤は、タプロス点眼液0.0015%の分析結果に基づき添加剤の種類及び含量(濃度)がタプロス点眼液0.0015%と同一となるよう処方設計を行ったものであり、pH、粘度、浸透圧などの物理化学的性質が近似することから、生物学的に同等とみなされた。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(ラタノプロスト対照比較試験)
原発開放隅角緑内障又は高眼圧症患者109例(有効性解析対象97例)を対象とした無作為化盲検比較試験において、0.0015%タフルプロスト点眼液又は0.005%ラタノプロスト点眼液を1日1回、4週間点眼した結果、0.0015%タフルプロスト点眼液投与後4週の眼圧変化値(平均値±標準偏差)は−6.6±2.5mmHgであり、対照薬に対する非劣性が検証された(表1)。
副作用は、0.0015%タフルプロスト点眼液群55例中22例(40.0%)に認められ、主な副作用は結膜充血16.4%(9/55例)であった6)。
副作用は、0.0015%タフルプロスト点眼液群55例中22例(40.0%)に認められ、主な副作用は結膜充血16.4%(9/55例)であった6)。
| 0.0015%タフルプロスト点眼液 (n=46) | 対照薬 (n=51) | |
| ベースライン | 23.8±2.3 | 23.7±2.3 |
| 治療期終了時 (4週後または中止時) | 17.2±2.8 | 17.5±2.7 |
| 眼圧変化値 | −6.6±2.5 | −6.2±2.5 |
| 平均値の群間差 (0.0015%タフルプロスト点眼液−対照薬) | −0.41 | |
| 平均値の差の95%信頼区間 | −1.42〜0.60 | |
17.1.2 国内第III相試験(プラセボ対照比較試験)
正常眼圧緑内障患者95例(有効性解析対象90例)を対象とした無作為化盲検比較試験において、0.0015%タフルプロスト点眼液又はプラセボ点眼液を1日1回、4週間点眼した結果、0.0015%タフルプロスト点眼液投与後4週の眼圧変化値(平均値±標準偏差)は−4.0±1.7mmHgであり、対照薬に比し有意な眼圧下降を認めた(表2)。
副作用は、0.0015%タフルプロスト点眼液群49例中25例(51.0%)に認められ、主な副作用は結膜充血26.5%(13/49例)であった7)8)。
副作用は、0.0015%タフルプロスト点眼液群49例中25例(51.0%)に認められ、主な副作用は結膜充血26.5%(13/49例)であった7)8)。
| 0.0015%タフルプロスト点眼液 (n=48) | プラセボ (n=42) | |
| ベースライン | 17.7±1.3 | 17.8±1.5 |
| 治療期終了時 (4週後または中止時) | 13.8±2.1 | 16.4±2.2 |
| 眼圧変化値 | −4.0±1.7 | −1.4±1.8 |
| 平均値の群間差 (0.0015%タフルプロスト点眼液−プラセボ) | −2.60 | |
| 平均値の差の95%信頼区間 | −3.35〜−1.85 | |
| P値(t検定) | <0.001 | |
18. 薬効薬理
18.1 作用機序
18.2 眼圧下降作用
サルに0.00002%〜0.005%のタフルプロスト点眼液を単回点眼したとき、濃度依存的な眼圧下降作用が認められ、この作用は0.0005%以上の濃度で基剤点眼群に比し有意であった。同じくサルに対し0.001%〜0.005%のタフルプロスト点眼液を1日1回5日間反復点眼したとき、すべての用量において点眼期間中安定した眼圧下降が持続し、作用の減弱は認められなかった9)。
18.3 眼血流への作用
19. 有効成分に関する理化学的知見
19.1. タフルプロスト
22. 包装
プラスチック点眼容器
2.5mL×5本、2.5mL×10本
23. 主要文献
- 第I相試験(タプロス点眼液0.0015%:2008年10月16日承認、申請資料概要2.7.6.2)
- Fukano Y,et al., J Ocul Pharmacol Ther., 27, 251-259, (2011) »PubMed
- 分布(タプロス点眼液0.0015%:2008年10月16日承認、申請資料概要2.4.3.2)
- 代謝(タプロス点眼液0.0015%:2008年10月16日承認、申請資料概要2.6.4.1)
- Fukano Y,et al., Drug Metab Dispos., 37, 1622-1634, (2009) »PubMed
- 桑山泰明 他, あたらしい眼科, 25, 1595-1602, (2008)
- 桑山泰明 他, 日本眼科学会雑誌, 114, 436-443, (2010) »PubMed
- 第III相比較試験(タプロス点眼液0.0015%:2008年10月16日承認、申請資料概要2.7.6.4)
- Takagi Y,et al., Exp Eye Res., 78, 767-776, (2004) »PubMed
- 受容体親和性及び選択性に関する検討(タプロス点眼液0.0015%:2008年10月16日承認、申請資料概要2.6.2.2)
- 臨床薬理試験(タプロス点眼液0.0015%:2008年10月16日承認、申請資料概要2.7.6.13)
- Akaishi T,et al., J Ocul Pharmacol Ther., 26, 181-186, (2010) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
わかもと製薬株式会社
メディカルインフォメーション
〒103-8330
東京都中央区日本橋本町二丁目2番2号
電話:03-3279-0379
FAX:03-3279-1272
製品情報問い合わせ先
わかもと製薬株式会社
メディカルインフォメーション
〒103-8330
東京都中央区日本橋本町二丁目2番2号
電話:03-3279-0379
FAX:03-3279-1272
26. 製造販売業者等
26.1 製造販売元
わかもと製薬株式会社
東京都中央区日本橋本町二丁目2番2号