医薬品情報
| 総称名 | エピナスチン塩酸塩 |
|---|---|
| 一般名 | エピナスチン塩酸塩 |
| 欧文一般名 | Epinastine Hydrochloride |
| 製剤名 | エピナスチン塩酸塩点眼液 |
| 薬効分類名 | 抗アレルギー点眼剤 |
| 薬効分類番号 | 1319 |
| KEGG DRUG |
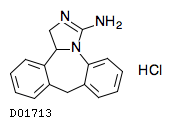
D01713
エピナスチン塩酸塩
|
| KEGG DGROUP |
DG01482
ヒスタミンH1受容体拮抗薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年8月 作成(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| エピナスチン塩酸塩LX点眼液0.1%「ニットー」 (後発品) | Epinastine Hydrochloride LX Ophthalmic Solution 0.1%「NITTO」 | 東亜薬品 | 1319762Q2040 | 252.9円/mL |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
アレルギー性結膜炎
6. 用法及び用量
通常、1回1滴、1日2回(朝、夕)点眼する。
8. 重要な基本的注意
8.1 本剤の使用により効果が認められない場合には、漫然と長期にわたり投与しないよう注意すること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。妊娠前及び妊娠初期試験(ラット:経口)では受胎率の低下が、器官形成期試験(ウサギ:経口)では胎児致死作用が、いずれも高用量で認められている1)。
9.7 小児等
12歳未満の小児等を対象とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 0.1〜1%未満 | 頻度不明 | |
| 眼 | 結膜充血 | 眼刺激、眼の異物感、羞明、眼瞼炎、眼痛、流涙、点状角膜炎、眼のそう痒感、眼脂 |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜のう内に点眼し、1〜5分間閉瞼して涙のう部を圧迫させた後、開瞼すること。
・点眼したときに液が眼瞼皮膚等についた場合には、すぐにふき取ること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
・本剤に含まれているベンザルコニウム塩化物は、ソフトコンタクトレンズに吸着されることがあるので、ソフトコンタクトレンズを装用している場合は、点眼前にレンズを外し、点眼5分以上経過後に再装用すること。
16. 薬物動態
16.1 血中濃度
健康成人男性6例に0.3%エピナスチン塩酸塩点眼液注)を片眼に1回2滴、1日4回7日間反復点眼したときの血漿中エピナスチン濃度は、最終点眼後10分において、すべての被験者で定量下限(1ng/mL)未満であった2)。
注)本剤が承認されている濃度は0.1%である。
16.3 分布
・サルの両眼に0.05%14C-エピナスチン塩酸塩点眼液を単回点眼したとき、主に外眼部組織に高濃度で分布し、その濃度は眼瞼、虹彩、結膜、角膜、強膜、毛様体の順であった。また、メラニン含有組織である虹彩、毛様体及び網脈絡膜中濃度の経時的な減少は、点眼後24時間以内において認められなかった3)。
・ラットの両眼にエピナスチン塩酸塩点眼液(0.05%製剤)及びエピナスチン塩酸塩点眼液(0.1%製剤)を単回点眼したとき、結膜中エピナスチン濃度はいずれも最初の測定時点である点眼後1時間にCmaxを示した後、時間経過とともに低下した。結膜中エピナスチンのCmaxは用量依存的に増加した4)。
16.4 代謝
・健康成人男性に経口投与した場合の尿及び糞抽出物中の代謝物量を検討したところ、ほとんど未変化体であった5)。
・エピナスチンの代謝にCYP3A4、CYP2D6及びCYP2B6の関与が示唆された6)(in vitro)。
16.5 排泄
健康成人男性に経口投与したとき、主に尿中及び糞中に排泄され、排泄率はそれぞれ25.4%及び70.4%であった5)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(抗原誘発試験)
無症状期のアレルギー性結膜炎患者(68例)を対象に、片眼にエピナスチン塩酸塩点眼液(0.05%製剤34例、0.1%製剤34例)、他眼にプラセボ点眼液を無作為に割付け、各眼に各点眼液を1回1滴点眼した。各点眼液点眼4時間後又は8時間後にスギ花粉抗原溶液を点眼し、症状について評価した。その結果、眼そう痒感スコア及び結膜充血スコアにおいて、エピナスチン塩酸塩点眼液(0.1%製剤)のプラセボ点眼液に対する優越性が示された(表1)。休薬期間を設けた後、片眼に前回とは異なるエピナスチン塩酸塩点眼液(0.05%製剤34例、0.1%製剤34例)、他眼にプラセボ点眼液を、1回1滴点眼し、各点眼液点眼4時間後又は8時間後にスギ花粉抗原溶液を点眼し、クロスオーバー比較を行った。その結果、眼そう痒感スコアにおいて、エピナスチン塩酸塩点眼液(0.1%製剤、1日2回点眼相当)のエピナスチン塩酸塩点眼液(0.05%製剤、1日4回点眼相当)に対する非劣性が示された(表2)。
エピナスチン塩酸塩点眼液の0.1%製剤群及び0.05%製剤群のいずれも副作用は認められなかった7)。
エピナスチン塩酸塩点眼液の0.1%製剤群及び0.05%製剤群のいずれも副作用は認められなかった7)。
| 0.1%製剤 (34例) | プラセボ (34例) | 群間差 [95%信頼区間] P値注) | |
| 眼そう痒感スコア | 0.4±0.6 | 2.0±0.7 | −1.6 [−1.87,−1.27] P<0.001 |
| 結膜充血スコア | 2.5±1.4 | 4.2±1.2 | −1.7 [−2.30,−1.01] P<0.001 |
| 0.1%製剤 (1日2回点眼相当) (68例) | 0.05%製剤 (1日4回点眼相当) (68例) | 0.1%製剤−0.05%製剤群間差 [95%信頼区間]注) | |
| 眼そう痒感スコア | 0.4±0.5 | 0.3±0.4 | 0.1 [−0.07,0.23] |
17.1.2 国内第III相試験(環境試験)
アレルギー性結膜炎患者(121例)を対象に、環境下でエピナスチン塩酸塩点眼液(0.1%製剤)を1回1滴、1日2回(朝、夕)8週間点眼する非盲検非対照試験(長期投与試験)を実施した結果、眼そう痒感スコア(平均値±標準偏差)はベースライン3.1±0.4(121例)、7日目2.0±1.0(121例)、14日目1.8±1.0(120例)、28日目1.5±0.9(120例)、42日目0.8±0.8(120例)、56日目0.6±0.8(120例)であった。眼瞼結膜充血スコア(平均値±標準偏差)はベースライン1.4±0.7(117例)、7日目1.1±0.8(117例)、14日目1.1±0.7(116例)、28日目0.9±0.7(116例)、42日目0.8±0.7(116例)、56日目0.5±0.6(116例)であった。眼球結膜充血スコア(平均値±標準偏差)はベースライン1.2±0.7(103例)、7日目0.8±0.5(103例)、14日目0.7±0.5(103例)、28日目0.4±0.5(103例)、42日目0.4±0.5(103例)、56日目0.3±0.5(103例)であった。
副作用は、眼充血0.8%(1/121例)であった8)。
副作用は、眼充血0.8%(1/121例)であった8)。
17.1.3 臨床効果の類似性を確認する試験(抗原誘発試験)
無症状期のアレルギー性結膜炎患者(60例)を対象に、両眼にエピナスチン塩酸塩LX点眼液0.1%「ニットー」又はアレジオンLX点眼液0.1%を左右眼で異なる点眼液が点眼されるよう無作為に割付け、部分遮蔽、クロスオーバー法により、各眼に各点眼液を1期あたり1回1滴点眼した。各点眼液点眼8時間後にスギ花粉抗原溶液を点眼し、症状について評価した。その結果、眼そう痒感スコア及び結膜充血スコアにおいて、製剤間差の点推定値は類似性の許容域±0.5の範囲内であり、両剤の臨床効果の類似性が確認された。
臨床効果の類似性を確認する試験(60例)において、副作用は認められなかった9)。
臨床効果の類似性を確認する試験(60例)において、副作用は認められなかった9)。
| 治験薬未投与時 (n=120) | 治験薬投与時 | |||
| エピナスチン塩酸塩LX点眼液0.1%「ニットー」 (n=120) | アレジオンLX点眼液0.1% (n=120) | 群間差 | ||
| 眼そう痒感スコア | 2.6±0.6 | 0.7±0.6 | 0.7±0.6 | −0.03 |
| 結膜充血スコア | 4.4±1.0 | 2.1±1.3 | 2.1±1.3 | 0.04 |
18. 薬効薬理
18.1 作用機序
18.2 抗ヒスタミン作用
18.3 メディエーター遊離抑制作用
18.4 実験的アレルギー性結膜炎モデルに対する効果
モルモットのアレルギー性結膜炎モデルで結膜の血管透過性亢進を抑制した14)。
18.5 薬理効果の同等性を評価する試験
モルモット(Hartley系/雄性)の片眼にエピナスチン塩酸塩LX点眼液0.1%「ニットー」又はアレジオンLX点眼液0.1%を、対眼に生理食塩液を単回点眼投与し、その24又は28時間後に色素溶液を静脈内投与した。続いてヒスタミンを点眼投与し、その30分後に結膜を採取し、両眼の結膜組織中に漏出した色素量測定値を基に血管透過性亢進抑制率(抑制率)を算出して比較した。その結果、製剤投与後24及び28時間時点における抑制率の平均値の差の割合は、いずれも90%信頼区間で許容域の範囲内にあり、両剤の血管透過性亢進抑制作用は同等であった15)。
| 評価時点 | 血管透過性亢進抑制作用 (抑制率;%)注1) | 平均値の差の割合の90%信頼区間注2) | |
| エピナスチン塩酸塩LX点眼液0.1%「ニットー」 | アレジオンLX点眼液0.1% | ||
| 製剤投与後24時間 (N=45/群) | 62.23±16.55 | 61.97±16.29 | −8.86〜9.72 |
| 製剤投与後28時間 (N=49/群) | 56.08±15.68 | 57.01±17.64 | −11.46〜8.19 |
19. 有効成分に関する理化学的知見
19.1. エピナスチン塩酸塩
22. 包装
プラスチック点眼容器 5mL×10本
23. 主要文献
- Niggeschulze A,et al., 応用薬理, 41, 355-369, (1991)
- 臨床第I相試験−連続投与試験−(アレジオン点眼液0.05%:2013年9月20日承認、申請資料概要2.7.6.2)
- 薬物動態試験概要−サル単回投与試験−(アレジオン点眼液0.05%:2013年9月20日承認、申請資料概要2.6.4.4)
- 眼組織分布試験(アレジオンLX点眼液0.1%:2019年9月20日承認、審査報告書)
- 健康成人における成績(アレジオンドライシロップ:2005年1月19日承認、申請資料概要ヘ.3.1)
- Kishimoto,W.et al., Res.Commun.Mol.Pathol.Pharmacol., 98, 273-292, (1997) »PubMed
- 国内第III相試験(アレジオンLX点眼液0.1%:2019年9月20日承認、審査報告書)
- 国内長期投与試験(アレジオンLX点眼液0.1%:2019年9月20日承認、審査報告書)
- 社内資料:臨床効果の類似性を確認する試験(抗原誘発試験)
- Fugner A.et al., Arzneimittel-Forschung/Drug Research., 38, 1446-1453, (1988)
- モルモットのヒスタミン誘発による結膜炎モデルの血管透過性亢進に対する作用(アレジオン点眼液0.05%:2013年9月20日承認、申請資料概要2.6.2.2)
- 正常又は受動感作アレルギー性結膜炎モデルラットの結膜肥満細胞の脱顆粒に対する作用(アレジオン点眼液0.05%:2013年9月20日承認、申請資料概要2.6.2.2)
- ラット受動感作アレルギー性結膜炎モデルの摘出結膜からのヒスタミン遊離に対する作用(アレジオン点眼液0.05%:2013年9月20日承認、申請資料概要2.6.2.2)
- 能動感作アレルギー性結膜炎モデルにおける血管透過性亢進抑制作用(アレジオンLX点眼液0.1%:2019年9月20日承認、審査報告書)
- 社内資料:エピナスチン塩酸塩LX点眼液0.1%「ニットー」の生物学的同等性試験
24. 文献請求先及び問い合わせ先
文献請求先
日東メディック株式会社
おくすり相談窓口
〒104-0031
東京都中央区京橋1-10-7
電話:03-3523-0345
FAX:03-6264-4086
製品情報問い合わせ先
日東メディック株式会社
おくすり相談窓口
〒104-0031
東京都中央区京橋1-10-7
電話:03-3523-0345
FAX:03-6264-4086
26. 製造販売業者等
26.1 製造販売元
東亜薬品株式会社
富山県富山市水橋開発277番10
26.2 発売元
日東メディック株式会社
富山県富山市八尾町保内1-14-1