医薬品情報
| 総称名 | オラネジン |
|---|---|
| 一般名 | オラネキシジングルコン酸塩 |
| 欧文一般名 | Olanexidine Gluconate |
| 製剤名 | オラネキシジングルコン酸塩液 |
| 薬効分類名 | 外用殺菌消毒剤 |
| 薬効分類番号 | 2619 |
| KEGG DRUG |
D10451
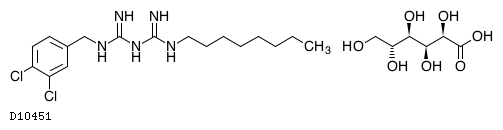
オラネキシジングルコン酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年7月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| オラネジン液1.5%消毒用カートリッジ25mL | Olanedine Solution 1.5% Antiseptic Cartridges | 大塚製薬工場 | 2619717Q3050 | ||
| オラネジン液1.5%OR消毒用カートリッジ25mL | Olanedine Solution 1.5% OR Antiseptic Cartridges | 大塚製薬工場 | 2619717Q3042 |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
手術部位(手術野)の皮膚の消毒
6. 用法及び用量
本剤を適量塗布する。
8. 重要な基本的注意
使用に際しては、本剤の成分に対する過敏症の既往歴、薬物過敏体質の有無について十分確認すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 薬物過敏症の既往歴のある患者(本剤の成分に対し過敏症の既往歴のある患者を除く)
9.1.2 喘息等のアレルギー疾患の既往歴、家族歴のある患者
9.1.3 クロルヘキシジン製剤に対し過敏症の既往歴のある患者
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。授乳中ラットを用いた動物実験で乳汁中に移行することが報告されている1)。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 0.1〜5%未満 | |
| 皮膚注) | 適用部位皮膚炎、適用部位紅斑、適用部位そう痒感 |
14. 適用上の注意
14.1 薬剤使用時の注意
14.1.1 脳、脊髄、眼、耳(内耳、中耳、外耳)に使用しないこと。湿疹又は発疹の部位に使用しないこと。
14.1.2 創傷部位(手術創を含む切創、びらん、潰瘍等)に使用しないこと。創傷部位への使用により血中濃度が上昇するおそれがある。創傷部位への使用による安全性は確立していない。[16.2.2参照]
14.1.3 粘膜に使用しないこと。類薬のクロルヘキシジン製剤において、粘膜面への使用によりショック症状が発現したとの報告があり、粘膜面への使用は禁忌とされている。
14.1.4 本剤は希釈せず、原液のまま使用すること。
14.1.5 本剤が眼及びその他の粘膜面に付着・飛散しないよう注意すること。誤って付着・飛散した場合は、直ちに水でよく洗い流し、速やかに診察を受ける等の処置を講じること。
14.1.6 使用に際しては、開封口からゆっくり開けること。
14.1.7 専用の塗布具と合わせて使用すること。
14.1.8 薬液容器開通時は薬液が専用の塗布具のハンドル内からなくなるまでフォーム面を下にし、水平に保持すること。
14.1.9 専用の塗布具のフォームに薬液を浸透させた後は速やかに使用すること。
14.1.10 本剤塗布後は、本剤が乾燥するまで待ち、皮膚との接触時間を十分に取ること。
14.1.11 開封後の使用は一回限りとし、使用後は速やかに廃棄すること。
16. 薬物動態
16.1 血中濃度
16.1.1 消化器手術施行予定の患者による成績
腹腔鏡下での消化器手術施行予定の患者にオラネキシジングルコン酸塩液1.5%を手術前の皮膚に塗布した結果、血清中オラネキシジン濃度は52例中27例において定量下限(0.050ng/mL)未満であった。定量下限を超えた25例の最高血清中濃度は0.053〜1.536ng/mLであった。塗布0.5時間後から血清中に認められ、血清中濃度の平均値は塗布2時間後に最大値となり、塗布168時間後にはいずれの被験者も定量下限未満となった2)。
16.1.2 健康成人による成績
16.2 吸収
16.2.1 ヒト皮膚を用いた透過性
ヒト皮膚を用いたin vitro皮膚透過性試験の結果、14C標識オラネキシジングルコン酸塩液1.5%の吸収率は2.34%であった5)。
16.2.2 ラット背部擦過皮膚投与
16.3 分布
16.3.1 ヒト血清たん白結合率
ヒト血清におけるたん白結合率は0.1〜10μg/mLの範囲において99.0%以上であり、その特異性は低く、可逆的であった(in vitro、平衡透析法)7)。
16.3.2 ラット背部正常皮膚投与
14C標識オラネキシジングルコン酸塩液1.5%をラット背部の正常皮膚に単回経皮投与した結果、放射能は主に投与部位、副腎、甲状腺、腎臓、肺、顎下腺、褐色脂肪等に分布し、皮膚からの移行が認められたが、蓄積性は認めなかった。ラット背部の正常又は擦過皮膚に単回経皮投与した結果、放射能が分布する組織に違いは認めなかった6)。
16.3.3 妊娠ラット皮下投与
妊娠ラットに皮下投与した結果、胎児と羊水中に放射能の移行を認めなかった1)。
16.4 代謝
16.5 排泄
16.7 薬物相互作用
16.8 その他
16.8.1 製剤間での薬物動態の比較(ラット)
雄性ラット腹部の正常皮膚にオラネジン消毒液1.5%又はオラネジン消毒液1.5%ORを単回経皮投与した結果、Cmax及びAUCは同程度であった14)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
健康成人を対象とした無作為化単盲検並行群間比較試験において、オラネキシジングルコン酸塩液1.5%(オラネジン消毒液1.5%)、0.5%クロルヘキシジングルコン酸塩液(CHG)又は基剤(プラセボ)を被験部位として腹部及び鼠径部に適量塗布した。
有効性解析対象症例592例(オラネジン消毒液1.5%群:237例、CHG群:236例、プラセボ群:119例)の結果は、以下のとおりであり、腹部及び鼠径部でオラネジン消毒液1.5%のプラセボに対する優越性が検証された(表17-1)。
副作用発現頻度は、オラネジン消毒液1.5%群1.3%(3/237例)、CHG群0.8%(2/237例)、プラセボ群0.8%(1/120例)であった。オラネジン消毒液1.5%群の副作用は適用部位紅斑1.3%(3/237例)であった2)。
有効性解析対象症例592例(オラネジン消毒液1.5%群:237例、CHG群:236例、プラセボ群:119例)の結果は、以下のとおりであり、腹部及び鼠径部でオラネジン消毒液1.5%のプラセボに対する優越性が検証された(表17-1)。
副作用発現頻度は、オラネジン消毒液1.5%群1.3%(3/237例)、CHG群0.8%(2/237例)、プラセボ群0.8%(1/120例)であった。オラネジン消毒液1.5%群の副作用は適用部位紅斑1.3%(3/237例)であった2)。
| オラネジン消毒液1.5%群 | CHG群 | プラセボ群 | |
| 【腹部】 | |||
| 塗布前 | 2.799±0.514 (474) | 2.748±0.543 (471) | 2.748±0.576 (238) |
| 塗布10分後 | 0.285±0.728 (474) | 0.521±0.803 (471) | 1.528±0.780 (238) |
| プラセボ群との群間差 [95%信頼区間]a) | 1.243 [1.100,1.386] P<0.001 | / | |
| CHG群との群間差 [95%信頼区間]a) | 0.235 [0.118,0.353] | ||
| 【鼠径部】 | |||
| 塗布前 | 5.211±1.128 (471) | 5.299±1.102 (472) | 5.159±1.291 (236) |
| 塗布10分後 | 2.811±1.450 (472) | 2.826±1.360 (470) | 4.504±0.993 (237) |
| プラセボ群との群間差 [95%信頼区間]a) | 1.706 [1.505,1.907] P<0.001 | / | |
| CHG群との群間差 [95%信頼区間]a) | 0.016 [−0.159,0.191] | ||
17.1.2 国内第III相試験(消化器手術患者を対象とした安全性確認試験)
腹腔鏡下での消化器手術施行予定の患者106例を対象とした無作為化非盲検並行群間比較試験において、オラネキシジングルコン酸塩液1.5%又は10%ポビドンヨード液(対照薬)を手術部位(手術野)の皮膚に塗布した。
副作用発現頻度は、オラネジン消毒液1.5%群5.8%(3/52例)で、副作用は適用部位皮膚炎、適用部位紅斑及び適用部位そう痒感が各1例(1.9%)であった2)。
副作用発現頻度は、オラネジン消毒液1.5%群5.8%(3/52例)で、副作用は適用部位皮膚炎、適用部位紅斑及び適用部位そう痒感が各1例(1.9%)であった2)。
18. 薬効薬理
18.1 作用機序
18.2 殺菌作用
18.3 効力を裏付ける試験成績
18.3.1 各種細菌(標準菌株及び臨床分離株)に対する殺菌作用(in vitro試験)
被験菌液と希釈したオラネキシジングルコン酸塩液を所定時間作用させた後、殺菌活性を停止させた作用液を培養し菌の増殖を判定した。増殖のみられない最小濃度を最小殺菌濃度(MBC)とした。
メチシリン耐性黄色ブドウ球菌(MRSA)を含むブドウ球菌属、バンコマイシン耐性腸球菌(VRE)を含む腸球菌属、Micrococcus属などグラム陽性球菌(155菌株)に対して、30秒間処置で0.0014〜>0.35%、1分間処置で≦0.00068〜0.17%のMBCを示した。
コリネバクテリウム属、Cutibacterium属などのグラム陽性桿菌(29菌株)に対して、30秒及び1分間処置で≦0.00068〜0.17%、3分間処置で≦0.00068〜0.011%のMBCを示した。
Acinetobacter属、大腸菌、緑膿菌、Serratia marcescens、Klebsiella pneumoniaeなどのグラム陰性菌(136菌株)に対して、30秒及び1分間処置で≦0.00068〜>0.70%、3分間処置で≦0.00068〜0.043%のMBCを示した20)21)。
メチシリン耐性黄色ブドウ球菌(MRSA)を含むブドウ球菌属、バンコマイシン耐性腸球菌(VRE)を含む腸球菌属、Micrococcus属などグラム陽性球菌(155菌株)に対して、30秒間処置で0.0014〜>0.35%、1分間処置で≦0.00068〜0.17%のMBCを示した。
コリネバクテリウム属、Cutibacterium属などのグラム陽性桿菌(29菌株)に対して、30秒及び1分間処置で≦0.00068〜0.17%、3分間処置で≦0.00068〜0.011%のMBCを示した。
Acinetobacter属、大腸菌、緑膿菌、Serratia marcescens、Klebsiella pneumoniaeなどのグラム陰性菌(136菌株)に対して、30秒及び1分間処置で≦0.00068〜>0.70%、3分間処置で≦0.00068〜0.043%のMBCを示した20)21)。
18.3.2 真菌(標準菌株)に対する殺菌作用(in vitro試験)
Candida albicansを含む酵母様真菌(6菌株)に対して30秒間処置で0.087〜>0.70%、3分間処置で0.0027〜0.043%、10分間処置で≦0.00068〜0.043%、30分間処置で≦0.00068〜0.011%のMBCを示した。
Aspergillus brasiliensis、Microsporum canisを除く糸状真菌(5菌株)に対して30秒間処置で0.011〜>0.35%、3分間処置で0.0027〜0.35%、10分間処置で0.0027〜0.022%、30分間処置で0.0014〜0.0054%のMBCを示した。Aspergillus brasiliensis(1菌株)及びMicrosporum canis(1菌株)は、0.70%、30分間処置でも殺菌できなかった22)。
Aspergillus brasiliensis、Microsporum canisを除く糸状真菌(5菌株)に対して30秒間処置で0.011〜>0.35%、3分間処置で0.0027〜0.35%、10分間処置で0.0027〜0.022%、30分間処置で0.0014〜0.0054%のMBCを示した。Aspergillus brasiliensis(1菌株)及びMicrosporum canis(1菌株)は、0.70%、30分間処置でも殺菌できなかった22)。
18.3.3 ウイルスに対する効力(in vitro試験)
オラネキシジングルコン酸塩液1.5%は、エンベロープを有するウイルスであるインフルエンザAウイルスに対し、作用時間1分以上で対数減少値(Log reduction)4以上の不活化作用を示した。一方、エンベロープがないネコカリシウイルスに対しては、作用時間10分でも弱い不活化効果しか示さなかった23)。
18.3.4 細菌汚染マウス皮膚に対する殺菌力(in vivo試験)
剪毛したマウス背部を被験部位(面積約3.5cm2)とし被験菌液を塗り広げ細菌汚染皮膚を作製した。オラネキシジングルコン酸塩液1.5% 10μLを細菌汚染皮膚に滴下し塗り広げ、所定の時間作用させた後、生残菌を消毒剤不活化剤含有培地に回収した。これを培養し、生残菌数を求めた。その結果、Staphylococcus aureus ATCC 6538、MRSA ATCC 33591、Staphylococcus epidermidis ATCC 12228、Enterococcus faecalis ATCC 51575(VRE)、Corynebacterium diphtheriae ATCC 13812、Acinetobacter baumannii ATCC BAA-747及びPseudomonas aeruginosa ATCC 27853汚染皮膚に対し、オラネキシジングルコン酸塩液1.5%塗布30秒後の平均殺菌率は、それぞれ99.96%、>99.99%、>99.99%、>99.99%、>99.99%、>99.99%、99.99%であった。また、Serratia marcescens ATCC 14756及びBurkholderia cepacia NBRC 14074汚染皮膚に対し、オラネキシジングルコン酸塩液1.5%塗布3分後の平均殺菌率は、それぞれ99.93%、99.78%であった24)。
18.3.5 カニクイザル皮膚常在菌・通過菌に対する殺菌力(in vivo試験)
オラネキシジングルコン酸塩液1.5%塗布群では、塗布10分後及び6時間後のいずれの時点においても生理食塩液塗布群より生残菌数の有意な減少を認め、そのLog reductionは塗布10分後で3.41、6時間後で3.70であった25)。
18.4 製剤間の生物学的同等性試験
オラネジン消毒液1.5%OR(試験製剤)と1.5%OPB2045Gカラード注)(標準製剤)のStaphylococcus aureus ATCC 29213、MRSA ATCC 33591、Staphylococcus epidermidis ATCC 12228、Brevibacterium epidermidis ATCC 35514、Micrococcus luteus ATCC 4698、Enterococcus faecalis ATCC 29212、Enterococcus faecalis ATCC 51575(VRE)、Corynebacterium minutissimum ATCC 23348、Acinetobacter baumannii ATCC 19606、Escherichia coli ATCC 25922、Klebsiella pneumoniae ATCC 13883、Pseudomonas aeruginosa ATCC 27853、Serratia marcescens ATCC 14756、Candida albicans ATCC 90028及びCutibacterium acnes ATCC 11827に対する最小発育阻止濃度(MIC)測定試験及びin vitro殺菌力試験(Time-kill試験)を行った結果、両製剤の生物学的同等性が確認された26)。
注)1.5%OPB2045Gカラードは、有効成分がオラネジン消毒液1.5%ORと同一で添加物のD-マンニトール、ポリビニルアルコール(部分けん化物)を含まない製剤であり、オラネジン消毒液1.5%との生物学的同等性が確認されている27)。
19. 有効成分に関する理化学的知見
19.1. オラネキシジングルコン酸塩
20. 取扱い上の注意
20.1 ブリスター包装内は滅菌しているので、使用時まで開封しないこと。
20.2 ブリスター包装内に薬液が漏れている場合には使用しないこと。
22. 包装
<オラネジン液1.5%消毒用カートリッジ25mL>
25mL 30本
<オラネジン液1.5%OR消毒用カートリッジ25mL>
25mL 30本
23. 主要文献
- (株)大塚製薬工場 社内資料:薬物動態(承認年月日:2015年7月3日、CTD2.6.4.6.5:OPB-2045G04001)
- 針原 康,他, 日本外科感染症学会雑誌, 12 (3), 137-148, (2015)
- (株)大塚製薬工場 社内資料:薬物動態(承認年月日:2015年7月3日、CTD2.7.2.2.2.2)
- (株)大塚製薬工場 社内資料:薬物動態(承認年月日:2015年7月3日、CTD2.7.2.2.2.3)
- (株)大塚製薬工場 社内資料:薬物動態(資料番号:OPB-2045G04007)
- (株)大塚製薬工場 社内資料:薬物動態(承認年月日:2015年7月3日、CTD2.6.4.4.1)
- (株)大塚製薬工場 社内資料:薬物動態(承認年月日:2015年7月3日、CTD2.6.4.4.2:OPB-2045G04002)
- (株)大塚製薬工場 社内資料:薬物動態(承認年月日:2015年7月3日、CTD2.6.4.5.2:OPB-2045G04003)
- (株)大塚製薬工場 社内資料:薬物動態(承認年月日:2015年7月3日、CTD2.6.4.5.2:OPB-2045G04004)
- (株)大塚製薬工場 社内資料:薬物動態(承認年月日:2015年7月3日、CTD2.6.4.6.1)
- (株)大塚製薬工場 社内資料:薬物動態(承認年月日:2015年7月3日、CTD2.6.4.6.2)
- (株)大塚製薬工場 社内資料:薬物動態(承認年月日:2015年7月3日、CTD2.6.4.7:OPB-2045G04005)
- (株)大塚製薬工場 社内資料:薬物動態(承認年月日:2015年7月3日、CTD2.6.4.7:OPB-2045G04006)
- (株)大塚製薬工場 社内資料:薬物動態(資料番号:OPB-2045Gティント04001)
- Hagi A.,et al., Antimicrob Agents Chemother., 59 (8), 4551-4559, (2015) »PubMed
- Sakagami Y.,et al., J Pharm Pharmacol., 51 (2), 201-206, (1999) »PubMed
- Sakagami Y.,et al., J Pharm Pharmacol., 52 (12), 1547-1552, (2000) »PubMed
- (株)大塚製薬工場 社内資料:薬効薬理(承認年月日:2015年7月3日、CTD2.6.2.2.2:OPB-2045G02001)
- Seyama S.,et al., Biol Pharm Bull., 42 (3), 512-515, (2019) »PubMed
- (株)大塚製薬工場 社内資料:薬効薬理(承認年月日:2015年7月3日、CTD2.6.2.2.2:OPB-2045G02002)
- (株)大塚製薬工場 社内資料:薬効薬理(承認年月日:2015年7月3日、CTD2.6.2.2.2:OPB-2045G02003)
- (株)大塚製薬工場 社内資料:薬効薬理(承認年月日:2015年7月3日、CTD2.6.2.2.2:OPB-2045G02004)
- (株)大塚製薬工場 社内資料:薬効薬理(承認年月日:2015年7月3日、CTD2.6.2.2.3:OPB-2045G02005)
- (株)大塚製薬工場 社内資料:薬効薬理(承認年月日:2015年7月3日、CTD2.6.2.2.5:OPB-2045G02006)
- Nakata H.,et al., J Med Microbiol., 66, 678-685, (2017) »PubMed
- (株)大塚製薬工場 社内資料:薬効薬理(資料番号:OPB-2045Gティント02001)
- (株)大塚製薬工場 社内資料:薬効薬理(資料番号:OPB-2045Gカラード02001)
24. 文献請求先及び問い合わせ先
文献請求先
株式会社大塚製薬工場
輸液DIセンター
〒101-0048
東京都千代田区神田司町2-2
電話:0120-719-814
FAX:03-5296-8400
製品情報問い合わせ先
株式会社大塚製薬工場
輸液DIセンター
〒101-0048
東京都千代田区神田司町2-2
電話:0120-719-814
FAX:03-5296-8400
26. 製造販売業者等
26.1 製造販売元
株式会社大塚製薬工場
徳島県鳴門市撫養町立岩字芥原115
26.2 販売提携
大塚製薬株式会社
東京都千代田区神田司町2-9
その他の説明
操作方法
カートリッジ(本剤)の構造
合わせて使用する医療器具:専門の塗布具
(販売名:カートリッジ用塗布具「オーツカ」)
(販売名:カートリッジ用塗布具「オーツカ」)
注意
フォームには触れないこと。
1 ブリスター包装の開封口からシールをゆっくり剥がす。
注意
固定具は外さないこと。
2 本剤の挿入指示マーク(←印)を、専用の塗布具のハンドルの挿入指示マーク(←印)に合わせる。
注意
挿入指示マークを合わせないと、薬液容器が開通しない。
3 本剤を専用の塗布具に挿し込む。
注意
最後まで挿し込むと薬液容器が開通するので注意すること。
4 スリーブの先端を最後まで押し込み、薬液容器を開通させる。
注意
スリーブからの液漏れ、フォームからの液垂れ防止のため、薬液がハンドル内からなくなるまでフォーム面を下にし、水平に保持すること。
5 消毒部位に適量を塗布する。