医薬品情報
| 総称名 | ハイカムチン |
|---|---|
| 一般名 | ノギテカン塩酸塩 |
| 欧文一般名 | Nogitecan Hydrochloride topotecan |
| 製剤名 | ノギテカン塩酸塩注射液 |
| 薬効分類名 | 抗悪性腫瘍剤 |
| 薬効分類番号 | 4240 |
| ATCコード | L01CE01 |
| KEGG DRUG |
D02168
ノギテカン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年8月 作成(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ハイカムチン点滴静注液1mg/1mL | HYCAMTIN for I.V.infusion 1mg/1mL | 日本化薬 | 4240408A1022 | 6070円/瓶 | 劇薬, 処方箋医薬品注) |
1. 警告
1.1 本剤は骨髄抑制性が強いため、投与に際しては緊急時に十分な措置のできる設備の整った医療施設及びがん化学療法に十分な経験を持つ医師のもとで、本剤の投与が適切と判断される症例についてのみ投与し、下記の患者には投与しないなど適応患者の選択を慎重に行うこと。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。[2.1-2.3、9.1.1、9.5、11.1.1参照]
・重篤な骨髄抑制のある患者
・重篤な感染症を合併している患者
・妊婦又は妊娠している可能性のある患者
・本剤の成分に対し過敏症の既往歴のある患者
1.2 本剤を含む小児悪性固形腫瘍に対するがん化学療法は、小児のがん化学療法に十分な知識・経験を持つ医師のもとで実施すること。
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
5. 効能または効果に関連する注意
<がん化学療法後に増悪した卵巣癌>
5.1 本剤を投与する場合には、白金製剤を含む化学療法施行後の症例を対象とし、白金製剤に対する感受性を考慮して本剤以外の治療法を慎重に検討した上で、本剤の投与を開始すること。
<進行又は再発の子宮頸癌>
6. 用法及び用量
(1)小細胞肺癌については、ノギテカンとして、通常、成人に1日1回、1.0mg/m2(体表面積)を5日間連日点滴静注し、少なくとも16日間休薬する。
これを1コースとして、投与を繰り返す。
なお、患者の状態により適宜増減する。
これを1コースとして、投与を繰り返す。
なお、患者の状態により適宜増減する。
(2)がん化学療法後に増悪した卵巣癌については、ノギテカンとして、通常、成人に1日1回、1.5mg/m2(体表面積)を5日間連日点滴静注し、少なくとも16日間休薬する。
これを1コースとして、投与を繰り返す。
なお、患者の状態により適宜減量する。
これを1コースとして、投与を繰り返す。
なお、患者の状態により適宜減量する。
(3)小児悪性固形腫瘍については、他の抗悪性腫瘍剤との併用でノギテカンとして、1日1回、0.75mg/m2(体表面積)を5日間連日点滴静注し、少なくとも16日間休薬する。
これを1コースとして、投与を繰り返す。
なお、患者の状態により適宜減量する。
これを1コースとして、投与を繰り返す。
なお、患者の状態により適宜減量する。
(4)進行又は再発の子宮頸癌については、シスプラチンとの併用で、ノギテカンとして、通常、成人に1日1回、0.75mg/m2(体表面積)を3日間連日点滴静注し、少なくとも18日間休薬する。
これを1コースとして、投与を繰り返す。
なお、患者の状態により適宜減量する。
これを1コースとして、投与を繰り返す。
なお、患者の状態により適宜減量する。
(5)本剤投与時、100mLの生理食塩液に混和し、30分かけて点滴静注する。
7. 用法及び用量に関連する注意
<効能共通>
<小細胞肺癌>
<がん化学療法後に増悪した卵巣癌>
<進行又は再発の子宮頸癌>
8. 重要な基本的注意
8.1 骨髄抑制による重篤な副作用(感染症、出血傾向)が起こるおそれがあるので、頻回に臨床検査(血液検査、腎機能検査等)を行うなど、患者の状態を十分に観察すること。なお、各コースの投与開始にあたっては、骨髄機能が保持又は回復したことを確認のうえ投与すること。また、骨髄抑制が強くあらわれ、遷延性に推移することがあるので、投与は慎重に行うこと。[7.2-7.4、9.1.1、11.1.1、17.1.2参照]
8.2 悪心・嘔吐、食欲不振等の消化器症状があらわれることがあるので、患者の状態を十分に観察し、適切な処置を行うこと。
8.3 易疲労感が発現した場合には、自動車の運転又は機械の操作に注意させること。
8.4 卵巣癌に本剤を使用する際には、関連文献(「医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:ノギテカン塩酸塩(卵巣癌)」等)を熟読すること。
8.5 小児悪性固形腫瘍に本剤を使用する際には、関連文献(「医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:ノギテカン塩酸塩(小児悪性固形腫瘍)」等)を熟読すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨髄抑制のある患者(重篤な骨髄抑制のある患者は除く)
9.1.2 間質性肺炎、放射線肺炎、肺線維症の既往歴又は合併症のある患者
間質性肺炎等が増悪することがある。[11.1.3参照]
9.1.3 全身衰弱が著しい患者
副作用が強くあらわれるおそれがある。
9.2 腎機能障害患者
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性には、本剤投与中及び投与終了後一定期間は適切な避妊をするよう指導すること。[9.5参照]
9.4.2 パートナーが妊娠する可能性のある男性には、本剤投与中及び投与終了後一定期間は適切な避妊をするよう指導すること。[15.2.2参照]
9.4.3 小児及び生殖可能な年齢の患者に投与する必要がある場合には性腺に対する影響を考慮すること。
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。動物実験(ラット)を用いた試験において、乳汁中への移行が報告されている。
9.7 小児等
<小児悪性固形腫瘍>
9.7.1 幼児又は小児に投与する場合には、副作用の発現に特に注意し、慎重に投与すること。
9.7.2 低出生体重児、新生児又は乳児に対する臨床試験は実施していない。
<小児悪性固形腫瘍以外>
9.7.3 小児等を対象とした臨床試験は実施していない。
9.8 高齢者
異常が認められた場合には、回復を十分に確認してから投与を行うなど、投与間隔及び用量に留意し、頻回に臨床検査(血液検査、腎機能検査等)を行うなどして慎重に投与すること。本剤は主として腎臓から排泄されるが、一般的に高齢者では腎機能が低下していることが多く、排泄が遅れることにより血液毒性等が増強するおそれがある。
10. 相互作用
10.2 併用注意
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 骨髄抑制
11.1.2 消化管出血(下血も含む:1.3%)
血小板減少を伴った消化管出血による死亡例が報告されている。
11.1.3 間質性肺炎(頻度不明)[9.1.2参照]
11.1.4 肺塞栓症、深部静脈血栓症(頻度不明)
11.1.5 高度な下痢、腸管穿孔、腸閉塞(頻度不明)
注)重大な副作用及びその他の副作用の頻度は、各種固形癌に対する前期第II相試験(019試験)における小細胞肺癌症例、小細胞肺癌に対する後期第II相試験(020試験、021試験)、卵巣癌に対する第I相試験(101試験)及び第II相試験(231試験)、及び進行又は再発の子宮頸癌に対する国内第I相試験(202試験)に基づき算出した。
11.2 その他の副作用
| 20%以上 | 5〜20%未満 | 5%未満 | 頻度不明 | |
| 消化器 | 悪心・嘔吐(62.8%)、食欲不振(64.1%) | 口内炎、下痢、便秘、腹痛 | 胃炎 | イレウス、呼気臭、口内乾燥、鼓腸、歯肉出血、舌変色、舌障害、直腸しぶり |
| 肝臓 | ALT上昇 | AST上昇、Al-P上昇 | 総ビリルビン上昇 | 肝機能障害 |
| 腎臓 | BUN上昇、尿糖、尿蛋白、尿沈渣 | 尿ウロビリノーゲン、血尿 | 排尿異常、腎機能障害、アルブミン尿、出血性膀胱炎、膿尿 | |
| 皮膚 | 脱毛 | 爪の障害 | 多汗症 | |
| 過敏症 | 発疹、そう痒症、蕁麻疹 | |||
| 全身症状 | 発熱、易疲労感 | 体重減少、状態悪化、頭痛、倦怠感、疼痛(筋肉痛、関節痛、背部痛、腰痛、四肢痛等) | 注射部位反応、浮腫、悪寒 | 無力症、インフルエンザ様疾患、口渇 |
| 精神神経系 | 味覚異常 | めまい、末梢性ニューロパチー、耳鳴、感覚鈍麻、不安 | 傾眠、回転性めまい、痙攣、錯感覚、不全麻痺、失神、異常な夢、うつ病、神経過敏 | |
| 循環器 | 頻脈 | 不整脈、低血圧、心房細動、心不全、チアノーゼ、循環虚脱、表在性静脈炎、心電図異常 | ||
| その他 | ナトリウム減少、総蛋白減少、アルブミン減少 | LDH上昇、カリウム増加、クロール減少、カルシウム減少、カリウム減少、クレアチニン上昇 | ナトリウム増加、静脈炎、感染症、胸痛、口腔咽頭痛、咳嗽、呼吸困難、脱水 | LDH下降、クロール増加、鼻出血、咽頭炎、喘息、結膜炎、視力障害、アルブミン・グロブリン比異常、尿検査異常、アシドーシス、骨痛、筋痙縮、外陰部障害、性器分泌物、グロブリン増加、血中マグネシウム減少、血中リン減少 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は細胞毒性を有するため、調製時には防護具(眼鏡、手袋、マスク等)を着用すること。薬液が皮膚に付着した場合には、直ちに石鹸及び多量の流水で洗い流すこと。また、粘膜に付着した場合には多量の流水で洗い流すこと。
14.1.2 患者の体表面積から換算した投与量に対応する必要量を注射筒で抜き取り、100mLの生理食塩液と混和して使用すること。
14.2 薬剤投与時の注意
静脈内投与に際し、薬液が血管外に漏れると、注射部位に炎症反応をおこすことがあるので、薬液が血管外に漏れないように投与すること。
15. その他の注意
15.1 臨床使用に基づく情報
15.2 非臨床試験に基づく情報
15.2.1 がん原性試験は実施していないが、染色体異常試験、遺伝子突然変異試験及び小核試験の遺伝毒性試験において、いずれも陽性の結果が報告されており、がん原性を有する可能性がある。
15.2.2 ヒトリンパ球を用いた染色体異常試験、マウスリンパ腫細胞を用いた遺伝子突然変異試験及びマウスを用いた小核試験において、遺伝毒性が報告されている。[9.4.2参照]
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
各種悪性腫瘍患者に、本剤5.0〜22.5mg/m2注)を単回点滴静脈内投与した時の血漿中濃度は、点滴終了時にCmaxとなり、以降二相性に減少し、最終消失相のT1/2は3〜5時間であった。Cmax及びAUC0-tは用量増加に伴って上昇した2)。
16.1.2 反復投与
各種悪性腫瘍患者に、本剤1.0〜1.5mg/m2/日を5日間連日点滴静脈内投与した時の5日目のCmax、AUC0-t、T1/2及びCLpには反復投与による明らかな変化は認められなかった2)。
本剤1.0mg/m2/日を5日間連日静脈投与したときの血漿中ノギテカン濃度
| 投与日 | 投与量(mg/m2/日) | 患者数 | Cmax(ng/mL) | AUC0-t(ng・hr/mL) | T1/2(hr) | CLp(L/hr) |
| 1日目 | 1.0 | 2 | 58.27 | 56.79 | 2.34 | 23.46 |
| 1.2 | 5 | 36.98±20.46 | 46.91±16.98 | 2.69±1.07 | 42.74±21.54 | |
| 1.5 | 4 | 86.12±67.62 | 84.23±29.53 | 2.51±0.99 | 29.34±14.17 | |
| 5日目 | 1.0 | 2 | 47.13 | 70.43 | 3.28 | 21.84 |
| 1.2 | 5 | 34.35±17.84 | 54.65±24.01 | 4.25±2.87 | 35.68±12.45 | |
| 1.5 | 3 | 39.51±21.20 | 84.82±75.00 | 3.63±2.26 | 40.32±26.64 |
16.3 分布
ヒト血漿蛋白結合率は31.4〜39.7%と低く、また血球分配率は35.9〜59.9%であった3)。
ラットに14C標識体を反復静脈内投与した時の放射能は、中枢神経系を除く各組織に速やかに移行し、特に肝臓、腎臓、膵臓及び副腎での濃度が高値を示した。最終投与終了168時間後においても、甲状腺/上皮小体で比較的高い濃度が確認されたが、いずれの組織においても蓄積は示唆されなかった4)。
16.4 代謝
本剤1.5mg/m2単回投与時の代謝物として、N-脱メチル体の生成が確認されたが、ノギテカンに対するAUC比は2.5%と小さかった(海外データ)5)。本剤のヒト肝各P450分子種(CYP3A4、CYP2C19、CYP2D6等)、ヒト肝ジヒドロピリミジン脱水素酵素及びキサンチン酸化酵素のいずれに対しても阻害作用はみられなかった(in vitro)6)。
動物(ラット・イヌ)に14C標識体を静脈内投与した時の代謝物を検討した結果、血漿及び尿・糞中には主にノギテカンが確認された7)。
16.5 排泄
各種悪性腫瘍患者に、5.0〜22.5mg/m2注)を単回点滴静脈内投与した時の尿中排泄率は、投与24時間後までに投与量の40〜60%であった。また、1.0〜1.5mg/m2/日を5日間連日点滴静脈内投与した時には、1日目及び5日目とも投与24時間後までに投与量の60%程度であったことから、主排泄経路は尿中排泄と考えられた2)。
また、動物(マウス)にノギテカン塩酸塩又はその開環体とプロベネシドを併用投与した際の総ノギテカンの腎クリアランスが単独投与に比べて減少(それぞれ約44及び71%)したことから、総ノギテカンの腎排泄には陰イオン輸送系による尿細管分泌機構が関与していることが推察された8)。[10.2参照]
また、動物(マウス)にノギテカン塩酸塩又はその開環体とプロベネシドを併用投与した際の総ノギテカンの腎クリアランスが単独投与に比べて減少(それぞれ約44及び71%)したことから、総ノギテカンの腎排泄には陰イオン輸送系による尿細管分泌機構が関与していることが推察された8)。[10.2参照]
注)本剤の承認最大用量は1.5mg/m2/日である。
16.6 特定の背景を有する患者
16.6.1 腎機能低下患者
海外の腎機能低下患者での検討において、軽度の腎機能低下患者(クレアチニンクリアランス(CLcr)値43〜59mL/分)の総ノギテカン及びノギテカンの血漿クリアランス(CLp)は、腎機能正常患者と比較して32.5及び39.3%低下し、血中半減期(T1/2)は23.1及び54.0%延長し、ノギテカンの尿中排泄率は43.7%低下した。中等度の腎機能低下患者(CLcr値が21.8〜38mL/分)では同様にCLpが65.0及び72.6%低下し、T1/2が101.2及び117.1%延長した。また、軽度の腎機能低下者では1.5mg/m2、中等度の腎機能低下者では0.75mg/m2を投与した時には耐容可能であった9)。
以上のことから、海外ではCLcrが40mL/分以上の腎機能低下患者では減量の必要はないが、CLcr20〜39mL/分の腎機能低下患者では通常用量(1.5mg/m2/日)の半量(0.75mg/m2/日)投与を推奨している。[7.1、9.2参照]
以上のことから、海外ではCLcrが40mL/分以上の腎機能低下患者では減量の必要はないが、CLcr20〜39mL/分の腎機能低下患者では通常用量(1.5mg/m2/日)の半量(0.75mg/m2/日)投与を推奨している。[7.1、9.2参照]
17. 臨床成績
17.1 有効性及び安全性に関する試験
<小細胞肺癌>
17.1.1 国内前期第II相試験(019試験)
本剤を初回用量1.0mg/m2/日又は1.2mg/m2/日の5日間連日投与と投与終了後16日間の休薬をもって1コースとして、抗腫瘍効果と安全性を検討した。小細胞肺癌における適格例21例に対する奏効率は28.6%(6/21例)であった。
主な副作用は、白血球減少100%(21/21例)、好中球減少100%(20/20例)、赤血球減少90.5%(19/21例)、ヘモグロビン減少90.5%(19/21例)等の臨床検査値異常と、食欲不振66.7%(14/21例)、悪心・嘔吐52.4%(11/21例)、発熱23.8%(5/21例)等の自他覚症状であった10)。
主な副作用は、白血球減少100%(21/21例)、好中球減少100%(20/20例)、赤血球減少90.5%(19/21例)、ヘモグロビン減少90.5%(19/21例)等の臨床検査値異常と、食欲不振66.7%(14/21例)、悪心・嘔吐52.4%(11/21例)、発熱23.8%(5/21例)等の自他覚症状であった10)。
17.1.2 国内後期第II相試験(020試験、021試験)
小細胞肺癌の既治療症例を対象とし、本剤を初回用量1.0mg/m2/日を5日間連日投与と投与終了後16日間の休薬をもって1コースとして、抗腫瘍効果と安全性を検討した。適格例103例における奏効率は23.3%(24/103例)であった。
主な副作用は、白血球減少100%(96/96例)、好中球減少99.0%(95/96例)、赤血球減少97.9%(93/95例)、ヘモグロビン減少90.6%(87/96例)等の臨床検査値異常と、食欲不振60.4%(58/96例)、悪心・嘔吐59.4%(57/96例)、発熱36.5%(35/96例)等の自他覚症状であった。
また、G-CSF投与、輸液等の処置が行われなかったコースにおける白血球数、好中球数、血小板数、ヘモグロビン値の最低値、最低値までの到達日数、グレード1以上(ヘモグロビン値はグレード2以上)に減少したコース数、並びに投与開始からそれぞれ4,000/mm3以上、2,000/mm3以上、10万/mm3以上、9.5g/dl以上に回復したコース数と日数を以下に示す11)。[7.2、8.1参照]
主な副作用は、白血球減少100%(96/96例)、好中球減少99.0%(95/96例)、赤血球減少97.9%(93/95例)、ヘモグロビン減少90.6%(87/96例)等の臨床検査値異常と、食欲不振60.4%(58/96例)、悪心・嘔吐59.4%(57/96例)、発熱36.5%(35/96例)等の自他覚症状であった。
また、G-CSF投与、輸液等の処置が行われなかったコースにおける白血球数、好中球数、血小板数、ヘモグロビン値の最低値、最低値までの到達日数、グレード1以上(ヘモグロビン値はグレード2以上)に減少したコース数、並びに投与開始からそれぞれ4,000/mm3以上、2,000/mm3以上、10万/mm3以上、9.5g/dl以上に回復したコース数と日数を以下に示す11)。[7.2、8.1参照]
| 白血球数 | |||||
| G-CSF非使用評価コース数 | 最低値注1)(/mm3) | 発現コース数 | 回復 | ||
| 到達日数 | コース数 | 日数注2) | |||
| 116 | 2600(1500〜4600) | 11 | 105 | 96 | 21 |
| 好中球数 | |||||
| G-CSF非使用評価コース数 | 最低値注1)(/mm3) | 発現コース数 | 回復 | ||
| 到達日数 | コース数 | 日数注2) | |||
| 116 | 1057.2(187.2〜3459.2) | 13 | 109 | 80 | 21 |
| 血小板数 | |||||
| 非処置評価コース数 | 最低値注1)(×104/mm3) | 発現コース数 | 回復 | ||
| 到達日数 | コース数 | 日数注3) | |||
| 269 | 9.3(1.0〜40.7) | 14 | 144 | 144 | 19 |
| ヘモグロビン値 | |||||
| 非処置評価コース数 | 最低値注1)(g/dL) | 発現コース数 | 回復 | ||
| 到達日数 | コース数 | 日数注3) | |||
| 260 | 9.0(5.8〜14.5) | 14 | 157 | 89 | 21 |
注1)中央値(範囲)
注2)投与開始から白血球数は4,000/mm3以上、好中球数は2,000/mm3以上までの日数
注3)投与開始から血小板数は10万/mm3以上、ヘモグロビン値は9.5g/dL以上までの日数、血小板数10万/mm3、ヘモグロビン値9.5g/dL未満に減少したコース数を発現コースとした。
本邦の小細胞肺癌の後期第II相試験(020試験、021試験)では、初回投与量1.0mg/m2/日より開始した。各コースの投与開始前及び用量の変更は以下の規定に従った。
<投与開始前の規定>
・初回投与時
投与前の臨床検査で白血球数4,000/mm3以上12,000/mm3以下、血小板数10万/mm3以上、ヘモグロビン値9.5g/dL以上の骨髄機能が保持されている。
・次コース以降の投与時
白血球数4,000/mm3以上、血小板数10万/mm3以上に回復したことが確認されている。
<用量の変更に関する規定>
・投与後、白血球数の最低値が1,000/mm3未満、又は血小板数の最低値が3万/mm3未満となった場合には、次コースの投与量を0.8mg/m2/日に減量する。
・投与後、白血球数の最低値が2,000/mm3以上及び血小板数の最低値が5万/mm3以上の場合には、次コースの投与量を1.2mg/m2/日に増量できる。
<がん化学療法後に増悪した卵巣癌>
17.1.3 国内第I相試験(101試験)
再発卵巣癌患者(6例)を対象に、本剤1.5mg/m2の5日間連日投与を3週間毎に繰り返した。有効性はPR(1/4例)、SD(3/4例)であった。
主な副作用は白血球数減少100%(6/6例)、好中球数減少100%(6/6例)、ヘモグロビン減少100%(6/6例)、赤血球数減少100%(6/6例)の臨床検査値異常と、悪心100%(6/6例)、食欲減退100%(6/6例)、脱毛症100%(6/6例)、下痢66.7%(4/6例)の自他覚症状であった。
主な副作用は白血球数減少100%(6/6例)、好中球数減少100%(6/6例)、ヘモグロビン減少100%(6/6例)、赤血球数減少100%(6/6例)の臨床検査値異常と、悪心100%(6/6例)、食欲減退100%(6/6例)、脱毛症100%(6/6例)、下痢66.7%(4/6例)の自他覚症状であった。
17.1.4 国内第II相試験(231試験)
再発卵巣癌患者(19例)を対象に、本剤1.5mg/m2の5日間連日投与を3週間毎に繰り返した。有効性はSD(8/11例)、PD(3/11例)であった。
主な副作用は白血球数減少100%(18/18例)、好中球数減少94.4%(17/18例)、ヘモグロビン減少100%(18/18例)、赤血球数減少100%(18/18例)の臨床検査値異常と、悪心61.1%(11/18例)、疲労61.1%(11/18例)、食欲減退55.6%(10/18例)の自他覚症状であった。
主な副作用は白血球数減少100%(18/18例)、好中球数減少94.4%(17/18例)、ヘモグロビン減少100%(18/18例)、赤血球数減少100%(18/18例)の臨床検査値異常と、悪心61.1%(11/18例)、疲労61.1%(11/18例)、食欲減退55.6%(10/18例)の自他覚症状であった。
<進行又は再発の子宮頸癌>
17.1.5 国内第I相試験(202試験)
根治的治療(手術又は放射線療法)の適応とならない進行又は再発の子宮頸癌(15例)を対象に本剤とシスプラチンとの併用投与注4)の実施医療機関判定によるRECIST ver1.1基準に基づく奏効率は27.3%(3/11例)[95%信頼区間:6.0,61.0]であった。
主な副作用は、白血球数減少100%(15/15例)、好中球数減少100%(15/15例)、ヘモグロビン減少100%(15/15例)、赤血球数減少93.3%(14/15例)の臨床検査値異常と、悪心86.7%(13/15例)、倦怠感86.7%(13/15例)、食欲減退80.0%(12/15例)、脱毛症60.0%(9/15例)の自他覚症状であった11)。[5.2、7.4参照]
主な副作用は、白血球数減少100%(15/15例)、好中球数減少100%(15/15例)、ヘモグロビン減少100%(15/15例)、赤血球数減少93.3%(14/15例)の臨床検査値異常と、悪心86.7%(13/15例)、倦怠感86.7%(13/15例)、食欲減退80.0%(12/15例)、脱毛症60.0%(9/15例)の自他覚症状であった11)。[5.2、7.4参照]
17.1.6 海外第III相試験(GOG-179試験)
根治的治療(手術又は放射線療法)の適応とならない進行又は再発の子宮頸癌を対象としたシスプラチン単独投与注5)及び本剤とシスプラチンとの併用投与注4)の成績は次表のとおりであった。
| 症例数 | 全生存期間中央値(カ月) [95%信頼区間] | ハザード比 [95%信頼区間] | p値 | |
| シスプラチン単独投与 | 146 | 6.5 [5.8,8.8] | 0.762 [0.593,0.979] | 0.033注6) |
| 本剤とシスプラチンとの併用投与 | 147 | 9.4 [7.9,11.9] |
本剤とシスプラチンとの併用投与群の安全解析対象データ140例における主な有害事象は、ヘモグロビン減少93.6%(131/140例)、白血球数減少91.4%(128/140例)の臨床検査値異常と全身症状68.6%(96/140例)、消化管系(その他)62.9%(88/140例)の自他覚症状であった12)。[5.2、7.4参照]
注4)本剤0.75mg/m2(体表面積)を第1、2、3日に、シスプラチン50mg/m2(体表面積)を第1日に投与することを21日毎に繰り返す。
注5)シスプラチン50mg/m2(体表面積)を第1日に投与することを21日毎に繰り返す。
注6)log-rank検定。
18. 薬効薬理
18.1 作用機序
DNAと複合体を形成したI型トポイソメラーゼに選択的に結合し、その構造を安定化させ、DNA超ラセン構造の弛緩阻害とDNAの断片化を引き起こし細胞死を誘導する13)。
18.2 抗腫瘍作用
ノギテカン塩酸塩は、マウス腫瘍株及びヒト腫瘍株において広い抗腫瘍スペクトラムを有し、小細胞肺癌に対し高感受性を示した。また、ヒト小細胞肺癌株(DMS273及びDMS114)移植モデルにおいて抗腫瘍効果を示した。なお、抗腫瘍効果は濃度及び処理時間に依存した。
また、P388白血病細胞由来のドキソルビシン耐性株、ダウノルビシン耐性株、ミトキサントロン耐性株又はアムサイクリン耐性株移植モデルにおいて抗腫瘍効果が認められ、ヒト摘出腫瘍を用いた試験では、ドキソルビシン、フルオロウラシル、シクロホスファミド及びエトポシド無効例に対し細胞増殖抑制作用を示した(in vitro)14)。
また、P388白血病細胞由来のドキソルビシン耐性株、ダウノルビシン耐性株、ミトキサントロン耐性株又はアムサイクリン耐性株移植モデルにおいて抗腫瘍効果が認められ、ヒト摘出腫瘍を用いた試験では、ドキソルビシン、フルオロウラシル、シクロホスファミド及びエトポシド無効例に対し細胞増殖抑制作用を示した(in vitro)14)。
19. 有効成分に関する理化学的知見
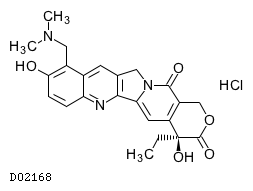
19.1. ノギテカン塩酸塩
20. 取扱い上の注意
外箱開封後は遮光して保存すること。
22. 包装
1mL[1バイアル]
23. 主要文献
- Rowinsky EK,et al., J Clin Oncol., 14, 3074-3084, (1996) »PubMed
- Kobayashi K,et al., Int J Clin Oncol., 7, 177-186, (2002) »PubMed
- 血漿タンパク結合率、血球分配率(2000年12月22日承認、申請資料概要ヘ.2-2-5、2-2-6)
- 組織内濃度(2000年12月22日承認、申請資料概要ヘ.2-2-1(3))
- 単回投与後の生物学的利用率及び代謝物の検討(2000年12月22日承認、申請資料概要ヘ.3-2-2)
- 肝薬物代謝酵素系に対する作用(2000年12月22日承認、申請資料概要ヘ.2-3-4(2)(3))
- 血漿,胆汁及び尿糞中代謝物(2000年12月22日承認、申請資料概要ヘ.2-3-2(1))
- Zamboni WC,et al., J Pharmacol Exp Ther., 284, 89-94, (1998) »PubMed
- O'Reilly S,et al, J Clin Oncol., 14, 3062-3073, (1996) »PubMed
- 前期第II相臨床試験(019試験)(2000年12月22日承認、申請資料概要ト.2)
- 後期第II相臨床試験(020試験、021試験)(2000年12月22日承認、申請資料概要ト.3)
- 海外第III相試験(GOG-179試験)(2015年11月20日承認、審査報告書)
- 非臨床試験における特徴及び有用性(2000年12月22日承認、申請資料概要イ.2-1-1)
- Burris HA III,et al., J Natl Cancer Inst., 84, 1816-1820, (1992)
24. 文献請求先及び問い合わせ先
文献請求先
日本化薬株式会社
医薬品情報センター
〒100-0005
東京都千代田区丸の内二丁目1番1号
電話:0120-505-282
製品情報問い合わせ先
日本化薬株式会社
医薬品情報センター
〒100-0005
東京都千代田区丸の内二丁目1番1号
電話:0120-505-282
26. 製造販売業者等
26.1 製造販売元
日本化薬株式会社
東京都千代田区丸の内二丁目1番1号