医薬品情報
| 総称名 | ワイキャンス |
|---|---|
| 一般名 | カンタリジン |
| 欧文一般名 | Cantharidin |
| 製剤名 | カンタリジン外用液剤 |
| 薬効分類名 | ウイルス性疣贅治療剤 |
| 薬効分類番号 | 2649 |
| KEGG DRUG |
D11745
カンタリジン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年11月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ワイキャンス外用液0.71% | Ycanth topical solution 0.71% | 鳥居薬品 | 2649736Q1025 | 14995.6円/管 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
伝染性軟属腫
6. 用法及び用量
通常、成人及び2歳以上の小児に、3週間に1回、患部に適量を塗布する。塗布16〜24時間後に、石鹸を用いて水で洗い流す。
7. 用法及び用量に関連する注意
本剤の8回の投与までに治療反応が得られない場合は、他の治療法を考慮すること。8回を超える投与経験はない。
8. 重要な基本的注意
塗布部位において激しい痛み等が発現した場合、塗布16〜24時間後より前でも、石鹸を用いて水で洗い流して本剤を除去し、直ちに医師等に相談するよう患者等に指導すること。
9. 特定の背景を有する患者に関する注意
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。生殖発生毒性試験は実施していない。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤塗布後のヒト母乳中への移行は不明である。
9.7 小児等
低出生体重児、新生児、乳児又は2歳未満の幼児を対象とした臨床試験は実施していない。
11. 副作用
11.2 その他の副作用
| 10%以上 | 1〜10%未満 | 1%未満 | |
| 皮膚及び皮下組織障害 | 適用部位小水疱(95.7%)、適用部位痂皮(90.2%)、適用部位紅斑(87.9%)、適用部位そう痒感(70.3%)、適用部位びらん(62.5%)、適用部位変色(55.9%)、適用部位皮膚剥脱(35.5%) | 適用部位乾燥、適用部位瘢痕、適用部位潰瘍、適用部位湿疹、接触皮膚炎 | 適用部位丘疹、水疱性皮膚炎、痂皮、皮膚色素過剰、紅斑 |
| 傷害、中毒及び処置合併症 | 適用部位疼痛(79.7%)、適用部位浮腫(22.7%) | 適用部位腫脹 | |
| 感染症及び寄生虫症 | 化膿、膿痂疹、皮膚感染、細菌感染、膿痂疹性湿疹 | ||
| その他 | 発熱、性器水疱 |
14. 適用上の注意
14.1 薬剤投与前の注意
本剤を初めて使用する際は、患部への投与手技を理解した上で使用を開始すること。
14.2 薬剤調製時の注意
アプリケータ内のアンプルを破砕する際には、付属のブレイクツールを使用すること。
14.3 薬剤投与時の注意
14.3.1 本剤は患部にのみ塗布すること。周囲の正常な皮膚に付着した薬剤は直ちに拭き取ること。
14.3.2 眼、眼の周囲、粘膜に使用しないこと。眼に入った場合は直ちに水で洗い流し、15分以上洗浄すること。
14.3.3 本剤を塗布後、塗布部位を乾燥させること。
14.3.4 1本のアプリケータを複数の患者に使用しないこと。また、残液は廃棄すること。
14.4 薬剤投与後の注意
患者等に対し以下の点に注意するよう指導すること。
・本剤は塗布16〜24時間後に、石鹸を用いて水で洗い流すこと。
・塗布後本剤を洗い流すまで、本剤を塗布した皮膚に触れたり、舐めたり、噛んだりしないこと。誤って口に入れた場合には直ちに医師等に相談すること。
・塗布後本剤を洗い流すまで、本剤を塗布した皮膚にクリーム、ローション等を塗布しないこと。
16. 薬物動態
16.1 血中濃度
2〜15歳の日本人小児伝染性軟属腫患者を対象に、本剤の初回塗布前、塗布2時間後及び24時間後における血漿中薬物濃度を測定した。初回塗布2時間後に16例のうち2例で定量下限(2.5ng/mL)を上回る血漿中カンタリジン濃度が検出されたが、24時間後では定量下限未満であった。その他の14例では定量下限未満であった1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相臨床試験(208-3-1試験)
2歳以上の日本人伝染性軟属腫患者を対象に、プラセボを対照とした無作為化二重盲検並行群間比較試験を実施した。本剤又はプラセボを、3週間に1回、最大4回(本剤はプラセボ対照期終了後を含めて最大8回)塗布した。主要評価項目である、治験薬の塗布開始12週時における、すべての治療可能な伝染性軟属腫病変(治験薬塗布開始前及び塗布開始日以降、新たに発現した治療可能な病変)の完全消失が認められた患者の割合は、本剤投与群で50.0%(74/148例)[95%CI:41.68,58.32]、プラセボ投与群で23.2%(36/155例)[95%CI:16.83,30.68]であり、プラセボ投与群と比較して統計学的に有意な差が示された(p<0.001、有意水準両側5%、カイ二乗検定)2)。
本剤投与12週時までの副作用発現頻度は、本剤群で99.3%(147/148例)であった。主な副作用は、適用部位小水疱(98.0%)、適用部位痂皮(93.2%)、適用部位紅斑(89.9%)、適用部位疼痛(86.5%)、適用部位そう痒感(77.0%)、適用部位びらん(64.2%)及び適用部位変色(60.1%)であった2)。
本剤投与12週時までの副作用発現頻度は、本剤群で99.3%(147/148例)であった。主な副作用は、適用部位小水疱(98.0%)、適用部位痂皮(93.2%)、適用部位紅斑(89.9%)、適用部位疼痛(86.5%)、適用部位そう痒感(77.0%)、適用部位びらん(64.2%)及び適用部位変色(60.1%)であった2)。
18. 薬効薬理
18.1 作用機序
本剤の作用機序は明確でない。塗布された部位において、中性セリンプロテアーゼの活性化を介して、表皮のデスモソームを脆弱化し、表皮構造を破壊することで、塗布部位に水疱を形成する3)。水疱の形成により病巣皮膚が剥がれ落ち、その結果、ウイルス感染組織が除去されると考えられている。さらに、水疱形成による局所での炎症反応、免疫応答の促進が、病変の消失に寄与すると推察される。
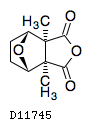
19. 有効成分に関する理化学的知見
19.1. カンタリジン
20. 取扱い上の注意
20.1 外箱開封後は遮光して保存すること。
20.2 本剤は可燃性であるため、保存及び使用の際には火気を避けること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
アンプルアプリケータ0.45mL×5本(ブレイクツール1本添付)
23. 主要文献
- 社内資料:日本人小児伝染性軟属腫患者を対象とした国内第I相臨床試験(208-1-1試験)(2025年9月19日承認、CTD2.7.6.1)
- 社内資料:日本人伝染性軟属腫患者を対象とした国内第III相臨床試験(208-3-1試験)(2025年9月19日承認、CTD2.7.6.3)
- Bertaux B et al., Br J Dermatol., 118 (2), 157-165, (1988)
24. 文献請求先及び問い合わせ先
文献請求先
鳥居薬品株式会社
お客様相談室
〒103-8439
東京都中央区日本橋本町3-4-1
電話:0120-316-834
FAX:03-3231-6890
製品情報問い合わせ先
鳥居薬品株式会社
お客様相談室
〒103-8439
東京都中央区日本橋本町3-4-1
電話:0120-316-834
FAX:03-3231-6890
25. 保険給付上の注意
本剤は新医薬品であるため、厚生労働省告示第107号(平成18年3月6日付)に基づき、2026年11月末日までは、投薬は1回14日分を限度とされている。
26. 製造販売業者等
26.1 製造販売元
鳥居薬品株式会社
東京都中央区日本橋本町3-4-1