医薬品情報
| 総称名 | アバレプト |
|---|---|
| 一般名 | モツギバトレプ |
| 欧文一般名 | Motugivatrep |
| 製剤名 | モツギバトレプ懸濁性点眼液 |
| 薬効分類名 | ドライアイ治療剤(TRPV1※拮抗薬) ※Transient receptor potential cation channel subfamily V member 1 |
| 薬効分類番号 | 1319 |
| KEGG DRUG |
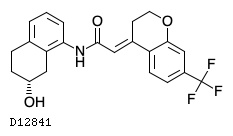
D12841
モツギバトレプ
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 作成(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アバレプト懸濁性点眼液0.3% | AVAREPT OPHTHALMIC SUSPENSION 0.3% | 千寿製薬 | 13197D6Q1029 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
6. 用法及び用量
通常、1回1滴、1日4回点眼する。
8. 重要な基本的注意
8.1 本剤の点眼後、一時的に目がかすむことがあるので、機械類の操作や自動車等の運転には注意させること。
9. 特定の背景を有する患者に関する注意
9.3 肝機能障害患者
肝機能障害のある患者に本剤を投与した場合の薬物動態は検討されていない。[16.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
9.7.1 小児等を対象とした臨床試験は実施していない。
9.8 高齢者
11. 副作用
11.2 その他の副作用
| 1〜5%未満 | 0.1〜1%未満 | 頻度不明 | |
| 眼 | 眼部冷感、霧視 | アレルギー性結膜炎、角膜びらん、眼そう痒症、眼の異常感、眼の異物感、眼部不快感、流涙増加 | 眼部熱感 |
| 消化器 | 口の錯感覚 | ||
| 呼吸器 | アレルギー性鼻炎 | ||
| その他 | 冷感 | 温度覚鈍麻、体温上昇、熱感、異常感覚、ほてり |
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・使用時、キャップを閉じたままよく振ってからキャップを開けて点眼すること。
・薬液汚染防止のため、点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜嚢内に点眼し、1〜5分間閉瞼して涙嚢部を圧迫させた後、開瞼すること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
・本剤は、保管の仕方によっては振り混ぜても粒子が分散しにくくなる場合があるので、開栓前までは上向きに保管すること。
15. その他の注意
15.1 臨床使用に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
ドライアイ患者の両眼に0.03%、0.1%、0.3%又は1%モツギバトレプ懸濁性点眼液注)を1滴ずつ単回点眼したとき(各コホート順に6、6、5及び4例)、血漿中モツギバトレプ濃度は投与後3〜12時間で最高濃度に達し、その後緩やかに低下又は同程度の濃度で推移した。Cmax及びAUC0-lastは、概ね用量依存的に増加し、0.3%モツギバトレプ懸濁性点眼液を点眼したときのCmax及びAUC0-lastの平均値はそれぞれ0.102ng/mL及び0.854ng・h/mLであった3)(外国人データ)。
16.1.2 反復投与
ドライアイ患者の両眼に0.3%又は1%モツギバトレプ懸濁性点眼液注)を1回1滴、1日4回、28日間反復点眼したとき、日本人(6例)と外国人(6例)で投与後2、4及び8日のCtroughに大きな差は認められなかった3)。
| Ctrough(ng/mL) | 0.3% | 1% | ||
| 日本人 (6例) | 外国人 (6例) | 日本人 (6例) | 外国人 (6例) | |
| 投与後2日 | 0.521±0.397 | 0.691±0.432 | 1.12±0.75 | 1.84±0.87 |
| 投与後4日 | 0.923±0.827 | 1.04±0.45 | 1.98±1.84 | 2.61±1.36 |
| 投与後8日 | 1.48±0.98 | 1.16±0.39 | 3.31±2.95 | 4.13±2.33 |
16.3 分布
16.4 代謝
ヒト肝細胞を用いた代謝反応において、主要代謝物は2種類の一水酸化体及び一水酸化ケトン体であると推定された6)(in vitro)。
16.5 排泄
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相比較試験
ドライアイ患者536例を対象にプラセボを対照とした無作為化二重遮蔽並行群間比較試験で、本剤又はプラセボを両眼に1回1滴、1日4回、8週間点眼した。その結果、主要評価項目である投与4週後のドライアイQOL質問票(DEQS)合計スコア注)のベースラインからの変化量で本剤群のプラセボ群に対する優越性が検証された8)。
| ベースラインからの変化量a) | プラセボ群との差a) p値a),b) | |
| 本剤群 (268例) | −16.76 [−18.40,−15.12] | −2.40 [−4.72,−0.07] p=0.0433 |
| プラセボ群 (267例) | −14.36 [−16.01,−12.72] |
本剤群の副作用は269例中15例(5.6%)に認められ、主な副作用は冷感6例(2.2%)、眼部冷感3例(1.1%)、霧視3例(1.1%)であった。
注)ドライアイQOL質問票(DEQS)は、目の症状、日常生活への影響に関する15項目の質問で構成される。総合的なQOL障害度は合計スコアで評価され、スコアが高いほど状態が悪いことを示す。
18. 薬効薬理
18.1 作用機序
18.2 TRPV1阻害作用
モツギバトレプはヒト及びラットTRPV1に対して阻害活性(IC50=0.6635nmol/L及び0.4588nmol/L)を示した12)(in vitro)。
18.3 瞬目回数増加の抑制作用
乾燥環境で誘発されるドライアイモデルラットの瞬目回数の増加を、モツギバトレプ懸濁液は単回点眼投与30分後に抑制し、その効果は0.1〜1.0%の範囲で用量依存的であった13)。
18.4 角膜上皮障害改善作用
0.3%モツギバトレプ懸濁液を1日4回、14日間点眼投与することでドライアイモデルラットの角膜上皮障害が改善した14)。
19. 有効成分に関する理化学的知見
19.1. モツギバトレプ
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
プラスチック点眼容器 5mL×10、5mL×50
23. 主要文献
- 社内資料:第I相経口投与試験(承認年月日:2025年12月22日、CTD2.7.6.5)
- Kort ME,et al., Prog Med Chem, 51, 57-70, (2012) »PubMed
- 社内資料:海外第I/II相試験(承認年月日:2025年12月22日、CTD2.7.2.2)
- 社内資料:ラットにおける単回経口投与後の全身分布(承認年月日:2025年12月22日、CTD2.6.4.4)
- 社内資料:血漿タンパク結合(承認年月日:2025年12月22日、CTD2.6.4.4)
- 社内資料:肝細胞を用いたin vitro代謝物検索(承認年月日:2025年12月22日、CTD2.6.4.1)
- 社内資料:ラット及びイヌにおける排泄(承認年月日:2025年12月22日、CTD2.6.4.6)
- 社内資料:国内第III相比較試験(承認年月日:2025年12月22日、CTD2.7.6.3)
- 社内資料:三叉神経節細胞に対する作用(承認年月日:2025年12月22日、CTD2.6.2.2)
- 社内資料:ヒト角膜上皮細胞に対する作用(承認年月日:2025年12月22日、CTD2.6.2.2)
- 社内資料:T細胞に対する作用(承認年月日:2025年12月22日、CTD2.6.2.2)
- 社内資料:ヒト及びラットTRPV1発現細胞に対する作用(承認年月日:2025年12月22日、CTD2.6.2.2)
- 社内資料:ドライアイモデルラットに対する瞬目回数増加の抑制作用(承認年月日:2025年12月22日、CTD2.6.2.2)
- 社内資料:ドライアイモデルラットに対する他覚所見改善作用(承認年月日:2025年12月22日、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
千寿製薬株式会社
カスタマーサポート室 受付時間 9:00〜17:30(土、日、祝日を除く)
〒541-0048
大阪市中央区瓦町三丁目1番9号
電話:0120-069-618
FAX:06-6201-0577
製品情報問い合わせ先
千寿製薬株式会社
カスタマーサポート室 受付時間 9:00〜17:30(土、日、祝日を除く)
〒541-0048
大阪市中央区瓦町三丁目1番9号
電話:0120-069-618
FAX:06-6201-0577
26. 製造販売業者等
26.1 製造販売元
千寿製薬株式会社
大阪市中央区瓦町三丁目1番9号
26.2 販売
武田薬品工業株式会社
大阪市中央区道修町四丁目1番1号