医薬品情報
| 総称名 | テルネリン |
|---|---|
| 一般名 | チザニジン塩酸塩 |
| 欧文一般名 | Tizanidine Hydrochloride |
| 製剤名 | チザニジン塩酸塩製剤 |
| 薬効分類名 | 筋緊張緩和剤 |
| 薬効分類番号 | 1249 |
| ATCコード | M03BX02 |
| KEGG DRUG |
D00776
チザニジン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年7月 改訂(第2版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| テルネリン顆粒0.2% | Ternelin Granules | サンファーマ | 1249010D1025 | 18.1円/g | 処方箋医薬品注) |
| テルネリン錠1mg | Ternelin Tablets | サンファーマ | 1249010F1026 | 8.1円/錠 | 処方箋医薬品注) |
2. 禁忌
4. 効能または効果
○下記疾患による筋緊張状態の改善
頸肩腕症候群、腰痛症
○下記疾患による痙性麻痺
6. 用法及び用量
<筋緊張状態の改善>
通常成人には、チザニジンとして3mgを1日3回に分けて食後に経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
<痙性麻痺>
通常成人には、チザニジンとして1日3mgより投与を始め、効果をみながら1日6〜9mgまで漸増し、1日3回に分けて食後に経口投与する。
なお、年齢、症状により適宜増減する。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
反射運動能力の低下、眠気、めまい及び低血圧等があらわれることがあるので、本剤投与中の患者には自動車の運転等危険を伴う機械の操作には従事させないよう十分注意すること。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。本剤は主として肝で代謝される。また、肝機能の悪化が報告されている。[2.3参照]
9.3.2 肝障害のある患者(重篤な肝障害のある患者を除く)
本剤は主として肝で代謝される。また、肝機能の悪化が報告されている。[11.1.5参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で、大量投与(100mg/kg)により奇形(脳ヘルニア、小眼球)の増加及び10〜30mg/kg投与により胎児重量の低下、化骨遅延、出生児の死亡等が報告されている。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中へ移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
10. 相互作用
相互作用序文
本剤は主として肝代謝酵素チトクロームP450(CYP)1A2で代謝されるので、本酵素の活性に影響を与える薬剤を併用する場合には注意すること。特にCYP1A2を阻害する薬剤との併用により、本剤の血中濃度が上昇する可能性がある。また、CYP1A2を誘導する薬剤との併用により、本剤の血中濃度が低下する可能性がある。
薬物代謝酵素用語
CYP1A2
10.1 併用禁忌
| フルボキサミン (ルボックス、デプロメール) シプロフロキサシン (シプロキサン等) [2.2参照] | フルボキサミン又はシプロフロキサシンとの併用により、本剤の血中濃度が上昇し、AUCがそれぞれ33倍、10倍に上昇したとの報告がある。 臨床症状として、著しい血圧低下、傾眠、めまい及び精神運動能力の低下等があらわれることがあるので併用しないこと。 | これらの薬剤がCYP1A2を阻害し、本剤の血中濃度を上昇させると考えられる。 |
10.2 併用注意
| 降圧剤 降圧利尿剤等 [11.1.2参照] | 低血圧及び徐脈があらわれることがある。 | 本剤の中枢性α2刺激作用により降圧作用が増強されるため。 |
| 中枢神経抑制剤 アルコール | 眠気等の副作用が増強されるおそれがある。 | いずれも中枢神経抑制作用を有するため。 |
| 抗不整脈剤 アミオダロン メキシレチン プロパフェノン シメチジン ニューキノロン系抗菌剤 エノキサシン ノルフロキサシン 黄体・卵胞ホルモン剤 経口避妊薬 チクロピジン | 本剤の血中濃度が上昇し、副作用が増強されるおそれがある。 | これらの薬剤がCYP1A2を阻害し、本剤の血中濃度を上昇させる可能性がある。 |
| CYP1A2を誘導する薬剤 リファンピシン 喫煙等 | 本剤の血中濃度が低下し、本剤の作用が減弱するおそれがある。 リファンピシンとの併用により本剤の血中濃度が50%低下することがあるため、併用投与の必要がある場合には、慎重に用量調節(増量)を行うこと。 また、男性喫煙者(>10本/日)に本剤を投与したことにより、本剤のAUCが約30%減少したとの報告がある。 | これらの薬剤がCYP1A2を誘導することにより、本剤の血中濃度が低下し、本剤の治療効果が減弱するおそれがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)
血圧低下、徐脈、顔面蒼白、冷汗、呼吸困難、意識消失等があらわれることがある。
11.1.2 急激な血圧低下(頻度不明)
11.1.3 心不全(頻度不明)
心拡大、肺水腫等があらわれることがある。
11.1.4 呼吸障害(頻度不明)
喘鳴、喘息発作、呼吸困難等があらわれることがある。
11.1.5 肝炎、肝機能障害、黄疸(いずれも頻度不明)
AST、ALT等の著しい上昇、悪心・嘔吐、食欲不振、全身倦怠感等を伴う肝炎、肝機能障害、黄疸があらわれることがある。[9.3.2参照]
注)使用成績調査を含む
11.2 その他の副作用
| 0.1〜5%未満 | 0.1%未満 | 頻度不明 | |
| 循環器 | 血圧低下 | 徐脈、動悸 | 失神 |
| 精神神経系 | 眠気、頭痛・頭重感、めまい(回転性めまい、浮動性めまい)・ふらつき | 知覚異常(しびれ感等)、構音障害(ろれつがまわらない等)、不眠 | 幻覚、錯乱 |
| 消化器 | 口渇、悪心、食欲不振、胃部不快感、腹痛、下痢 | 胃もたれ、便秘、口内炎、舌のあれ、口中苦味感、流涎 | − |
| 肝臓 | AST、ALTの上昇 | ALPの上昇 | − |
| 過敏症 | 発疹、皮膚そう痒感 | 蕁麻疹、紅斑 | 血管性浮腫 |
| その他 | 脱力・倦怠感 | 浮腫、尿閉、霧視 | 眼瞼下垂 |
13. 過量投与
13.1 症状
悪心、嘔吐、血圧低下、徐脈、QT延長、めまい、縮瞳、呼吸窮迫、不穏、傾眠、昏睡等
13.2 処置
活性炭投与あるいは、強制利尿などにより薬物除去を行う。
14. 適用上の注意
14.1 薬剤交付時の注意
<錠>
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.2 非臨床試験に基づく情報
動物実験(サル)により精神依存の形成が示唆されたとの報告がある。
16. 薬物動態
16.1 血中濃度
健康成人にテルネリン錠1mgを2錠又は顆粒0.2%を1g(チザニジンとして2mg)それぞれ1回経口投与した場合の血漿中濃度の推移は次のとおりである。
また、薬物動態パラメータから両剤の生物学的同等性が確認された。
また、薬物動態パラメータから両剤の生物学的同等性が確認された。
| Tmax(h) | Cmax(ng/mL) | AUC0→10(ng・h/mL) | T1/2(h) | |
| 顆粒 | 0.75 | 1.75 | 4.84 | 1.51 |
| 錠剤 | 1 | 1.83 | 4.77 | 1.58 |
チザニジン2mg(テルネリン錠剤2錠又は顆粒剤1g)を1回投与後の血漿中濃度の推移(平均値±S.E.,n=24)
16.4 代謝
チザニジンは吸収後速やかに代謝され、主代謝経路はイミダゾリン環の酸化又は芳香環の酸化とそれに続くグルクロン酸抱合体あるいは硫酸抱合体の形成であった(外国人のデータ)。
16.5 排泄
健康成人に14Cチザニジン5mgを1回経口投与後の総放射能排泄率は尿中53.0%及び糞中23.2%であった(120時間値)。尿、糞中への未変化体の排泄はわずかであった(外国人のデータ)。
16.6 特定の背景を有する患者
17. 臨床成績
17.1 有効性及び安全性に関する試験
<筋緊張状態の改善>
17.1.1 国内一般臨床試験
頸肩腕部および腰背部の筋緊張性疼痛疾患患者387例を対象に本剤(錠剤)を2週間投与した結果、本剤の最終全般改善度は、「中等度改善」以上が55.8%、「軽度改善」以上が80.0%であった。
副作用発現率は、26例(6.7%)であった。主な副作用は、眠気8例(2.1%)、胃部不快感6例(1.6%)、めまい・ふらつき3例(0.8%)、発疹・発赤3例(0.8%)であった2)。
副作用発現率は、26例(6.7%)であった。主な副作用は、眠気8例(2.1%)、胃部不快感6例(1.6%)、めまい・ふらつき3例(0.8%)、発疹・発赤3例(0.8%)であった2)。
17.1.2 国内一般臨床試験
17.1.3 国内二重盲検試験
頸肩腕部および腰背部の筋緊張性疼痛疾患患者386例(本剤投与群193例、トルベリゾン投与群193例)を対象として、本剤1mg3錠とトルベリゾンのプラセボ錠6錠を併用して1日3回2週間経口投与した二重盲検比較試験の結果、全般改善度は、1週後では「中等度改善」以上で39.4%、「軽度改善」以上で70.6%であった。2週後では、「中等度改善」以上で57.9%、「軽度改善」以上で83.6%であり、両群間に有意差は認められなかったが、1週後に比べ2週後の改善率が高く、特に著明改善例が増加しており、本疾患に対しての有用性が高い薬剤であることが示された。
副作用発現率は、22例(11.9%)であった。主な副作用は、眠気10例(5.4%)、脱力感5例(2.7%)、悪心3例(1.6%)、下痢3例(1.6%)等であった5)。
副作用発現率は、22例(11.9%)であった。主な副作用は、眠気10例(5.4%)、脱力感5例(2.7%)、悪心3例(1.6%)、下痢3例(1.6%)等であった5)。
<痙性麻痺>
17.1.4 国内一般臨床試験
種々の脳性、脊髄性疾患に起因する痙性麻痺患者405例を対象に本剤を8週間以上投与した結果、本剤の最終全般改善度は、「中等度改善」以上の改善率が32.1%、「軽度改善」以上が76.3%であった。
副作用発現率は、64例(20.7%)であった。主な副作用は、眠気33例(8.1%)、口渇17例(4.2%)、脱力感15例(3.7%)、倦怠感11例(2.7%)等であった6)。
副作用発現率は、64例(20.7%)であった。主な副作用は、眠気33例(8.1%)、口渇17例(4.2%)、脱力感15例(3.7%)、倦怠感11例(2.7%)等であった6)。
17.1.5 国内一般臨床試験
17.1.6 国内二重盲検試験
脳性・脊髄性痙性麻痺患者226例(本剤投与群113例、トルベリゾン投与群113例)を対象として、本剤1mg錠とトルベリゾンのプラセボ錠を併用して1日3回4週間経口投与した二重盲検比較試験の結果、最終全般改善度は、「中等度改善」以上で19.1%、「軽度改善」以上で66.4%と対照薬との間に有意差はみられなかった。有用度は、「有用」以上で18.2%、「やや有用」以上で62.7%であり本剤が優れる傾向を示した。
副作用発現率は、22例(20.0%)であった。主な副作用は、口渇8例(7.3%)、眠気7例(6.4%)、めまい・ふらつき4例(3.6%)、悪心3例(2.7%)等であった9)。
副作用発現率は、22例(20.0%)であった。主な副作用は、口渇8例(7.3%)、眠気7例(6.4%)、めまい・ふらつき4例(3.6%)、悪心3例(2.7%)等であった9)。
18. 薬効薬理
18.1 作用機序
チザニジンは中枢性のアドレナリンα2作動効果を有し、脊髄及び脊髄上位中枢に作用して、固縮緩解作用、脊髄反射抑制作用等の筋緊張緩和作用を有する。
18.2 行動薬理学的検討
一般行動(サル)、斜面法(マウス)及び回転円筒法(マウス)等における行動観察により本剤の筋弛緩作用が認められる。
18.3 実験的固縮緩解作用
骨格筋の異常緊張モデルである貧血性除脳固縮(α-固縮)及び上丘・下丘間除脳固縮(γ-固縮)を緩解する(ラット)。
18.4 脊髄反射抑制作用
脊髄後根刺激による多シナプス反射電位を抑制するが、単シナプス反射電位を抑制する作用は弱い(ラット、ネコ)。
また、多シナプス反射の一つである脚の交差性伸展反射を抑制する(ヒヨコ)。
また、多シナプス反射の一つである脚の交差性伸展反射を抑制する(ヒヨコ)。
18.5 γ-運動ニューロンに対する抑制
筋紡錘を直接に抑制しないが、脊髄からのγ-運動ニューロンを抑制して二次的に筋紡錘の感度を低下する(ラット)。
18.6 抗侵害受容作用
侵害刺激に対する脊髄後角ニューロンの興奮を抑制するが、非侵害刺激に対する反応は抑制しない(ネコ)。
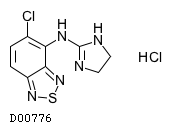
19. 有効成分に関する理化学的知見
19.1. チザニジン塩酸塩
20. 取扱い上の注意
<錠>
20.1 アルカリ性薬剤と配合しないこと。アルカリ性薬剤(アミノフィリン等)との配合により外観が黄色に変化することがある。
<顆粒>
20.2 アルカリ性薬剤、吸湿性の薬剤と配合しないこと。アルカリ性薬剤(アミノフィリン等)との配合により外観が黄色に変化することがある。また、吸湿性の薬剤との配合により固化することがある。
22. 包装
<テルネリン錠1mg>
100錠[10錠(PTP)×10]
500錠[10錠(PTP)×50]
1,000錠[10錠(PTP)×100]
1,000錠[瓶、バラ]
2,100錠[21錠(PTP)×100]
<テルネリン顆粒0.2%>
100g[瓶]
23. 主要文献
- Kirch, W.et al., In 3rd Europian Congr. Biopharmaceutics and Pharmacokinetics. Proc., 3, 6-10, (1987)
- 社内資料:国内一般臨床試験(頸肩腕症候群、腰痛症)に関する資料
- 山本龍二, 診療と新薬, 30 (1), 107-115, (1993)
- 田中 守, 新薬と臨床, 42 (2), 283-288, (1993)
- 青木虎吉ほか, 医学のあゆみ, 136 (4), 311-326, (1986)
- 社内資料:国内一般臨床試験(痙性麻痺)に関する資料
- 中島八十一, Prog. Med., 13 (2), 395-406, (1993)
- 橋本朋子ほか, 臨牀と研究, 70 (6), 1934-1944, (1993)
- 社内資料:国内二重盲検試験(痙性麻痺)に関する資料
24. 文献請求先及び問い合わせ先
文献請求先
サンファーマ株式会社
くすり相談センター
〒105-0011
東京都港区芝公園1-7-6
電話:0120-22-6880 受付時間:9時〜17時(土、日、祝日、その他当社の休業日を除く)
製品情報問い合わせ先
サンファーマ株式会社
くすり相談センター
〒105-0011
東京都港区芝公園1-7-6
電話:0120-22-6880 受付時間:9時〜17時(土、日、祝日、その他当社の休業日を除く)
26. 製造販売業者等
26.1 製造販売元
サンファーマ株式会社
東京都港区芝公園1-7-6